Химия и химические технологии/7. Неорганическая
химия
Долинина
А.С., Коробочкин В.В.
Национальный
исследовательский Томский политехнический университет, г.Томск, Россия
ЗАКОНОМЕРНОСТИ
ЭЛЕКТРОХИМИЧЕСКОГО СИНТЕЗА НАНОДИСПЕРСНЫХ ОКСИДОВ КАДМИЯ И МЕДИ В РАСТВОРАХ
ХЛОРИДОВ
Для
получения нанодисперсных оксидов кадмия и меди методом электрохимического
синтеза металлического кадмия и меди на переменном токе промышленной частоты
необходимо в первую очередь определить скорость процесса в зависимости от
параметров электролиза. Установлено, что наибольшее влияние
на скорость процесса образования фазовых оксидов металлов оказывают следующие
факторы: состав и концентрация электролита, температура электролиза и плотность
переменного тока [1].
Исследования кинетики электрохимического
окисления одновременно двух металлов кадмия и меди с использованием переменного тока промышленной
частоты проводились согласно методике, изложенной в работе [2]. В качестве
электролитов были использованы соли хлоридов натрия и аммония с концентрацией
от 3% до 25% мас. Эксперименты проводились при
температуре 100°С и варьировании плотности тока от 1 до 3 А/см2 .
Эксперименты
показали, что влияние температуры на скорость процесса менее значимо, чем
концентрации электролита: скорость процесса возрастает линейно с увеличением
температуры независимо от величины плотности тока, и достигает своего максимума
при температуре равной 100 ºС. Принимая во внимание это обстоятельство,
дальнейшие эксперименты по выявлению скорости процесса проводились при данной
температуре. Полученные результаты
представлены на рисунках 1, 2 и 3.
На рис. 1
представлены зависимости скорости
окисления кадмия и меди от
концентрации электролитов. Видно, что скорость окисления металлов с ростом концентрации
электролитов уменьшается. При этом в растворах хлорида аммония скорость выше,
чем в растворах хлорида натрия, примерно в 2 раза. Вместе с тем, скорость
окисления кадмия во всех случаях выше, чем для меди.
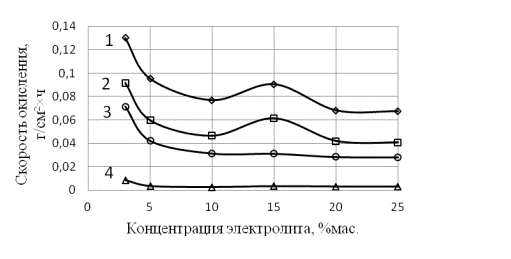
Рис.
1. Зависимости скорости окисления кадмия и меди от концентрации NaCl, NH4Cl
в растворе при плотности тока 2 А/см2 и температуре 100°С: 1-кадмий,
2-медь в растворе NH4Cl; 3- кадмий, 4-медь в растворе NaCl
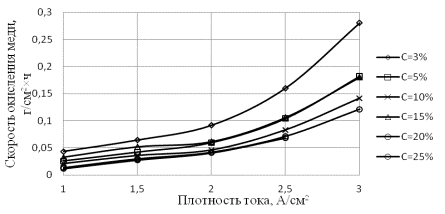
Рис.2. Зависимости скорости окисления меди от
плотности тока при различной концентрации хлорида аммония
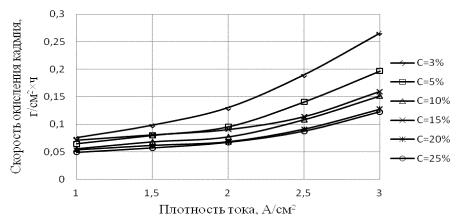
Рис.3. Зависимости скорости
окисления кадмия от плотности тока при различной концентрации хлорида аммония
Выбранный
интервал плотности тока обусловлен тем, что при плотности тока ниже 1 А/см2
скорость процесса низкая и не представляет практического интереса; при
плотности тока выше 3 А/см2 происходит интенсивный разогрев раствора
и его выкипание, что приводит к нарушению стабильного режима работы установки.
На рис. 2 и
3 представлены зависимости скорости окисления меди и кадмия от плотности тока
при различных концентрациях электролитов. Видно, что скорость окисления кадмия
под действием электролиза на переменном токе возрастает в интервале плотности
тока 1–3 А/см2 в 3–4 раза
при всех значениях концентраций NH4Cl
в растворе, а для меди в 6–8 раз при тех же условиях. Наибольшая интенсификация
процесса достигается при концентрации 3 % мас.
Литература
1. Косинцев В.И., Коробочкин В.В. Электрохимическое окисление
металлов под действием переменного тока. Препринт № 31. - Томск: Томский научный
центр СО АН СССР, 1998. -18 с.
2.
Коробочкин
В.В., Ханова Е.А. Определение количества окисленных титана, кадмия и меди при
электролизе на переменном токе // Заводская лаборатория. Диагностика
материалов. 2005. №6, Т.71. С. 20-23.