Дунаев П.Д.,
Иванкова А.В., Бойчук С.В., Мустафин И.Г.
Казанский
государственный медицинский университет, Россия
Механизмы вирусной репликации и
апоптоза лимфоцитов при ВИЧ-инфекции in vitro
Актуальность.
Патогенез иммунологический нарушений,
возникающих при ВИЧ-инфекции остается до конца не изученным и обуславливает
проведение экспериментальных исследований. Показано, что в развития
иммунодефицита при данном заболевании важное значение играют биологически
активные вещества, вырабатывающиеся в ходе иммунного ответа – цитокины, в
частности ИЛ-2, ИЛ-4, ИЛ-7 и ФНО-α [2; 4; 6]. В связи с этим, цель настоящего исследования – изучить роль ИЛ-2, ИЛ-4, ИЛ-7 и ФНО-α в
регуляции процессов вирусной репликации
и апоптоза лимфоцитов при ВИЧ-инфекции.
Материалы и методы исследования.
Мононуклеарные клетки периферической крови
выделяли центрифугированием на градиенте плотности раствора Фиколл-Пак. Клетки вносили
в лунки плоскодонных планшетов и культивировали в течение 11 дней в среде RPMI 1640 с добавлением: L-глутамина, эмбриональной телячьей сыворотки,
антибиотиков. К культурам лимфоцитов (Лф) вносили цитокины ИЛ-2, ИЛ-4, ИЛ-7 и ФНО-α в физиологических
концентрациях [1; 3; 5]. В отдельные
плоскодонные планшеты помещали МНПК с целью моделирования ВИЧ-инфекции in vitro. Инфицирование
клеточных культур производили сразу же в 1-й день, через 2 часа после
добавления цитокинов. Для инфицирования использовался лабораторный штамм ВИЧ-1 NL4-3 (NIH Res&Reag. Prog., США). Количество инфицированных Лф (клеток с активной
вирусной репликацией) определяли методом проточной цитометрии по
внутриклеточному содержанию вирусного белка р24gag. Репликацию ВИЧ-1
оценивали методом ИФА по уровню белка р24gag в супернатантах
клеточных культур. Апоптоз Лф оценивали методом проточной цитометрии по параметрам:
1) снижение величины трансмембранного митохондриального потенциала
(ΔΨm) – флюорохром DiOC6;
2) повышение экспрессии молекул фосфатидилсерина (ФС) – флюорохромы MC 540 и Ann V-FITC.
Результаты.
Внесение ВИЧ-1 в культуры Лф,
инкубированные в отсутствии цитокинов не приводило к его репликации. После
внесения ВИЧ-1 в культуры Лф, инкубированные с цитокинами, отмечалась вирусная
репликация (р<0,001). Пик репликации ВИЧ-1 наблюдался на 6 день
культивирования. Наиболее эффективными индукторами вирусной репликации являлись
ИЛ-7 и ИЛ-2.
Цитокины в отсутствии
инфицирования ВИЧ-1 поддерживали жизнеспособность Лф в культуре. Напротив, в
инфицированных ВИЧ-1 культурах цитокины индуцировали гибель Лф: количество клеток
стремительно уменьшалось в процессе
культивирования (р<0,001). В данном
случае гибель Лф происходила по механизму апоптоза. В присутствии цитокинов Лф с признаками апоптоза было достоверно
больше в инфицированных культурах, чем в неинфицированных (р<0,001).
Наиболее эффективным индуктором апоптоза Лф являлся ФНО-α (см. Рис. 1).
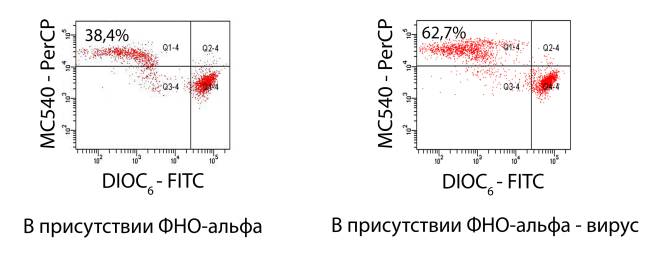
Рис. 1. Апоптоз лимфоцитов в
неинфицированных и инфицированных ВИЧ-1 культурах, инкубированных в присутствии
ФНО-α – 6 день культивирования.
Лимфоциты с признаками апоптоза (в %) – в левом верхнем квадрате.
Проведенные исследования выявили, что в
инфицированных культурах в присутствии цитокинов (ИЛ-2 и ИЛ-7) по механизму
апоптоза погибали преимущественно неинфицированные Лф, в то время как Лф с
активной репликацией вируса оставались жизнеспособными
Заключение.
Цитокины ИЛ-2, ИЛ-4, ИЛ-7
и ФНО-α in vitro индуцируют репликацию
ВИЧ-1 в Лф, а также способствуют гибели неинфицированной популяции Лф по
механизму апоптоза. При этом цитокины поддерживают жизнеспособность инфицированных
Лф, тем самым способствуя репликации ВИЧ-1. Следовательно, цитокины ИЛ-2, ИЛ-4, ИЛ-7 и ФНО-α в норме являющиеся
факторами, направленными на поддержание гомеостаза иммунной системы и
формирование иммунного ответа, при ВИЧ-инфекции могут играть противоположную
негативную роль, обуславливающую прогрессирование заболевания. Полученные
результаты являются предпосылками для дальнейшего экспериментального изучения
механизмов иммунологических нарушений, возникающих при ВИЧ-инфекции. В
частности, актуальной задачей является изучение свойств белков ВИЧ-1. Показано,
что белки вируса способны индуцировать гибель неинфицированных СD4+Т-Лф
по механизму апоптоза. Вирусные белки запускают в неинфицированные СD4+Т-Лф программу апоптоза при контактном
взаимодействии с ними. Механизмы действия данных белков весьма разнообразны. В
частности, некоторые из них (вирусные белки Env, Nef, Tat) способны
индуцировать активацию Лф и, следовательно, повышать чувствительность данных
клеток к развитию активационного
апоптоза [7, 8].
Литература:
1. Дунаев П.Д., Иванкова
А.В., Бойчук С.В., Мустафин И.Г. Исследование роли цитокинов в патогенезе
ВИЧ-инфекции // ВИЧ-инфекция и иммуносупрессии. – 2010. – Т.2, №3. – С. 55-57.
2. Дунаев П.Д., Бойчук
С.В., Мустафин И.Г. Свойства и роль фактора некроза опухолей альфа в патогенезе
ВИЧ-инфекции // Казанский медицинский журнал. – 2012. – Т. 93, № 2. – С.
290-293.
3. Unutmaz D., KewalRamani V.N.,
Marmon S. et al. Cytokine signals are sufficient for HIV-1 infection of resting
human T lymphocytes //J. Exp. Med. – 1999. – Vol. 189, № 11. – P. 1735- 1746.
4. Sirskij D., Theze J., Kumar A. et al. Disruption of the γc cytokine network in T cells during HIV infection
// Cytokine. – 2008. – Vol. 43, № 8. – P. 1-14.
5. Chun T.W. , Engel D., Mizell S.B. et al. Induction of HIV-1 replication in latently infected CD4+T
cells using a combination of cytokines // J. Exp. Med. – 1998. – Vol. 188, № 1. – P.
83-91.
6.
Vandergeeten C., Fromentin R., Chomont. N. The role of cytokines in the
establishment, persistence and eradication of the HIV reservoir // Cytokine
& Growth Factor Reviews. – 2012. – Vol. 23, № 4-5. – P. 143-149.
7. James C.O., Huang M.B., Khan M.
et al. Extracellular Nef protein targets CD4+T cells for apoptosis by
interacting with CXCR4 surface receptors // J. Virol. – 2004. – Vol. 78, № 6. – P. 3099-3109.
8. Shedlock D.J., Hwang D., Choo A.Y. et al. HIV-1 viral genes and
mitochondrial apoptosis // Apoptosis. – 2008. – Vol. 13, № 9. – P. 1088-1099.