Медицина/7.Клиническая медицина.
Дубровина-Парус
Т.А.
ГУ
«Крымский государственный медицинский университет имени С.И. Георгиевского» Украина
Биосовместимость материалов для пломбирования корневого канала,
используемых в современном эндодонтическом лечении.
Актуальность темы:
Доказано,
что материалы, которые используются для пломбирования корневого канала
контактируют с периапикальными тканями
и тканями периодонта как через апикальное отверстие, так и через дентинные
канальцы и дельтовидные ответвления. Реакция этих тканей на материалы в
значительной степени определяет исход эндодонтического лечения.
Биосовместимость эндодонтических материалов характеризуется многими
параметрами, такими как генотоксичность, мутагенность, карциногенность,
цитотоксичность, гистосовместимость и индифферентность к тканям организма
микробиологические эффекты.
Целью нашего
исследования было провести сравнительную характеристику материалов для
пломбирования корневых каналов и их биосовместимость с периапикальными тканями
и тканями корневого канала.
Материалы и методы:
В исследовании были использованы твердые
пломбировочные материалы: гуттаперчивые штифты, стеклоиономерные цементы и пасты: цинк-оксид-эвгеноловые, на основе
гидроокиси кальция, содержащие формальдегид, полимеры. Биологическую
характеристику пломбировочным материалам невозможно дать при помощи только
одного метода исследования. Более информативным является использование
различных тестов in vitro и in vivo:
- Неспецифическая
токсичность (клеточные культуры и лабораторные животные, например крысы).
- Специфическая
токсичность (тесты применения, например на приматах).
- Клиническое
тестирование на людях.
На основании
совокупности нижеизложенных тестов in vitro и in vivo и их отдаленных результатов
нами были разработаны коэффициенты биологической совместимости и токсичности
для каждого из исследуемых материалов (рис. 1). Чем выше числовое значение
коэффициента, тем более биосовместим материал. Коэффициент токсичности обратно
пропорционален коэффициенту биосовместимости.
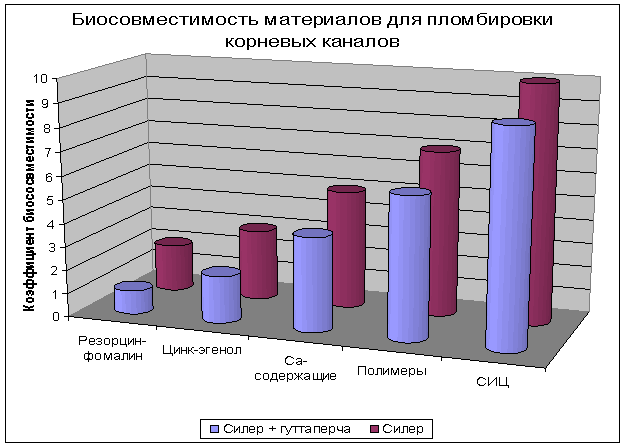
Рис. 1.
Результаты исследования и их обсуждение:
Гуттаперча - это основной пломбировочный материал,
используемый при лечении корневого канала, несмотря на то, что она образует
только примерно 20 % состава современных гуттаперчевых штифтов. Оксид цинка является
главным компонентом (60-70%) штифта и обеспечивает большую часть
рентгеноконтрастности. Оставшиеся 10% не специфичны, т.к. не представляют собой
патентованную информацию, а состоят из смеси пластмасс, восков и сульфатов
металлов (Spеngberg 1999). Гуттаперчевые штифты используются в сочетании с
цементом, который необходим для заполнения пространств между штифтом и стенкой
корневого канала, заполняя неровности канала и боковые канальцы.
Считается,
что гуттаперча имеет приемлемую биосовместимость с низкой степенью токсичности.
Эта точка зрения основана на находках в исследованиях на животных, включающих
имплантирование кусочков гуттаперчи (Spеngberg 1969a, Wolfson & Seltzer
1975). Эти исследования описывают образование коллагеновой капсулы вокруг имплантатов
с очень небольшой реакцией воспаления организма хозяина или с ее отсутствием.
Однако, как было доказано, гуттаперчевые штифты обладают слабой
цитотоксичностью в тестах in vitro, что связано с водорастворимыми веществами,
которые высвобождаются, когда гуттаперча распадается на небольшие отдельные
фракции. Однако, именно пасты (силеры) являются наиболее токсичным элементом
корневой пломбы.
Цинк-оксид-эвгеноловые пасты - эти силеры просто
представляют собой цинк-оксид-эвгеноловые (ZnOE) цементы, модифицированные для
эндодонтического использования. Жидкостью для этих материалов является эвгенол,
в то время как порошок содержит мелко просеянный ZnO, для повышения текучести
цемента. В исследовании Serene et al. (1988) было обнаружено, что ZnO силеры
активируют иммунную систему комплимента и, следовательно, реакцию воспаления.
Кроме того, Guigand et al. (1999) обнаружил, что эти силеры оказывают сильный
цитотоксический эффект на культуры фибробластов. Эти свойства связывают главным
образом с эвгеноловым компонентом. Однако, ZnOE силеры легко предоставляют себя
для добавления химикатов, которые могут содействовать их цитотоксичности.
Канифоль или Канадский бальзам добавляется для более лучшей адгезии к дентину,
параформальдегид для антимикробного и мумифицирующего эффектов, антимикробные
препараты для антисептического действия и кортикостероиды для подавления
воспаления.
Оксид цинка
эффективен как антимикробный агент (Sunzel et al. 1990), и уже доказано, что он
обеспечивает цитопротекцию клеток тканей. Взаимодействующие токсические эффекты
между цинком и канифолью или смоляной кислотой исследовались с использованием
полиморфноядерных лейкоцитов и фибробластов десны человека. Канифоль и смоляные
кислоты оказались, высоко токсичными, в зависимости от их концентрации.
Добавление цинка заметно уменьшало токсичность канифоли и смоляной кислоты,
пропорционально с увеличением концентрации цинка (Sunzel et al. 1997). Коэффициент биологической совместимости – 3
Силеры, содержащие гидроокись кальция - силеры на основе гидроокиси
кальция в основном характеризуются, как обладающие хорошей цитосовместимостью.
Несколько силеров, например Sealapex и Apexit было выпущено на рынок с
заявлением о выгодах биологических эффектов от добавления Ca(OH)2.
Для того, чтобы оказывать лечебное воздействие, гидроокись кальция должна
диссоциировать на ионы Ca2+ и ОН-. Следовательно, чтобы
оказывать терапевтический эффект, эндодонтический силер на основе гидроокиси
кальция должен выделять эти ионы, что может повредить структурную целостность
силера и поставить под вопрос долгосрочную герметизацию. В исследованиях in
vivo было продемонстрировано, что Sealapex и Apexit легко распадаются в тканях
(Soares et al. 1990), за счет диффузии ОН - из корневых каналов, что может способствовать размножению и
проникновению микроорганизмов в ткани периодонта, способствующих
периапикальному воспалению.
Коэффициент биологической совместимости - 4
Силеры, содержащие формальдегид - большая группа
силеров/цементов, включающая часто применяемые Endomethasone и Foredent, содержит в своем
составе значительное количество paraformaldehyde. Из них Foredent
наиболее изучен. Состав Foredent не сильно отличается от
других параформальдегид-содержащих силеров, в том что касается токсичности, и
его основа - это цинк-оксид эвгенольный силер. Он хорошо герметизирует, когда
применяется вместе со штифтом (Brown et al. 1979).
Было
обнаружено, что Foredent очень токсичен к
периапикальным тканям. Коагуляционый некроз обычно наблюдается в течение очень
короткого периода времени, и достигает максимума менее чем за 3 дня. После
того, как ткань пропитается формальдегидом, заживление некроза будет
представлять собой медленный процесс, часто занимающий месяцы. Как только
формальдегид вымывается из некротической ткани (Block et al. 1980, Araki et al.
1993b), следует или бактериальная инвазия, или, если ткань хорошо снабжается
кровью, восстановление (Spangberg 1969a, 1974). В клинических условиях, эта
неблагоприятная реакция ткани может выглядеть, как локализованные
воспалительные реакции в периапикальной ткани (Engstrom & Spangberg 1969b).
Коэффициент биологической совместимости - 2
Полимеры - большинство современных силеров на рынке - это
полимеры. Они включают в себя силеры на основе эпоксидной смолы, например, AH26
и AH Plus. Умеренная цитотоксическая
реакция на свежеприготовленный АН26
связана с высвобождением формальдегида, который образуется как побочный
продукт процесса полимеризации. Поскольку для полимеризации АН26 необходимо
некоторое время, у пациентов может появляться некоторая степень
чувствительности, которая может быть связана с его использованием. Как было
показано, АН Plus высвобождает лишь небольшое количество формальдегида (3,9
мг/кг) по сравнению с АН26 (1347 мг/кг), следовательно обладает меньшей цитотоксичностью, хотя она
значительно снижается после отверждения материала. Выделение формальдегида
уменьшается после отвердевания в течение 48 часов. Также было обнаружено, что
AH Plus обладает большей избирательной антимикробной активностью, особенно
против Porphyromonas endodontalis , что опять же связано с выделением
формальдегида в первоначальный период после замешивания.
Коэффициент биологической совместимости -7
Стеклоиономерные силеры - Ketac-Endo
- стеклоиономерный цемент, модифицированный для эндодонтического применения,
известен тем, что вызывает незначительное раздражение ткани (Zetterqvist et al.
1987, Zetterqvist et al.
1988) и обладает низкой токсичностью in vitro
(Pissiotis et al.
1991). Kolokuris et al. (1996) имплантировали Ketac-Endo в тефлоновых трубках в
подкожные ткани крысам. В течение 5 дней после имплантации наблюдалась
умеренная воспалительная реакция. Интенсивность реакции воспаления уменьшилась
на 15 день, и это ослабление постепенно продолжалось втечение 60 дней и 120
дней, что показывает хорошую биосовместимость. Ketac-Endo продемонстрировал
небольшой цитотоксический эффект на L-929 клетки после затвердевания через 24 ч
и 1 неделю, соответственно, и показал отсутствие мутагенной активности в Ames
test (Ersev et al. 1999). А также,
продемонстрировал высокую антибактериальную активность в отношении
Enterococcus faecalis, спустя 24 часа, с увеличением активности через 7 дней
(Heling & Chandler 1996). В исследовании Leonardo et al. (2000), Ketac-Endo
проявил антибактериальные свойства по отношению ко всем 7 тестируемым
бактериальным штаммам. Однако, описывается благоприятный ответ периапикальных
тканей при отсутствии инфекции в корневом канале ( Zetterqvist et al. 1991).
Коэффициент биологической совместимости -10
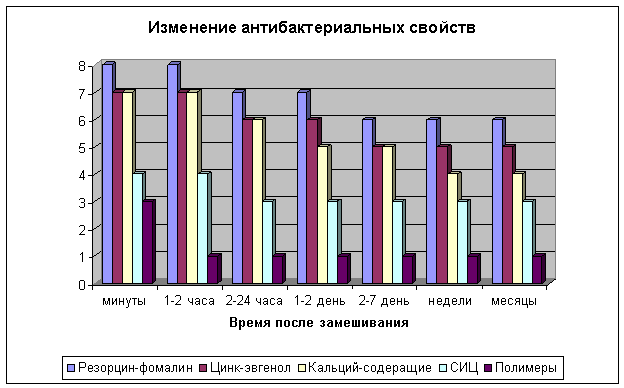
Рис. 3.
Таким
образом:
1. Результаты
экспериментов in vitro и in vivo показали, что биологические свойства
материалов для пломбирования корневых каналов значительно различаются. При
выборе пломбировочного материла биологические свойства не менее важны, чем
механические и физические. Положительные биологические свойства
(противовоспалительные, остеотропные, антибактериальные) способствуют
скорейшему выздоровлению и препятствуют развитию осложнений. Тогда как
отрицательные биологические свойства, такие как цитотоксичность, мутагенность,
канцерогенность, способны не только привести к осложнениям, но составить угрозу
для жизни пациента.
2. Как
положительные, так и отрицательные биологические свойства материалов изменяются
с течением времени, причём скорость изменения этих свойств различна.. Так
полимеры имеют высочайшую токсичность в первые часы замешивания и очень низкую
уже через сутки после замешивания; кальцийсодержащие материалы обладают средней
токсичностью во время замешивания, которая сохраняется на протяжении нескольких
суток и исчезает к концу первой недели; резорцин-формалин обладает средней
токсичность непосредственно после замешивания, которую сохраняет на протяжении
всего лечения; стеклоиономерные цементы обладают низкой токсичностью на
протяжении всего лечения. Биологические свойства тоже изменяются с течением
времени с разной скоростью у различных материалов.
·
Цементы
на основе (ZnOE) обладают хорошим прилеганием к стенкам корневого
канала, хорошим антисептическим пртивовоспалительным действием, но не исключено
токсическое и аллергенное действие на ткани организма компонентов пасты при
контакте с тканями периодонта, рассасывание пасты в корневом канале.
·
Материалы
на основе Ca(OH)2 способны регулировать процессы регенерации в
тканях пародонта, но обладают большой растворимостью и, следовательно,
значительной вероятностью рассасывания материала в корневом канале.
·
Полимеры
– в целом инертны к тканям периодонта, стабильны в канале, устойчивы к влаге,
термостойки что дает возможность использовать эти материалы при работе с горячей
гуттаперчей, но полимеризационная усадка достаточно высока, из-за которой эти
материалы должны применятся только с гуттаперчивыми штифтами.
·
Силлеры
содержащие формальдегид обладают сильным антисептическим действием, но высоко токсичны и оказывают раздражающее
действие на ткани периодонта.
·
Стеклоиономерные
цементы, следуя результатам наших наблюдений, обладают наибольшей биологической
совместимостью и стабильностью, но так же имеют отрицательное свойство:
трудность выведения из корневого канала
в случае необходимости.
3. Оценка
биологических свойств любого материала должна проводиться с позиций
доказательной медицины: любой биологический эффект дожжен быть доказан в серии
экспериментов in vitro и in vivo с достаточной статистической базой.
4. Выбор
материала должен осуществляться индивидуально в каждой конкретной клинической
ситуации, на основании его положительных и отрицательных биологических свойств,
их временной динамики, и желаемого терапевтического эффекта.
Выводы:
1. Нами было установлено,
что наибольшей биологической совместимостью обладают стеклоиономерные
цементы и полимеры, а наибольшей токсичностью - цинк-эвгенол и
резорцин-формалиновая паста.
2. Повышение токсичности
корневой пломбы за счет гуттаперчи клинически не существенно, но гуттаперча
значительно улучшает ее физико-механические свойства. Поэтому целесообразнее
использовать силер в сочетании с гуттаперчей.
3. Различные материалы
обладают различным балансом положительных и отрицательных биологических
свойств, и не существует идеального материала для пломбирования корневых
каналов. Поэтому выбор материала должен осуществляться индивидуально в каждой
конкретной клинической ситуации. А положительные эффекты от использования
материала должны преобладать над возможными негативным последствиями.
Литература:
1. Kishor
Gulabivala . Исследования в эндодонтии за последние 10 лет
(1998- 2008) //Эндодонтическая практика. – 2008. – вып.3 № 1. – С. 51-55.
2. Боровский Е.В.
Лечение периодонтитов: состояние вопроса и перс пек-тивы
совершенствования // Стоматология.
Спец. Выпуск. Материалы 3-го съезда
Стоматологической ассоциации.-Москва, 1996. – С. 38-39.
3. Левченко Г.В.
Оцінка ефективності ендодонтичного лікування при удосконаленому препаруванні
кореневих каналів зубів: Автореф. Дис.. канд.. мед. наук: Київ, 2003. – 22 с.
4. Николаев А.И., Цепов Л.М. Практическая
терапевтическая стоматология// Москва .- 2007.-С.702-718
5. Alhadainy HA, Himel VT (1993) Evaluation of the sealing ability of
amalgam, Cavit and glass ionomer cement in the repair of furcation perforation.
Oral Surgery, Oral Medicine and Oral Pathology 75, 362-6.