УДК 541.13
Электрохимические
и фотоэлектрохимические реакции теллура и селена при восстановлении на
стеклоуглеродном электроде.
М.Б.Дергачева,
Н.В.Пенькова, К.А.Маева, К.А.Уразов
Институт
органического катализа и электрохимии им. Д.В.Сокольского
Алматы
050010 Кунаева 142 E-mail: m_dergacheva@nursat.kz
Процессы фотостимулированного переноса заряда на
границе раздела полупроводник- электролит привлекают все большее внимание в
связи с необходимостью решения ряда фундаментальных и прикладных задач современной
электрохимии, физической химии и физики поверхности полупроводников. Среди этих
задач можно выделить такие, как выяснение закономерностей строения межфазной
границы раздела и кинетики электрохимических реакций, стимулированных
освещением, проблемы адсорбции и фотокатализа, преобразование солнечной
энергии, фотоэлектрохимических методов формирования поверхности полупроводников
и контроля их характеристик. Особенности протекания этих процессов на
полупроводниках связаны со спецификой строения межфазной границы раздела,
характеризующейся наличием относительно протяженной области пространственного
заряда у поверхности электрода, где происходит разделение фотогенерированных
носителей заряда, и узкой области локализации заряда в ионной обкладке двойного
слоя для концентрированных растворов электролитов./1,2/
Электрохимические
реакции теллура и селена, протекающие под действием светового облучения
интенсивно исследуются в последние десятилетия. Теллур и селен являются
компонентами двойных и тройных полупроводников, таких как CdTe,
CdSe, CuInSe2 и других более сложных соединений.
Электросинтез таких соединений позволяет резко понизить стоимость производства
фотопреобразователей солнечной энергии. Электрохимическое поведение ионов Te(IV) и Se(IV) при восстановлении на твердых
электродах в кислых водных средах в основном состоит из двух стадий:
восстановление до элементного
металла (Te0) и далее до двухвалентных ионов(Te-2). Эти процессы могут
быть осложнены адсорбцией и гомогенными химическими реакциями. Исследования
показывают, что электрохимическое поведение и профиль вольтамперных кривых
существенно зависят от природы электрода или электродной подложки, на которую
производится электроосаждение /3-9/.
Фотоэффект в электрохимических системах давно
признанное явление, которое заключается в появлении дополнительного тока,
стимулируемого падающим светом, названное эффектом Беккереля по имени его
открывателя. Фотоэлектрический эффект, лежащий в основе работы
полупроводникового фотоэлемента, состоит в том, что в веществе при облучении
светом связанные электроны из валентной зоны переходят в зону проводимости. На
их месте образуются вакансии-дырки. Р-n переход обладает
встроенным электрическим полем, которое оттягивает электроны в сторону
полупроводника n-типа. Электроны и дырки пространственно
разделяются и не могут рекомбинировать. В последние 20 лет фотоэлектрохимия с
полупроводниковыми электродами достигла больших успехов благодаря использованию
жидкостных соединений солнечных элементов /10/.
Фотоэлектрохимия подчеркивает, что свойства
твердого состояния очень важны для
электрохимического поведения. Теллур и селен относятся к тому типу
полупроводников, которые хорошо абсорбируют световое излучение с энергией hν
и генерируют дополнительные электроны в
валентной зоне.
hν →
е - + h+
В результате ток при постоянном потенциале
изменяется и возрастает при протекании электрохимической реакции на поверхности
раздела электрод/электролит /6,7/.
В настоящей работе использованы методы
вольтамперометрии и хроноамперометрии при постоянном потенциале в условиях электроосаждения Te0, Se0, CdTe,
CdSe в темноте и при освещении для доказательства влияния света
на эффективность процесса электросинтеза полупроводников.
Mетодика эксперимента
Было проведено исследование электрохимических
процессов, протекающих на стеклоуглеродном электроде при осаждении теллура (IV)
и теллурида кадмия, а так же селена (IV) и селенида кадмия под
действием освещения с использованием
метода вольтамперометрии. Вольтамперные кривые были получены со скоростью
развертки потенциала 20мВ/сек. Измерения проводили в термостатируемой
трехэлектродной ячейке, представляющей собой герметичный сосуд из кварцевого
стекла, с разделенными анодным и катодным пространствами. Использовали дисковый
стеклоуглеродный электрод с видимой поверхностью 0,078 см2.
Электроосаждение при постоянном потенциале выполняли на стеклоуглеродную (или титановую) пластину с рабочей
поверхностью 1,0 см2. В качестве вспомогательного электрода
использовалась платиновая спираль с большой поверхностью (1,5 см2).
Электродом сравнения служил хлорсеребряный электрод в насыщенном растворе КС1.
Все экспериментально полученные значения потенциалов в данной работе приведены
относительно этого электрода сравнения.
Фоновым электролитом служил водный раствор
состава 0,45 М Na2SO4+0,05 M
H2SO4, рН=1,6. В качестве
источников ионов теллура (IV), селена (IV),
кадмия (II) использовались
исходные водные растворы солей теллурита калия, с концентрацией СТе=2×10-2М,
раствор соли селена NaHSeO3, с концентрацией СSe=2×10-3М,
раствор сульфата кадмия с концентрацией СCd=1×10-2М,
соответственно. Ячейка термостатировалась, поддерживалась постоянная температура 22 ±1 0С.
При выполнении электрохимических
исследований был использован
потенциостат IPC-pro. Раствор электролита перемешивали при
помощи магнитной мешалки ММ3М.
Освещение проводилось при помощи галогеновой
лампы марки Philips, 50 ватт, диметром 51 мм.

Трехэлектродная
электрохимическая ячейка
Результаты
и обсуждение
Исследовалось электрохимическое восстановление
ионов теллура(IV) на стеклоуглеродном электроде методом вольт амперометрии с
линейной разверткой потенциала и
записью циклических кривых от 0 до -1000мВ и при обратной развертке до
+1000мВ, а также поведение его осадков
в «темноте» и при освещении
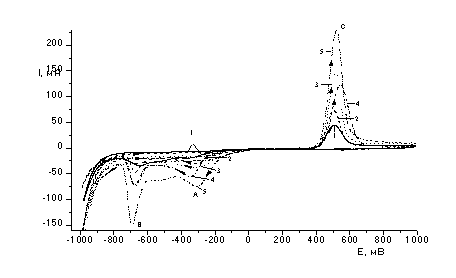
Эл-т: 0,45 М Na2SO4+0,05 M H2SO4; t=25
ºС,. Обозначения
кривых:
1) CТе =5×10-4 М; 2) CТе = 1×10-3 М; 3)
CТе = 1,5×10-3 М; 4)
CТе = 2×10-3 М;; 5) CТе = 3×10-3 М;
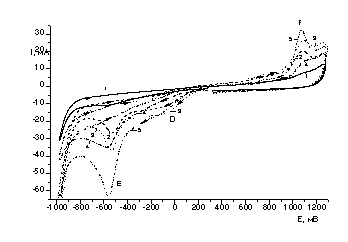
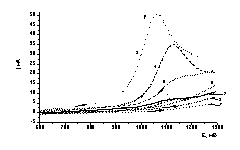
Рисунок 1
– Вольтамперные кривые восстановления-окисления Те (IV) в сернокислом
электролите на дисковом стеклоуглеродном электроде при различных концентрациях
теллура
Было установлено, что первый пик(А)
восстановленияTe(IV) наблюдается при потенциалах (-300
÷ -350 мВ) и соответствует электрохимической реакции (1). При увеличении концентрации ионов теллура
максимум тока пика электровосстановления Те (IV) до Те (0) сдвигается в область
более положительных потенциалов (рис. 1).
Также с увеличением концентрации ионов теллура возрастает величина
предельного тока восстановления по уравнению (1). Наблюдается пропорциональная
зависимость тока восстановления от концентрации ионов теллура в электролите.
Ток второго пика (В) также возрастает.(рис.2) и соответствует электрохимической
реакции(2) образования теллурид ионов. При обратной развертке потенциала
наблюдается анодный ток окисления теллура, оставшегося на электроде, который
также увеличивается при увеличении концентрации ионов теллура(IV) в электролите.
TeO32- + 6H+ +
4e → Te +
3H2O (1)
2Te +
2e → Te22- (2)
Te
- 4e + H2O → TeO32- + 6H+
(3)
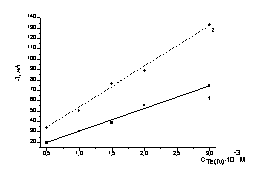
Фоновый
электролит: 0,45 М Na2SO4+0,05 M
H2SO4
Обозначение
кривых: 1 – первый пик восстановления при Е= -0,35 В;
2
– второй пик восстановления при Е= -0,66 В
Рисунок 2 – Зависимость величины тока пиков
восстановления от концентрации Те (IV).
На
рисунке 3 показаны циклические вольтамперные
кривые восстановления Те (IV)
при различных скоростях развёртки потенциала. При увеличении скорости развертки потенциала прямо пропорционально
увеличиваются величины токов восстановления Те (IV).и окисления Те(0) с
поверхности электрода.
Эл-т:
0,45 М Na2SO4+0,05 M
H2SO4; СТе=2×10-3 М.
1-3 - скорости развёртки потенциалов: 1)
20 мВ/с; 2) 10мВ/с; 3) 5 мВ/с
Рисунок
3 – Вольтамперные кривые
восстановления- окисления Те (IV) в сернокислом водном электролите при
различной скорости развёртки
Снятие циклических вольт-амперных кривых на не
обновляемом электроде показало, что в катодной области с увеличением числа
циклов, в соответствии с рисунком 4, наблюдается сдвиг потенциала
восстановления Те (IV) до Те (0) в положительную область, что объясняется
выигрышем энергии кристаллизации за счет восстановления Те (IV) на поверхности
электрода, уже покрытого теллуром. Потенциал пика дальнейшего восстановления Те
(0) до Те (-2) согласно уравнению (2) не изменяется. Однако токи восстановления
уменьшаются за счет накопления теллура на электроде и уменьшения проводимости
электрода.
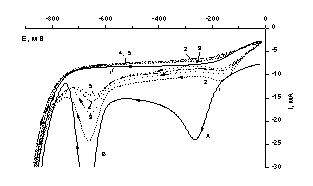
Эл-т:
0,45 М Na2SO4+0,05 M
H2SO4;СТе=1×10-3 М. 1-5
- номера циклов
Рисунок
4 – Циклические вольтамперные кривые
электровосстановления в сернокислом водном электролите.
Влияние освещения на вольтамперную кривую при восстановлении Те (IV) исследовано на
стеклоуглеродном электроде с поверхностью 1см2 На рисунке 5 представлены вольтамперные
кривые восстановления-окисления теллура в «темноте» и при освещении.
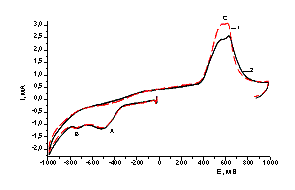
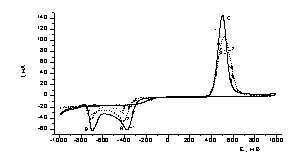
Эл-т:
0,45 М Na2SO4+0,05 M
H2SO4+4×10-3 М К2ТеО3.
Обозначения кривых: 1 – при освещении; 2
– в темноте
Рисунок
5 - Вольтамперные кривые восстановления-окисления Te на стеклоуглеродном
электроде
Как видно из рисунка 5, при включенном освещении
пик тока окисления возрастает, а при
выключенном уменьшается , что предполагает появление дополнительных зарядов на
поверхности теллура при положительных
потенциалах.
Te
+ 4 h+vb + 2H20 = HTeO2+
+ 3H+. (4)
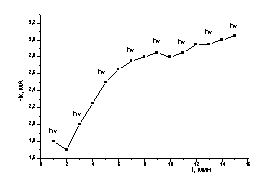
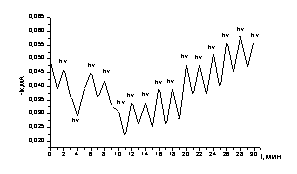
Для подтверждения
этого явления исследовали влияние
периодического освещения на электроосаждение ионов Те(IV) при потенциале Е= -0,5 В. Электроосаждение
проводили из электролита состава 0,45 М Na2SO4+0,05M
H2SO4+2×10-3М K2TeO3
с интервалом «освещение/без освещения» одна
минута. Из рисунка 6а видно, что величина тока восстановления по уравнению (1)
увеличивается со временем, как при освещении, так и без него. Увеличение тока
отражает рост поверхности электрода за счет развития осадка теллура.. В
результате на поверхности электрода получена плёнка теллура серебристо-серого
цвета.
а б
а)Эл-т: 0,45 М Na2SO4+0,05 M
H2SO4+4×10-3 М К2ТеО3 Е= -0,5 В.
б) Эл-т: 0,45 М Na2SO4+0,05 M
H2SO4 Е= -0,25 В
Рисунок
6 – Изменение тока восстановления Те/С.У. электрода в присутствии ионов Те(IV)(а)
и на чистом фоне(б) при чередовании освещения (hν) и без освещения (о) от времени.
Выполнены также эксперименты по исследованию
электрохимического поведения теллурового электрода, полученного путем осаждения
теллура на стеклоуглероде, при более положительном потенциале (-0.25 В) в растворе фонового электролита, в отсутствие
ионов Те(IV) в электролите с
чередованием «освещение/без освещения» с интервалом 1 минута. (рис.6б).
Для
этого эксперимента стеклоуглеродный электрод был предварительно покрыт теллуром
при Е= -0,5 В в течение 30 минут из
электролита 0,45 М Na2SO4+0,05 M
H2SO4 с содержанием ионов
теллура СТе=2×10-3 М.
Как видно из рисунка 6б, возникающий фототок
является катодным и при включении освещения увеличивается. На границе раздела
фаз реакция стимулируется с помощью фотопроизведенных электронов (неосновные
носители заряда) в р- Te, которые накапливаются
на полупроводниковой поверхности. При отключении освещения ток восстановления падает
Полученный
результат свидетельствует о том, что при освещении теллур (0) переходит в
теллур (-2), по реакции:
Te0 + hv →
Te-2 (5)
Такой же теллуровый электрод, приготовленный в
аналогичных условиях, был исследован в электролите, содержащем ионы кадмия (II).
Исследование выполнено методом хроноамперометрии при постоянном потенциале
-0,25 В На рисунке 7 приведено
изменение тока при электроосаждении кадмия из этого электролита при потенциале
-0,25В на полученный ранее теллуровый
электрод в темноте (кривая 1) и при
освещении (кривая 2).
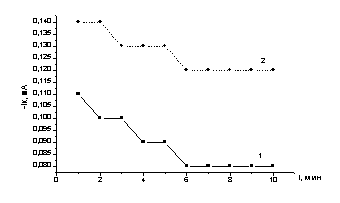
Эл-т: 0,45 М Na2SO4+0,05 M H2SO4. Е= -0,25 В, СCd=3×10-3 М
Обозначение
кривых: 1 – в темноте; 2 - при освещении
Рисунок
7 – Электроосаждение кадмия на теллуровый электрод (Те/СУ) без освещения(1) и
при освещении(2).
Первое резкое увеличение тока связано с
заряжением двойного слоя. Затем ток постепенно падает. При освещении ток восстановления выше почти в два раза,
однако, и в этом случае наблюдается спад тока в течение 6 минут до установления
равновесного постоянного значения. На электроде наблюдается тонкий осадок,
возникающий за счет образования соединения CdTe по реакции
Cd+2 +Te +2e
→ CdTe (6)
Повышение тока увеличивает скорость осаждения в два раза.
Известно, что если в качестве электродной
поверхности используется полупроводник (например титан, покрытый оксидом
титана), то фотовозбуждение может возникать и в его оксидных слоях./6,7/
Было выполнено
электроосаждение теллура на титановые подложки, поверхность которых была
предварительно очищена абразивной бумагой и полировкой. На основании
вольтамперных кривых восстановления-окисления теллура(IV) на титановом электроде
был выбран потенциал электроосаждения, Е= -0,4 В. Осаждение проводилось 30 минут с перемешиванием при комнатной
температуре при рассеянном освещении, концентрация ионов теллура (IV)
в электролите составляла СТе=2×10-3М. В результате получен теллуровый электрод на титане.
Этот (Те/Тi) электрод был помещен в электролит,
содержащий ионы кадмия (II) СCd=3×10-3М и
поляризовался при потенциале Е= -0,25 В в условиях освещения. Через 30 минут
плёнка на электроде увеличилась в объеме, приобрела серый цвет и сохранила
хорошую адгезию к подложке.
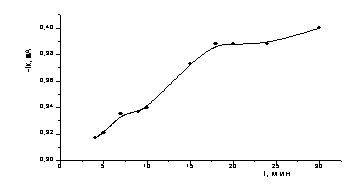
Эл-т:
0,45 М Na2SO4+0,05 M
H2SO4 СCd=3×10-3 М;
Е= -0,25 В,
Рисунок 8 – Изменение тока (Те/Тi) электрода при осаждении кадмия при постоянном потенциале в
условиях
освещения
Как видно из рисунка 8 происходит
систематическое повышение тока при образовании осадка теллурида кадмия на
поверхности электрода. Постоянное значение тока достигается через 20 минут
после начала процесса. При проведении электроосаждения теллура на титановые
электроды ток намного выше, чем при электроосаждении теллура на
стеклоуглеродные электроды, это может быть связано с дополнительным
фотовозбуждением и возникновением неосновных носителей заряда на поверхности
титанового электрода, покрытом полупроводниковой пленкой диоксида титана.
Исследования морфологии поверхности и
элементного состава осадка, полученного после фотоосаждения кадмия на теллуре,
выполнили методом рентгеновского микроанализа с помощью прибора Superprobe-733.
(рис.9)
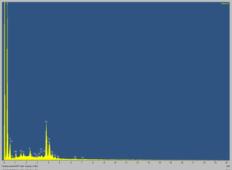

а б
Рисунок
9 - Микрофотография поверхности(а) и энергетический спектр (б) пленки,
полученной при фотоосаждении CdTe на стеклоуглеродном
электроде.
Таблица
1 - Содержание компонентов в пленке, полученной при фотосаждении CdTe
на стеклоуглеродном электроде ( без отжига).
|
Образец №пп |
C |
O |
Na |
Al |
Si |
S |
Fe |
Cd |
Te |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
81.44 |
12.58 |
1.16 |
- |
0.04 |
0.43 |
0.04 |
0.09 |
4.23 |
|
2 |
82.95 |
13.51 |
0.78 |
0.27 |
0.17 |
0.36 |
0.06 |
0.07 |
1.83 |
|
3 |
83.50 |
11.86 |
0.85 |
0.10 |
- |
0.39 |
0.06 |
0.09 |
3.45 |
|
|
|
|
|
|
|
|
|
|
|
Микрофотографии поверхности свидетельствуют, что
осадок имеет вид разветвленных дендритов. В составе наблюдается высокое
содержание углерода, которое соответствует рефлексам стеклоуглеродной подложки при небольшой толщине осадка. Присутствие кислорода в свежеосажденной
пленке без отжига отражает гидратирование осадка в водном электролите. Из
таблицы 1 ясно, что за время эксперимента ,30 минут только часть теллура,
предварительно осажденного на стеклоуглеродном электроде, прореагировала с
образованием соединения CdTe.
Вольтамперные
кривые восстановления-окисления Se (IV)
Исследовано электрохимическое поведение селена(IV)
на дисковом стеклоуглеродном электроде в фоновом электролите 0,45 М Na2SO4+0,05 M
H2SO4. Исследование
проводилось при различных концентрациях ионов селена (СSe(IV)=5×10-4М; 1×10-3М; 1,5×10-3М; 2×10-3М; 3×10-3М), и при
различных скоростях развертки потенциала.
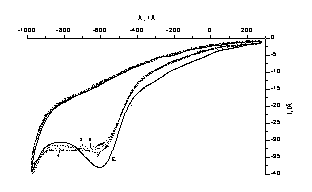
Ток
пика(Е) восстановления Se(IV)
при потенциале Е= -0,55 ÷ -0,60 В, согласно рисунку 10, растет
пропорционально концентрации ионов Se(IV).
При маленькой концентрации селена пик(F) окисления при
потенциале +1,1В проявляется слабо. Катодный ток(D) в области потенциалов
0 ÷ -0,40 В также растет с ростом концентрации ионов, и не имеет ярко
выраженного пика. Пик(F)
окисления на анодной части волны растёт пропорционально концентрации ионов
селена в электролите.
Эл-т:
0,45 М Na2SO4+0,05 M
H2SO4.1-5 – концентрации
селена:
1) 5×10-4 М
; 2)
1×10-3
М ; 3)
1,5×10-3
М; 4)
2×10-3
М; 5)
3×10-3
М;
Рисунок 10 – Вольтамперные кривые
восстановления-окисления Se (IV) в сернокислом
электролите на дисковом стеклоуглеродном электроде при различных концентрациях
селена
Эл-т: 0,45
М Na2SO4+0,05 M
H2SO4,СSe=
3×10-3
М. Обозначения кривых: 1-5 - номера циклов
Рисунок
11 - Циклические вольтамперные кривые электровосстановления Se
(IV) в сернокислом водном электролите
Для определения
оптимального потенциала осаждения селена выполнили электроосаждение селена при
различных потенциалах накопления без перемешивания, а затем сняли кривые
окисления накопленного осадка.(рис. 12а).
а
б
Эл-т:
0,45 М Na2SO4+0,05 M
H2SO4,
СSe(IV)= 1×10-3 М. 1)
Е= -100 мВ; 2) Е= -200 мВ;
3) Е= -300 мВ; 4) Е= -400 мВ;5) Е= -500 мВ;
6) Е= -600 мВ; 7) Е= -700 мВ; 8) Е= -800 мВ;
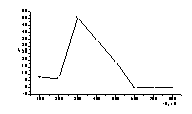
Рисунок
12 – а) Кривые окисления б)
Зависимость тока окисления Se(0) после осаждения его на дисковом электроде от
потенциала осаждения.
Накопление селена на стеклоуглеродном электроде при различных
потенциалах проводили в течение 60 с. Результаты, представленные на рисунке 12,
показывают, что наибольший ток окисления селена наблюдается при потенциале
осаждения Е= -0,30 В. При увеличении катодного потенциала количество селена на
электроде уменьшается. При потенциалах более отрицательных, чем – 0,6 В
элементный селен практически весь переходит в раствор с образованием
селеноводорода:
Se0 + 2e +2H+→ H2Se↑ (7)
Электрохимическое
осаждение селена на стеклоуглеродном электроде
Электрохимическое осаждение селена на стеклоуглеродном электроде с площадью
поверхности 1 см2 осуществляли в потенциостатическом режиме из
электролита 0,45 М Na2SO4
+
0,05 M H2SO4 + 2×10-3 М NaHSeO3 в темноте, при
рассеянном дневном свете и при
освещении галогеновой лампой при I = 100 мВт/см2.(рис.13).
Потенциалы осаждения изменяли от -0,3В до -0,7В.
В темноте при потенциале Е= -0,3 В селен
плохо осаждается на стеклоуглеродный электрод, плёнки получаются неоднородными.
При увеличении отрицательного потенциала до Е= -0,4 В и выше происходит
осаждение селена на электрод. При потенциалах Е = -0,6 В и при Е= -0,7В в темновых условиях процесс
электрохимического осаждения селена
характеризуется очень низким током восстановления. (рис. 13, кривая 1).
.
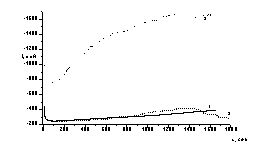
Эл-т: 0,45 М Na2SO4+0,05 M H2SO4+2×10-3 М NaHSeO3
t=25 ºС, Е= -0,6 В. Обозначения кривых: 1 -
в темноте; 2 - рассеянный свет; 3 - при освещении галогеновой лампой
Рисунок
13 - Потенциостатическое осаждение селена на стеклоуглеродный электрод
Такие
же закономерности наблюдаются при осаждении селена в условиях рассеянного
дневного света.(рис.13,кривая2)
При освещении электрода квантами света с
энергией, превышающей ширину запрещённой зоны селена (Еg=2,7 эВ)
электровосстановление Se (ΙV)
происходит за счёт фотоэлектронов зоны проводимости селена. Происходит заметное
увеличение катодного тока во времени (почти в 3 раза). Улучшается внешний вид
осажденной плёнки. В течение 30 минут при потенциале -0,6В получены плотные
покрытия красного цвета с хорошей адгезией к стеклоуглеродной подложке.
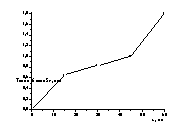
а б
Эл-т:
0,45 М Na2SO4+0,05 M
H2SO4+2×10-3 М NaHSeO3
t=25 ºС, при освещении, t=30 минут
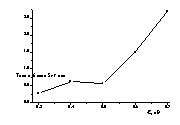
Рисунок 14
– Зависимость толщины плёнки (мкм) селена на стеклоуглеродном электроде: а) от потенциала электроосаждения. б) от времени электроосаждения.( Е=
-0,6 В, при освещении)
Исследование влияния потенциала электроосаждения
на толщину слоя селена показано на рисунке 14. Толщину пленки рассчитывали по
увеличению веса электрода после осаждения. С увеличением отрицательного
потенциала улучшается качество осаждённых пленок и увеличивается толщина слоя
осадка.
При
увеличении времени электроосаждения толщина плёнки селена увеличивается
(Рис.14б).. Лучшие покрытия получаются при проведении электроосаждения в
течение 30 и 45 минут. После 60минут осаждения осадок частично осыпается с
электрода.
Селеновые электроды на стеклоуглероде были
помещены в фоновый электролит, не
содержащий ионы селена, поляризовались
при постоянном потенциале Е= -0,3 В, с перемешиванием в течение 30минут
в темноте (образец 1) и при освещении галогеновой лампой (образец 2) В
первом случае, при проведении реакции в темноте, плёнка не изменилась (красного
цвета, с плохой адгезией). Во втором случае, при проведении реакции с
освещением, плёнка растворилась с подложки. Это позволило сделать вывод, что
при освещении поверхности селенового электрода произошла реакция:
Se0+2e+hu=Se-2 (8)
Электроосаждение кадмия на селеновый электрод из электролита,
содержащего СCd(II)
=4×10-3М, при
перемешивании и освещении лампой, при потенциале Е= -0,4В выполняли в течение
30 и 60 минут (рис.15). Уже через 30 минут на стеклоуглеродной подложке при
освещении лампой был получен осадок селенида кадмия коричнево-серого цвета.
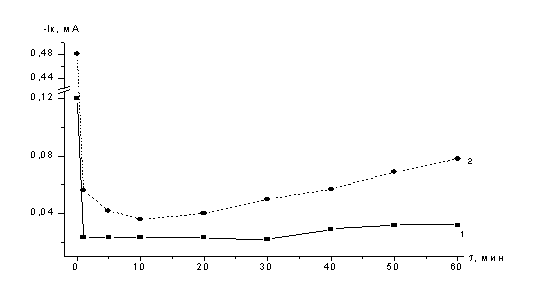
Эл-т:
0,45 М Na2SO4+0,05 M
H2SO4 СCd=3×10-3 М;
Е= -0,4 В,
Обозначение кривых: 1 - в темноте; 2 -
при освещении
Рисунок
15 – Электроосаждение кадмия на
селеновый электрод при потенциале
Е= -0,4 В в темноте и при освещении
галогеновой лампой
Сопоставили изменение тока во время осаждения
кадмия. Электроосаждение кадмия (СCd=3×10-3М) на
стеклоуглеродные электроды, покрытые селеном, выполнили с освещением и в темноте при перемешивании.
Отмечено резкое падение тока после образования первого монослоя селенида
кадмия. В темновых условиях ток остается минимальным и слабо возрастает. При
проведении электролиза в темноте красный цвет плёнки селена не изменился. При
проведении электроосаждения при освещении лампой ток увеличивается (рисунок 15,
кривая 2), и плёнка на электроде приобретает серый цвет. Получен поверхностный слой селенида кадмия с хорошей
адгезией. Резкое уменьшение тока и, следовательно, торможение процесса
электроосаждения связано с тем, что образующийся осадок селена имеет р-тип
проводимости. Это объясняет явление формирования вблизи поверхности электрода
(в приповерхностной области) области положительного пространственного заряда, который препятствует переносу
электронов из объема электрода в электролит.
ЗАКЛЮЧЕНИЕ
Развит метод фотоэлектрохимического получения
тонких пленок Te, Se, CdTe, CdSe в условиях
потенциостатического электролиза и определены оптимальные потенциалы осаждения.
Комбинация катодного осаждения в темновых
условиях и при освещении галогеновой лампой при интенсивности освещения 100
мВт/см2 была использована для получения осадков теллура, селена, теллурида кадмия и теллурида селена на стеклоуглеродном
и титановом электроде
Поверхность электродов, покрытая осадком теллура
или селена, облучалась видимым светом c целью восстановления их
от элементного состояния до теллурид или селенид ионов. В результате
получены ионы теллура(-2) и селена(-2),
вступающие в реакцию с ионами кадмия(+2) при невысоких отрицательных
потенциалах. Освещение электродов ускоряет процесс образования соединений.
Пленочные покрытия соединений отличаются
однородным распределением частиц по поверхности. Анализ осадка теллурида
кадмия выполнен с помощью электронной микроскопии и рентгеновского
микроанализа.
Отмечено, что на титановом электроде при
освещении возникают дополнительные носители заряда. Освещение по-разному
действует на процесс восстановления
ионов Те (IV) при различных потенциалах.
Список использованной литературы
- Gerischer N.,. Mindt W. The mechanism of
decomposition of semiconductors by
electrochemical oxidation and reduction.// Electrochim. Acta 1968.-13.- P.1329-1341
2.
Колбасов Г.Я., Городыский А.В. Процессы
фотостимулированного переноса заряда в системе полупроводник-электролит. М. Наука, 1993.-
190 стр.
3. Плесков Ю.В., Мямлин В.А. Электрохимия
полупроводников. - М.: Наука, 1965.- 216 стр.
4. Mori E., Baker C.K., Reynolds J.R., Rajeshwar
K. Aqueous electrochemistry of tellurium at glassy carbon and gold //
J.Electroanal.Chem. 1988. V.252. P.441-451
5.
Гуревич
Ю.Я., Плесков Ю.В. Фотоэлектрохимия полупроводников «Наука».1980. М. 311 с.
6. Дергачева М.Б.
Электроосаждение полупроводников.// Вестник КазНУ. 2007. – №2 (46), – С.128-139.
7. Дергачева М.Б., Пенькова
Н.В., Ким И.Э. Электрохимическое поведение теллура(IV) на стеклоуглеродном
электроде в кислых и нейтральных электролитах на основе этиленгликоля // Изв. НАН
РК. Сер. Хим. – 2009. – №2. –
С.29-34.
8. Дергачева
М.Б., Чайкин
В.В., Пенькова
Н.В., Комашко
Л.А. Electrochemical behavior of Se (IV) on glasscarbon electrode modified
by nano- g Al2O3 //
57th Annual Meeting of the International Soc. Electrochemistry. (Edinburg,
UK. – 27.08.–1.09.).
– Edinburg,
UK, 2006.
– Р.1.
9. Пенькова Н.В
Электрохимические реакции при совместном восстановлении Te(IV)
и Cd(II) в сернокислом электролите на
стеклоуглеродном электроде // Тезисы междунар. научно-практич. конф. мол.
ученых «химия и хим. технология».-Алматы.-2004.-С.63-65.
10.Плесков Ю.В Фотоэлектрохимическое преобразование солнечной
энергии.- М: Химия, 1990.- С.133.
11.Плесков Ю.В Фотоэлектрохимическое преобразование
солнечной энергии.- М: Химия, 1990.- С.133.