Экология/2, экологические и метеорологические проблемы
больших
городов и промышленных зон.
Д.х.н. Нифталиев С.И., к.х.н. Кузнецова И.В.,
к.х.н. Перегудов Ю.С., Сергеева А.В.
Воронежская государственная технологическая академия, Россия
В.В. Окшин
ОАО «Минудобрения», г. Россошь (Воронежская область),
Россия
Модифицирование сточных вод для
получения жидкого комплексного удобрения
Проблема очистки разнообразных
видов сточных вод в России с каждым годом становится всё
более актуальной в связи с усиливающимся антропогенным воздействием их на
водные экосистемы. Постепенно восстанавливающиеся промышленность, транспорт, сфера
услуг в результате своей деятельности увеличивают сброс различных жидких отходов
производственного и хозяйственно-бытового происхождения. На предприятиях по производству минеральных удобрений
в результате химических процессов вода насыщается различными ионами, поэтому
она не может снова использоваться в технологическом цикле без очистки, что
невозможно без существенных затрат. Поэтому, чаще всего, сточная вода поступает
в отстойники, возникает проблема утилизации жидких отходов.
В нашей работе рассматриваются возможности
модифицирования сточной воды производства азотно-калийно-фосфорных удобрений с
целью получения питательных растворов с заданным составом для выращивания
декоративных садовых и комнатных растений в открытом и закрытом грунте,
различными методами, в том числе гидропоникой и ионитопоникой.
Состав промышленных сточных
вод производства азотно-калийно-фосфорных удобрений на ОАО
«Минудобрения» приведен в таблице 1.
Таблица 1. Химический состав сточных вод ОАО
«Минудобрения»
|
Наименование
компонента |
Концентрация, мг/л Заводская лаборатория ОАО «Минудобрения» |
Концентрация разовой пробы, мг/л Лаборатория ГОУ ВПО ВГТА |
|
Азот аммонийный |
50-200 |
|
|
Азот нитратный |
20-120 |
34 |
|
Фосфаты |
0,2-2,0 |
|
|
рН |
6,5-8,5 |
6,8 |
|
Хлориды |
1,7-7,5 |
2,3 |
|
Сульфаты |
3,1-11,8 |
|
|
Нитриты |
0,24-13,1 |
21,9 |
|
Железо общее |
0,01-0,25 |
0,18 |
|
Медь |
0,0378 |
|
|
Цинк |
До 0,005 |
|
|
Натрий |
- |
0,1 |
|
Калий |
- |
0,2 |
|
Осмотическое давление, Па |
4458,1-18745,1 |
|
|
Общая концентрация солей |
88,8 –371 |
|
Сточные воды ОАО «Минудобрения»
представляют собой ценные жидкие отходы, так как содержат азот. Путем различных
модификаций отходов можно получить
жидкие комплексные удобрения (ЖКУ) (рис.1). Предлагаемый способ получения жидкого
модифицированного минерального продукта
осуществляют по следующей методике. В исходный сток от производства
минеральных удобрений (состав разовой пробы представлен в таблице 1) добавляют
следующие вещества: ZnSO4 •7H2O; MnSO4•7H2O;
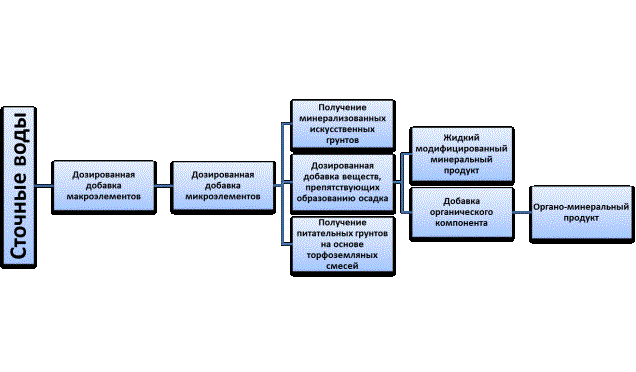
Рис.
1. Направления модификации и применения сточных вод ОАО «Минудобрения»
CuSO4•5H2O;
(NH4)2MoO4;
FeSO4•7H2O; Ca(H2PO4)2;
MgCI2; KNO3. Для предотвращения появления осадка гидроксида железа (III), необходимо связать двухвалентное
железо в устойчивую и активную форму.
Наиболее активны микроэлементы в форме
комплексных солей с органическими кислотами (комплексонами) [1]. Такие соли называются хелатами микроэлементов. Хелаты микроэлементов хорошо растворимы в
воде, практически не токсичны, обладают высокой устойчивостью, хорошо
адсорбируются на поверхности листьев и в почве. Микроэлементы в хелатной форме,
в отличие от минеральных солей, практически не закрепляются в почве и
длительное время остаются доступными для растений. В производстве хелатных микроудобрений
используются комплексоны с
карбоксильными группами: этилендиаминтетрауксусная кислота (Э Д Т А); диэтилентриаминпентауксусная
кислота (Д Т П А); дигидроксибутилендиаминтетрауксусная кислота (Д Б Т А);
этилендиаминдиянтарная кислота (Э Д Д Я); комплексоны на основе фосфоновых
кислот: гидроксиэтилендендифосфоновая кислота (О Э Д Ф);
нитрилтриметиленфосфоновая кислота (Н Т Ф); комплексоны на основе низших поликарбоновых оксикислот: лимонная кислота;
яблочная кислота; винная кислота; щавелевая кислота и др. [1]
Растения усваивают азот, калий, фосфор и
кальций с рН 6-8. Зато железо, марганец и бор при таких значениях находятся в
формах, которые недоступны растениям, чаще всего это малорастворимые
соединения. Например, железо усваивается живыми организмами в форме
двухвалентного иона Fe2+, которая стабильна при рН<6,5, а при более
высоких значениях водородного показателя переходит в трехвалентный ион Fe3+.
Такую форму половина ионов железа приобретает при рН =7,3, при рН = 8 растения
уже не могут извлечь этот элемент из воды и почвы. Комплексоны, тесно связываясь с ионами двухвалентного железа,
способны достаточно долго сохранять его именно в такой, двухвалентной форме,
предотвращая переход в трехвалентную и предохраняя его от гидроксилирования.
Для разработки технологии получения хелатов и добавления их в сток от
производства минеральных удобрений необходимо определить оптимальное соотношение
FeSO4 : ЭДТА,
при котором связывание ионов Fe2+ в комплекс максимально.
Для получения хелата железа (известен
один комплекс [FeEdta]2-, Кн=3,54.10-15) использовали
этилендиаминтетрауксусную кислоту (ЭДТА) (как наиболее доступную) и железный
купорос FeSO4•7H2O.
Для изучения комплексообразования
применяли метод изомолярных серий (метод Жоба) [2,3]. Измерения проводили на серии растворов, в которых сумма общих
концентраций иона металла и лиганда постоянна, а их отношение непрерывно
изменяется. Растворы этой серии готовили путем смешения раствора соли FeSO4•7H2O с
концентрацией 0,01 моль/дм3 и растворов ЭДТА с концентрацией 0,01
моль/дм3 в различных соотношениях, определяли рН полученных
растворов (табл.2). Оптическую плотность измеряли на спектрофотометре УФ -
видимого диапазона UV mini-1240 в области
190-390 нм. Были сняты спектры в видимой области серии
растворов, в которых варьируются отношение концентраций FeSO4 и ЭДТА.
Таблица 2. Характеристики изомолярной
серии растворов
|
Соотношение мольных
долей FeSO4 : ЭДТА |
рН |
Оптическая плотность
раствора при λ=256 нм |
Оптическая плотность
раствора при λ=226 нм |
|
0,1 :
0,9 |
8,2 |
0,630 |
0,507 |
|
0,2 :
0,8 |
6,6 |
2,056 |
3,891 |
|
0,3 :
0,7 |
7,5 |
2,604 |
2,199 |
|
0,4 :
0,6 |
7,2 |
2,658 |
2,228 |
|
0,5 :
0,5 |
6,8 |
2,403 |
2,027 |
|
0,6 :
0,4 |
6,7 |
1,885 |
1,596 |
|
0,7 :
0,3 |
6,4 |
1,456 |
1,247 |
|
0,8 :
0,2 |
6,1 |
1,053 |
0,924 |
|
0,9 :
0,1 |
6,0 |
1,053 |
0,924 |
Зависимость Жоба получали, измеряя поглощение
раствора смесей этих соединений при определенной длине волны (226нм, 256нм),
соответствующей max и min пиков на
спектрах.
Положение максимумов на рис. 2,3, таб.2 соответствует
соотношениям мольных долей FeSO4 : ЭДТА=0,2:0,8 (λ=226 нм ) и 0,4:0,6 (λ=256
нм). При приготовлении первого раствора также наблюдали резкое падение рН до
6,6, что свидетельствует об комплексообразовании и максимальном связывание ионов Fe2+.
Для получения ЖКУ необходимо использовать
растворы с оптимальным соотношением мольных долей FeSO4 : ЭДТА 0,2:0,8 или 0,4:0,6 соответственно, при этом рН надо поддерживать в пределах 6-6,6 во избежании перехода Fe2+
в Fe3+. ЖКУ, имеющее в своем составе хелат железа, отличается
устойчивостью при хранении и эффективностью при использовании в качестве
питательной среды для выращивания растений.
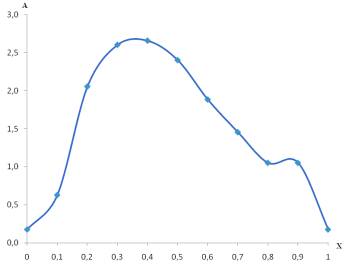
Рис.2. Зависимость
светопоглощения (А) растворов при λ=256 нм от мольной доли (Х) FeSO4 (метод
Жоба)
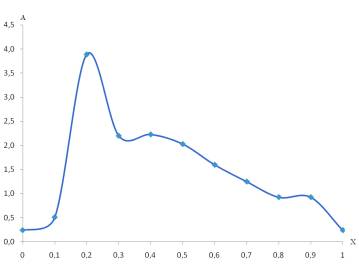
Рис.3.
Зависимость светопоглощения (А) растворов при λ=226 нм от мольной
доли (Х) FeSO4 (метод Жоба)
Литература
1. Булыгин
С.Ю., Демишев Л.Ф., Доронин В. А. и др. Микроэлементы в сельском
хозяйстве.- Дніпропетровськ: «Січ»,
2007- 100с.
2. Fujimori T.,
Yamada S., Yasui H., Sakurai H., In Y., Ishida T. // J. Biol. Inorg. Chem. – 2005. –
Vol. 10. – pp. 831-841.
3. Бек М., Надьпал И. Исследование
комплексообразования новейшими методами. – М.: Мир, 1989 г. – 413 с.