К.Н.Семенов*,
Н.А.Чарыков*, В.А.Кескинов*, Д.Г.Летенко**,
В.А.Никитин**, А.А.Блохин*, Ю.В.Мурашкин*,
О.А.Крохина*, Е.Г.Грузинская*
* ЗАО
“Инновации Ленинградских институтов и предприятий”, Санкт-Петербург.
** Санкт-Петербургский
Северо-Западный государственный технический университет
ФУЛЛЕРЕНОЛ-70-D, ПОЛУЧЕННЫЙ МЕТОДОМ
ПРЯМОГО ОКИСЛЕНИЯ.
Под фуллеренолом-70-d будем понимать смешанный фуллеренольный продукт,
представляющий собой смесь полигидрокислированных фуллеренов, получаемых прямым
гомогенно-каталитическим щелочным окислением второго легкого фуллерена С70, состава С70(ОН)n (индекс
“d” в названии “фуллеренол-70-d” и означает прямое - “direct” окисление).
В отличие от фуллеренолов, отвечающих первому легкому
фуллерену С60, в
литературе описывается значительно меньшее количество методов синтеза
фуллеренолов, отвечающих второму легкому фуллерену - С70, или кратко фуллеренолов-70. Остановимся на них
подробнее.
Нами для синтеза
фуллеренола-70 был выбран метод
прямого гомогенно-каталитического окисления, который ранее был успешно
использован для синтеза его ближайшего аналога - более легкого фуллеренола-60
(или фуллеренола-d)
(см., например, [1]), как несомненно самый простой и доступный из предлагаемых.
Насколько известно авторам, такой метод ранее доля синтеза фуллеренолов-70 не использовался.
В рамках данной работы нами была
разработана следующая методика синтеза фуллеренола С70(OH)x. Первоначально готовился насыщенный
раствор фуллерена С70 в бензоле методом изотермического насыщения
при 200С в течение 8-10 часов. Для приготовления насыщенного
раствора был взят фуллерен С70 массой 1 г и растворен в 500 мл
бензола. Равновесное значение растворимости было получено
спектрофотометрическтим методом на спектрофотометре SPECORD M-32 (Carl Zeiss) в
соответствии с методиками [2] и составляло ![]() 1.30
1.30![]() г/л, что в свою очередь хорошо согласуется с имеющимися
литературными данными [3]. Затем раствор был отфильтрован для удаления
нерастворившегося С70, после чего к раствору было добавлено 20 мл
50% водного раствора гидроксида натрия. Далее к реакционной смеси добавлялся по
каплям межфазный катализатор (40% раствор тетрабутиламмоний гидроксида в воде)
при перемешивании до обесцвечивания раствора. После этого из реакционной под
вакуумом (0.1 мм рт. ст.) смеси отгонялся бензол в течение нескольких часов.
Полученный в результате осадок и раствор щелочи перемешивался с дополнительной
порцией воды объемом 100 мл в течение 10 ч. Далее, к реакционной смеси
добавлялось 200 мл воды для завершения реакции и полученный красно-коричневый
раствор отделялся от нерастворившегося осадка путем фильтрования на фильтре
«Зеленая лента». Затем, полученный фильтрат был сконцентрирован на роторном
испарителе (при 0.1 мм рт. ст.) до 50 мл, после чего к раствору было добавлено
150 мл метанола для высаливания образовавшегося фуллеренола. Процедура
перекристаллизации повторялась три раза, после чего полученный фуллеренол
высушивался в вакуумном сушильном шкафу при температуре 400 С (0.1
мм рт. ст.) в течение четырех часов для удаления следов метанола и бензола.
г/л, что в свою очередь хорошо согласуется с имеющимися
литературными данными [3]. Затем раствор был отфильтрован для удаления
нерастворившегося С70, после чего к раствору было добавлено 20 мл
50% водного раствора гидроксида натрия. Далее к реакционной смеси добавлялся по
каплям межфазный катализатор (40% раствор тетрабутиламмоний гидроксида в воде)
при перемешивании до обесцвечивания раствора. После этого из реакционной под
вакуумом (0.1 мм рт. ст.) смеси отгонялся бензол в течение нескольких часов.
Полученный в результате осадок и раствор щелочи перемешивался с дополнительной
порцией воды объемом 100 мл в течение 10 ч. Далее, к реакционной смеси
добавлялось 200 мл воды для завершения реакции и полученный красно-коричневый
раствор отделялся от нерастворившегося осадка путем фильтрования на фильтре
«Зеленая лента». Затем, полученный фильтрат был сконцентрирован на роторном
испарителе (при 0.1 мм рт. ст.) до 50 мл, после чего к раствору было добавлено
150 мл метанола для высаливания образовавшегося фуллеренола. Процедура
перекристаллизации повторялась три раза, после чего полученный фуллеренол
высушивался в вакуумном сушильном шкафу при температуре 400 С (0.1
мм рт. ст.) в течение четырех часов для удаления следов метанола и бензола.
Выход смешанного
оксигидроксифуллеренола-70 составил ![]() 225 мг (из 1000 мг
исходного фуллерена С70).
Перевести это значение в отн.% от теоретически возможного не удается, поскольку
полученный продукт представляет собой многокомпонентную смесь полизамещенных
продуктов общего состава С70(ОН)n1Оn2 (с разными значениями n1, n2). В любом случае, этот выход весьма
невелик по сравнению с выходом фуллеренола, соответствующего более легкому
фуллерену С60 – фуллеренолу-d [1], получаемому аналогичным методом.
Конкретно, выход фуллеренола - d составляет
225 мг (из 1000 мг
исходного фуллерена С70).
Перевести это значение в отн.% от теоретически возможного не удается, поскольку
полученный продукт представляет собой многокомпонентную смесь полизамещенных
продуктов общего состава С70(ОН)n1Оn2 (с разными значениями n1, n2). В любом случае, этот выход весьма
невелик по сравнению с выходом фуллеренола, соответствующего более легкому
фуллерену С60 – фуллеренолу-d [1], получаемому аналогичным методом.
Конкретно, выход фуллеренола - d составляет ![]() 1000 мг (из 1000 мг исходного фуллерена С60).
1000 мг (из 1000 мг исходного фуллерена С60).
Электронные
спектры водного раствора фуллеренола – 70 - d.
Электронный спектр водного
раствора фуллеренола-70-d относительно чистой воды в видимой и ближней ультрафиолетовой
областях спектра представлен ниже на Рис.1. Спектр получен с помощью
спектрофотометра SPECORD M-32 в
кварцевых кюветах “КВ-1” шириной 1 см
в области длин волн 300 – 900 нм.
Как
видно из рис.1, во всем изученном спектральном диапазоне:
а) Электронный
спектр фуллеренола-70-d не имеет каких-либо видимых полос поглощения.
б) В
частности, отсутствуют столь характерные для легких фуллеренов и многих их
производных в ароматических и неароматических растворителях пики поглощения в
области ![]() 472 нм (для фуллерена С70),
472 нм (для фуллерена С70),
![]() 335 нм (для обоих фуллеренов С60 и С70).
335 нм (для обоих фуллеренов С60 и С70).
в) Во
всех случаях наблюдается монотонно усиливающееся при смещении в коротковолновую
часть спектра поглощение.
Инфракрасные спектры фуллеренола – 70 - d.
Для идентификации полученного
фуллеренола-70-d
нами на приборе SHIMADZU FTIR-8400S были получены ИК-спектры
поглощения твердых образцов. В опытах использованы таблетки бромида калия – KBr (высущенный в Ar), область приведенных частот составила ![]() см-1 (Т – пропускание в отн. %). Полученный
спектр представлен ниже на Рис.2.
см-1 (Т – пропускание в отн. %). Полученный
спектр представлен ниже на Рис.2.
а) Из
рис. 2 видно, что некоторые характеристические пики поглощения совпадают для
фуллеренола-70-d и
самого легкого фуллерена С70. В
частности, это наблюдается на приведенных частотах ![]() 2830
2830![]() см-1,
см-1, ![]() 1616 см-1,
1616 см-1,
![]() 1362
1362![]() см-1, а также для слабо выраженных длинноволновых
пиков
см-1, а также для слабо выраженных длинноволновых
пиков ![]() 994
994![]() см-1,
см-1, ![]() 615
615![]() см-1. Довольно устойчив оказался и коротковолновой
триплет
см-1. Довольно устойчив оказался и коротковолновой
триплет ![]() 3414
3414![]() 3475
3475![]() 3550
3550![]() см-1.
см-1.
б) Любопытно,
что наблюдаются очень существенные отличия в ИК-спектрах, казалось бы,
родственных фуллеренола-70-d и фуллеренола-d (отвечающему фуллеренолу С60,
полученному аналогично) [1]. Для последнего исчезают практически все пики,
характеристичные одновременно для фуллеренола-70-d и фуллерена С70, зато появляются
новые пики на приведенных частотах частотах ![]() 1448 см-1,
1448 см-1,
![]() 1591 см-1,
1591 см-1,
![]() 1037 см-1. Длинноволновой пик несколько смещается
по отношению к вышеупомянутому триплету
1037 см-1. Длинноволновой пик несколько смещается
по отношению к вышеупомянутому триплету ![]() 3421см-1.
3421см-1.
в) В
целом, можно утверждать, что ИК-спектры
фуллеренола-70-d
вполне информативны и могут быть использованы для идентификации последнего.
Масс-спектрометрия
фуллеренола -70- d.
Вполне логичным, с точки зрения авторов, и по аналогии с более
легким фуллеренолом-d
(отвечающим производным фуллерена С60
[1] и синтезированных аналогично) было бы предполагать, что в результате синтеза
фуллеренола-70-d по
указанной методике получаются не индивидуальные фуллеренолы типа ![]() , а более сложная смесь продуктов. В случае фуллеренолов С60 , например
синтезируется смесь продуктов
“полиспиртов” -
, а более сложная смесь продуктов. В случае фуллеренолов С60 , например
синтезируется смесь продуктов
“полиспиртов” - ![]() , “оксиполиспиртов”
, “оксиполиспиртов” ![]() или их солей
или их солей![]() . Для выяснения указанного вопроса нами был снят масс-спектр
образца фуллеренола-70-d.
. Для выяснения указанного вопроса нами был снят масс-спектр
образца фуллеренола-70-d.
Рассмотрим, для примера, типичную масс-спектрограмму фуллеренола –
d, представленную на
рис.3. В работе использован Брукеровский масс-спектрограф MICROTOF (Bruker), ионизация электронная. Представленная
масс-спектрограмма, естественно носит неколичественный, а качественный
характер. На рис.3 хорошо видны масс-спектрометрические рефлексы, отвечающие
отношениям образованию “полиспиртов” - ![]() (причем n варьируется в широких пределах: от n = 4 (M/z = 908 а.е.), далее к n = 5 (M/z = 925 а.е.) …, n = 10 (M/z = 1010 а.е.) … n = 19 (M/z = 1163 а.е.). На рис.4 хорошо видны также рефлексы,
отвечающие натриевым формам полиспиртов
(причем n варьируется в широких пределах: от n = 4 (M/z = 908 а.е.), далее к n = 5 (M/z = 925 а.е.) …, n = 10 (M/z = 1010 а.е.) … n = 19 (M/z = 1163 а.е.). На рис.4 хорошо видны также рефлексы,
отвечающие натриевым формам полиспиртов ![]() , например: n1 = 7, n2 = 1 (M/z = 998 а.е.), n1 = 8, n2 = 2 (M/z = 1054 а.е.) и т.д.
, например: n1 = 7, n2 = 1 (M/z = 998 а.е.), n1 = 8, n2 = 2 (M/z = 1054 а.е.) и т.д.
Таким образом, мы вполне можем качественно описать полученную
смесь продуктов гидрокислирования:
1. В продуктах содержатся “полиспирты - ![]() и натриевые формы
полиспиртов
и натриевые формы
полиспиртов ![]() ,
,
2. В продуктах практически не
содержатся “оксиполиспирты” ![]() или их соли
или их соли ![]() , в отличие от продуктов реакции гидроксилирования фуллерена С60 [1], в котором
содержались подобные формы.
, в отличие от продуктов реакции гидроксилирования фуллерена С60 [1], в котором
содержались подобные формы.
3. Уровень гидроксилирования в реакциях с С70 в целом заметно ниже, чем
в случае гидрокислирования С60
(сравни ![]() для С70 и
для С70 и ![]() для С60 [1]).
для С60 [1]).
4. Также, в отличие от масс-спектров
фуллеренолов-d,
масс-спектры фуллеренолов-70-d при электронегативной ионизации не содержат многозарядных ионов и
не подвергаются деструкции при ионизации.
В дальнейших расчетах везде мы принимали условную молекулярную
массу фуллеренола – 70-d, равную M/z
= 1044 а.е. , т.е. отвечающей условной формуле
фуллеренола – 70-d ![]() (сравни с молекулярной массой фуллеренола –d, равной M/z = 1128 а.е., т.е. отвечающую условной формуле
фуллеренола - d
(сравни с молекулярной массой фуллеренола –d, равной M/z = 1128 а.е., т.е. отвечающую условной формуле
фуллеренола - d ![]() [1]).
[1]).
Работа проводится при
поддержке гранта РФФИ (проект № 09-03-00350-а)
Литература.
[1]. K.N.Semenov, V.A.Keskinov, N.A.Charykov. Fullerenol Synthesis and Identification. Properties of Fullerenol Water Solutions. J. Chem. Eng.
Data. V.56. 2011. P.230-239.
[2]. Ponomarev N., Yudovich M.E., Charykov
N.A. et al. Opt. a. Spectr.
2000. V.88. N2. P.195-197.
[3]. K.N.Semenov, N.A.Charykov, V.A.Keskinov, A.K.Piartman, A.A.Blokhin, A.A.Kopyrin. Solubility of light Fullerenes in Organic Solvents. J. Chem. Eng. Data. 2010. V.55. P.13-36.
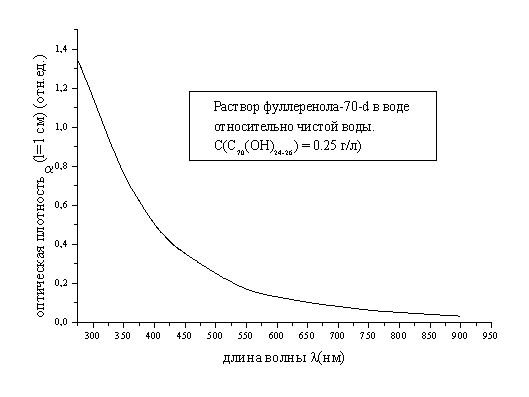
Рис.1. Электронный
спектр поглощения фуллеренола-70-d.
Пропускание
Т (отн.%)
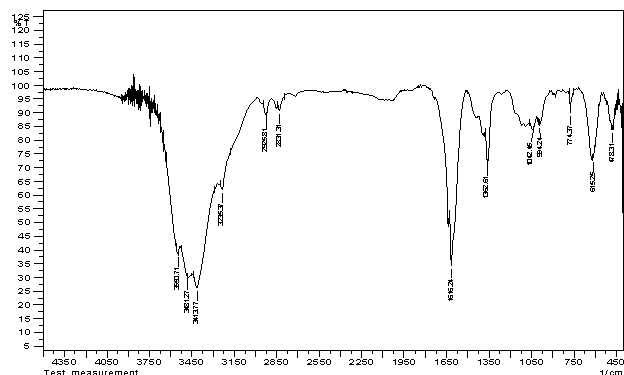
Волновое
число ![]()
Рис.2. Инфракрасный
спектр фуллеренола-70-d.
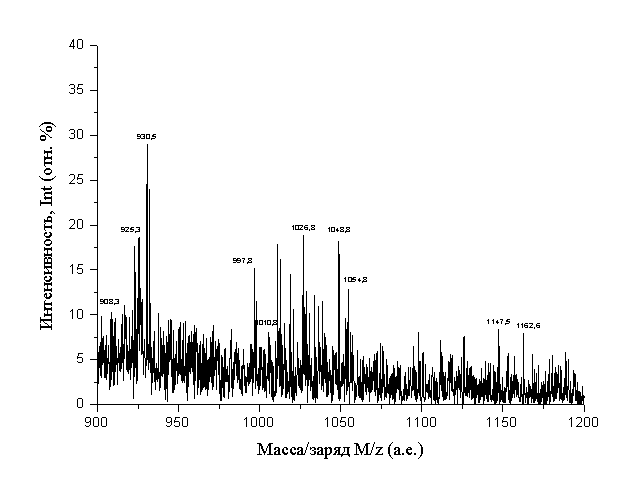 Рис.3. Масс-спектр фуллеренола-70-d.
Рис.3. Масс-спектр фуллеренола-70-d.