УДК 533.15:621.039.341
КОМПЛЕКСЫ МОЛЕКУЛ И
ТЕОРИЯ ТЕПЛОЕМКОСТИ РЕАЛЬНЫХ ГАЗОВ
Павлов А.М., Калижанова У.С.
Республика Казахстан
Восточно-Казахстанский
государственный университет
им. С.Аманжолова, г.Усть-Каменогорск
Комплексами молекул сейчас занимаются
во многих странах. Справочные данные приводятся обычно для теплоемкости при
постоянном давлении. Мы рассмотрим теорию теплоемкости. Комплексы молекул необходимо считать
самостоятельными компонентами и теплоемкость газа находить предварительно
определив отдельно молярные теплоемкости мономеров, димеров
и других комплексов.
Справочные
данные приводятся обычно для теплоемкости при постоянном давлении [1]. Поэтому
рассмотрим теорию этой теплоемкости.
Известны
следующие формулы для расчета Ср. Например, И.П.Базаров
приводит такую формулу [2]:
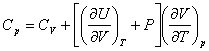 (1)
(1)
Для
газа Ван-дер-Ваальса А.И.Ансельм получает
 (2)
(2)
Г.Шиллинг,
используя вириальное уравнение состояния, записывает [3]:
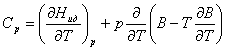 (3)
(3)
где Н- энтальпия, В- второй вириальный коэффициент.
Отсюда получается две формулы для Ср.
Если взять производную от скобки в (3), то получим
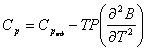 (4)
(4)
Если же
выразить В
через поправки Ван-дер-Ваальса с помощью формулы
![]() (5)
(5)
то
оказывается
![]() (6)
(6)
Ниже
приведем вычисленные по формула (4) и (6) значения ср удельное при Т=155К
для аргона.
Таблица 1- Сравнение расчетных ср
с экспериментальными данными.
|
Р(бар) |
СР(кДж/кг град) по (6) |
СР(кДж/кг град) по(4) |
СР(кДж/кг град) по[1] |
|
1 10 100 |
0.5329 0.5532 0.857 |
0.5234 0.5578 0.9034 |
0.527 0.601 1.703 |
Как
видно из приведенной таблицы при низких давлениях формулы термодинамики дают
хорошее согласие с экспериментом.
Однако
при повышении давления разница увеличивается и достигает 50% и более. Поэтому
обычно используются эмпирические формулы для описания поведения теплоемкостей в
широком интервале температур. Однако такие формулы и
слагаемые в них не имеют физической интерпретаций.
Трудно
объяснима зависимость теплоемкости от давления. Например, у аргона при Т=85К и
давлениях 0,25бар, 0,5бар и 0,75бар теплоемкость равна 0,533 кДж/(кг град),
0,545кДж/(кг град) и 0,558кДж/(кг град) соответственно. Нет также объяснения
снижению теплоемкости при повышении температуры. На наш взгляд все эти
особенности поведения теплоемкости можно объяснить, если учесть комплексы
молекул при расчетах Ср
и Сv.
ВЫВОД РАСЧЕТНОЙ
ФОРМУЛЫ ДЛЯ Ср
Возьмем один моль газа и будем считать, что
в нем содержится N1 мономеров и N2 димеров. Тогда свободную энергию такого газа можно записать
в виде
![]() (7)
(7)
где Z1 и Z2 интегралы
состояний мономеров и димеров.
Отсюда,
согласно формуле
![]()
получаем
![]() (8)
(8)
где ε1 и ε2 –энергия одной
частицы мономера и димера.
Тогда
![]() (9)
(9)
Но ![]() , так как
, так как ![]() .
.
Получается,
что (9) дает значение теплоемкости меньшего количества газа, чем один моль, и
поэтому комплексом образование должно снижать значение теплоемкости. Тогда, при
повышении давления и увеличении концентрации комплексов теплоемкость должна
была бы уменьшаться.
Однако,
как видно из таблицы 1, теплоемкость газа увеличивается при повышении давления.
Это можно объяснить тем, что комплекс молекул имеет большее число колебательных
и вращательных степеней свободы.
Как
известно, теплоемкость смеси газов определяется по формуле
![]() (10)
(10)
где xi – концентраций
компонентов.
Из
вышесказанного следует, что комплексы молекул необходимо считать
самостоятельными компонентами и теплоемкость газа находить по формуле(10),
предварительно определив отдельно молярные теплоемкости мономеров, димеров и других комплексов.
Теплоемкость
Ср каждого
компонента комплексов молекул можно найти по формулам (4) или (6), а затем
теплоемкость газа рассчитать по формуле (10).
Итак,
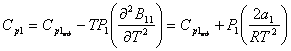 (11)
(11)
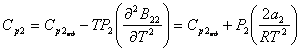 (12)
(12)
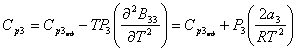 (13)
(13)
![]() (14)
(14)
где Рі - парциальные давления комплексов;
хк- их концентрация,
определяемая как
![]() (15)
(15)
Поскольку
поправка ![]() мала, малы так же
парциальные давления Р2
и Р3,то можно считать
мала, малы так же
парциальные давления Р2
и Р3,то можно считать
аi=а и Pi = nikT = xiP.
Как
следует из (14), для определения теплоемкости газа необходимо вычислить
концентрацию комплексов различной размерности.
РАСЧЕТ КОНЦЕНТРАЦИИ
КОМПЛЕКСОВ
Концентрация
комплексов рассчитывается с помощью закона действующих масс. Если происходит
реакция
2А1=А2 или gA1=Ag,
То
химические потенциалы мономеров и комплексов удовлетворяют условию
![]() или
или ![]() (16)
(16)
Согласно
[3]
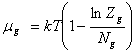 , (17)
, (17)
где 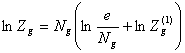 (18)
(18)
![]() статистическая сумма, отнесенная к одной частице, причем
статистическая сумма, отнесенная к одной частице, причем
![]() (19)
(19)
Подставляя
(17) и (18) в (16), получаем:
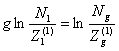
Отсюда
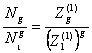 (20)
(20)
и
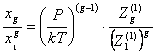 (21)
(21)
где
![]()
Здесь в
одном уравнении два неизвестных.
Чтобы найти ![]() необходимы
дополнительные условия. Таким дополнительным условием является
необходимы
дополнительные условия. Таким дополнительным условием является ![]()
Таким
образом, если учитывать только димеры и тримеры, то уравнения для расчета их концентраций будут:
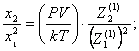 (22)
(22)
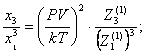 (23)
(23)
![]() (24)
(24)
Интегралы
состояний зависят от количества атомов в молекуле и от количества молекул в
комплексе. Однако расчет колебательной и вращательной части ![]() и
и ![]() должен отличаться от
соответствующего расчета для молекул. Если у молекулы энергия связи составляет
несколько электрон-вольт, то у квазимолекул она равна
0,01 а то и 0,001эВ.
должен отличаться от
соответствующего расчета для молекул. Если у молекулы энергия связи составляет
несколько электрон-вольт, то у квазимолекул она равна
0,01 а то и 0,001эВ.
ВРАЩАТЕЛЬНАЯ И
КОЛЕБАТЕЛЬНАЯ СОСТАВЛЯЮЩИЕ ИНТЕГРАЛА СОСТОЯНИЙ КВАЗИМОЛЕКУЛ
Поскольку
энергия связи квазимолекулы мала, то интегрирование в
бесконечных пределах при расчете ![]() и
и ![]() будет не корректно.
будет не корректно.
При
энергии вращательного и колебательного движения, равной энергии связи, комплекс
распадается. Поэтому переменные интегрирования ограничены.
Подсчитаем
для одноатомного димера колебательную часть интеграла
состояний
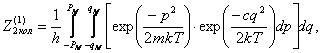 (25)
(25)
где с- коэффициент
упругости межмолекулярной связи.
Подсчитаем
каждый интеграл в отдельности.
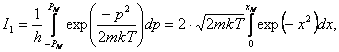
где - ![]() ,
, ![]()
Поскольку
в нашем случае ни один из предельных случаев (![]() <<kT и
<<kT и ![]() >>kT) не подходят, то мы по таблице [6] подобрали
подходящую функцию, достаточно хорошо приближающуюся к соответствующему
интегралу при
>>kT) не подходят, то мы по таблице [6] подобрали
подходящую функцию, достаточно хорошо приближающуюся к соответствующему
интегралу при ![]() ~1:
~1:
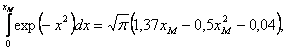 (26)
(26)
Таким
образом,
![]() (27)
(27)
Далее
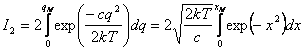
или
![]() (28)
(28)
Таким
образом
![]()
Учитывая,
что ![]() , окончательно можно записать:
, окончательно можно записать:
![]() (29)
(29)
или
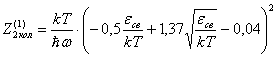 (30)
(30)
Можно это выражение
записать по другому:
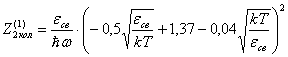 (31)
(31)
Или
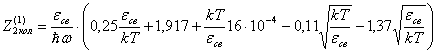
Отсюда
видно, что первым и третьим слагаемыми в скобках можно пренебречь.
Тогда
окончательно будем иметь
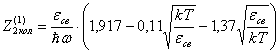 (32)
(32)
Частота
колебаний димера определена в (4) и её можно
вычислить по формуле
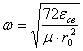 ;
; ![]() (33)
(33)
Подобным
же образом определим вращательную часть интеграла состояний. Если квазимолекула имеет 3 вращательных степеней свободы, то
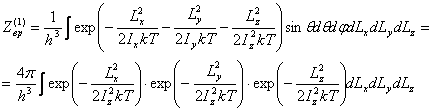
Сводятся
к предыдущему случаю:
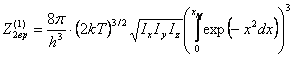
где
снова ![]()
учитывая
(26), получим
![]() (34)
(34)
или
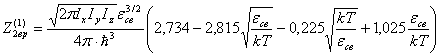 (35)
(35)
Для димера из одноатомного газа будет
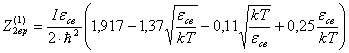 (36)
(36)
Расчет
внутренней энергии и теплоемкости СVвр по известным
формулам дает
СVвр≈0,515R,
R, а на 2 степени свободы будет СVвр≈1,03R что близко к R,
Поскольку
температурная зависимость ![]() примерно та же самая,
то можно положить, что
примерно та же самая,
то можно положить, что
СVкол≈0,515R.
Тример даже из одноатомных молекул имеет три
степени свободы (если молекулы не располагаются по одной линий), поэтому ![]() можно считать по (35).
Колебательных степеней свободы у него две. Поэтому (32) следует возвести в
квадрат.
можно считать по (35).
Колебательных степеней свободы у него две. Поэтому (32) следует возвести в
квадрат.
![]() (37)
(37)
Интегралы
состояний мономеров зависят от количества атомов в молекуле. Если газ
одноатомный, то
![]() (38)
(38)
![]() (39)
(39)
![]() (40)
(40)
Для
многоатомных газов в (38) добавляется ![]() и
и ![]() . Энергия связи тримера можно
считать равной 2
. Энергия связи тримера можно
считать равной 2![]() , т.е.
, т.е.
![]() (41)
(41)
Далее
![]() (42)
(42)
и
![]() (43)
(43)
если
считать ![]() по (35).
по (35).
РАСЧЕТ ТЕПЛОЕМКОСТИ
РЕАЛЬНЫХ ГАЗОВ
Теплоемкость
димера из одноатомных молекул, как следует
из вышесказанного равна:
Ср2≈2,53R (44)
Поскольку у тримера из одноатомных молекул две колебательные степени
свободы и три вращательные, то Свр3≈0,773R; С3кол≈1,03R.
Поэтому
Ср3≈3,3R (45)
Димер и тример из многоатомных
молекул имеет три вращательные степени свободы. Поэтому для димера
будет
Свр2V≈0,773R; С3Vвр≈0,773R
Число
колебательных степеней свободы по-прежнему будет одна у димера
и две у тримера. Поэтому колебательная теплоемкость
остается без изменений. Напомним, что вследствие низкой энергии связи димеров и тримеров у них мало
уровней энергии и поэтому классические значения вращательной и колебательной
теплоемкости не подходят. Так И.Г.Каплан пишет, что у Ne2 всего 2 колебательных уровня, у кислорода – 7, у Ar2 – 8 и.т.д.[7].
Таким
образом, для многоатомных газов
И так,
Ср2≈2,79R; Ср3≈3,3R (46)
Найдя
концентрацию димеров и тримеров
по формулам (22-24) и (32,33 и 36)-(40) находим Ср по (10).
Ниже
приводится расчет теплоемкости для аргон
и азот, и сравнение теоретического значения с экспериментальными данными
1)
Расчет удельной теплоемкости Аргона при Т=155К, Р=1атм,10атм,100атм.
2)
Расчет удельной теплоемкости Азота при Т=150К, Р=1атм,10атм,100атм.
2-таблица сравнение
удельной теплоемкости для аргона при 155К
|
Р(атм) |
по (10)ср кДж/кг град |
по [1]ср кДж/кг град |
по (4)ср кДж/кг град |
|
1 |
0.536 |
0.527 |
0.523 |
|
10 |
0.630 |
0.601 |
0.558 |
|
100 |
1.776 |
1.703 |
0.904 |
3-таблица сравнение
удельной теплоемкости для азота при 150К
|
Р(атм) |
по (10)ср кДж/кгград |
по [1]ср кДж/кгград |
по (4)ср кДж/кгград |
|
1 |
1.059 |
1.050 |
1.044 |
|
10 |
1.190 |
1.160 |
1.157 |
|
100 |
3.001 |
2.911 |
2.102 |
Итак, теплоемкость
газа подсчитывается по формуле:
![]() (47)
(47)
Концентрации
комплексов находим из уравнений:
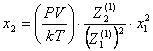
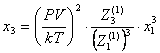 (48)
(48)
![]() (49)
(49)
Интегралы состояний, приходящиеся, на
одну молекулу будут
для одноатомных
газов:
![]() (50)
(50)
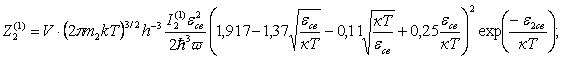 (51)
(51)
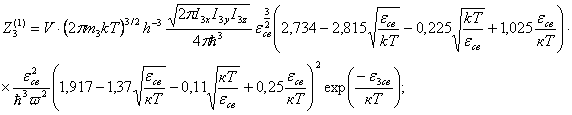 (52)
(52)
Для
многоатомных молекул:
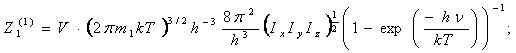 (53)
(53)
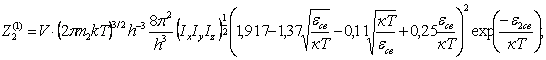 (54)
(54)
![]() - по (52),
- по (52),
где ν – собственная частота колебаний атомов в молекуле.
Как
видно из приведенных формул, аналитический расчет теплоемкости газа вряд ли
возможен. Возможно, с учетом выше сказанного можно подобрать полуэмпирическую
более компактную формулу. Но это другая задача. Мы ставили своей задачей
объяснить поведение теплоемкости реального газа вблизи точки насыщения.
Надеемся, нам это удалось.
СПИСОК ЛИТЕРАТУРЫ
1.
Вассерман А.А. и др.
Теплофизические свойства воздуха и его компонентов.
-М.:Наука,-1966,-375с
2.
Базаров И.П. Термодинамика –М.:Высшая школа,1976.-447
3. Шиллинг Г. Статистическая физика в примерах.М.:Мир, 1976.-432с
4. Павлов А.М., Калижанова
У.С. Теплофизические измерения в начале xxi века.
Часть
5. Павлов А.М., Кудинов А.И. Оптика и
спектроскопия 1999 Т86 №3 с388-389.
6. Е.Янке, Ф.Лёш Специальные функции.-М.:Наука, 1977.-344с.
7. Каплан И.Г.,
Родимова О.Б., Фомин В.В. В сб. «Спектральные проявления межмолекулярных
взаимодействий в газах»- Новосибирск:1982.-51-100с.
Резюме (Аннотация)
А.М.Павлов, У.С.Калижанова- Республика Казахстан, Восточно-Казахстанский государственный
университет им. С.Аманжолова, г.Усть-Каменогорск
КОМПЛЕКСЫ МОЛЕКУЛ И ТЕОРИЯ
ТЕПЛОЕМКОСТИ РЕАЛЬНЫХ ГАЗОВ
Комплексами молекул сейчас
занимаются во многих странах. Справочные данные приводятся обычно для
теплоемкости при постоянном давлении. Поэтому рассмотрим теорию этой теплоемкости. Комплексы молекул необходимо считать
самостоятельными компонентами и теплоемкость газа находить предварительно
определив отдельно молярные теплоемкости мономеров, димеров
и других комплексов. Интегралы состояний зависят от количества атомов в
молекуле и от количества молекул в комплексе
A.M.Pawlov, U.C.Kalizhanova – Republic Kazahstan,
East - Kazahstan State University
C.Amangolov , Ust-Kamenogorck sity.
COMPLEXES OF THE
MOLECULES AND THEORY HEATCAPACITY REAL GAS.
The
complexes of molecules attend to in many countries now. Reference
given happen to usually for heatcapacity under
constant davleniy. So we shall consider the
theory this heatcapacity. The
complexes of the molecules necessary to consider the independent component and heatcapacity gas to find beforehand definable apart moth heatcapacity monomer, dimmers and other comlex.
The integralsof the conditions hang from amount atom
in molecule and from amount of the molecules in comlex.