1В.Ф Валюк, 2В. Г Пивоваренко
1Уманський
державний педагогічний університет
ім. Павла Тичини, природничо-географічний факультет, кафедра агробіотехнологій та хімії,
02003, Україна, Умань, вул. Садова 2, e-mail: Vvalyuk@mail.ru
2 Київський
національний університет імені Тараса Шевченка, хімічний факультет, кафедра
органічної хімії. 01033 Україна, Київ, вул. Володимирська, 64.
Синтез N-арил- та
N-алкілпіридинієвих солей
Серед
дициклопентанопіридинієвих солей описані N-заміщені солі
2,3,5,6-бістриметиленпіридинію без замісників у бічних ароматичних кільцях [1],
які синтезували двома шляхами:
-
конденсацією циклопентанону, ароматичного альдегіду і первинного аміну в
молярному співвідношенні 2:1:1 з додаванням чотирихлористого вуглецю як
окисника. При цьому отримували солі з виходом 10-17%;
- реакцією
дикетонів з первинними амінами. Виходи солей 10-15%.
У перших спробах синтезу
N-метилдициклопентанопіридинієвих солей ми намагались проалкілувати дициклопентанопіридини по атому азоту
шляхом тривалого нагрівання (90°С, 15 діб) вихідної сполуки з
йодистим метилом у запаяній ампулі. Проте, в таких умовах методом ТШХ-аналізу
було зареєстровано утворення лише незначних кількостей піридинієвої солі, яка
на відміну від вихідної сполуки (блакитна флуоресценція), мала яскраво - жовту
флуоресценцію. Труднощі в алкілуванні атома азоту дициклопентанопіридину,
очевидно пояснюються значними стеричними перешкодами, які створюють атоми
гідрогену метиліденових груп.
N-метилпіридинієві
солі нами були отримані реакцією конденсації ароматичних альдегідів,
циклопентанону, метиламінгідрохлориду та ацетату натрію. Проте і в таких умовах
виходи цільових продуктів були невисокими.
Беручи до
уваги, що в умовах синтезу дигідропіридинів 1-3 поряд із цими сполуками
утворювались в невеликій кількості продукти їх подальшого окиснення – солі
піридинію, ми провели спробу синтезувати ці солі одноколбовим методом, шляхом
синтезу відповідних дигідропіридинів і подальшого їх окиснення у цільовий
продукт. Окиснення здійснювали еквімолярними кількостями пероксиду водню у
розведеній соляній кислоті. В результаті піридинієві солі були отримані з
виходом 8-15%. У багатьох випадках реакція супроводжувалась сильним осмоленням.
В подальших
дослідах виявилось, що значно кращим методом синтезу солей дициклопентано[b,e]піридинію
є двоколбовий варіант, коли нейонні високосиметричні проміжні сполуки – похідні
1,4-дигідропіридину виділяються у кристалічному вигляді (їх вихід при цьому
становить 80-90%) і далі окиснюються у піридинієві солі. Вихід останніх при
цьому становить 70-75%.
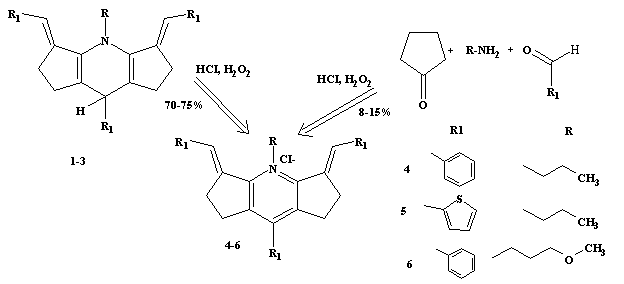 На стадії окиснення дигідропіридини 7-9 розчиняли в
етанолі та кип’ятили з еквімолярною кількістю концентрованої соляної кислоти і
пероксиду водню (контроль здійснювали методом ТШХ). Для повноти виділення
продукту реакції, суміш витримували 4-5 діб.
На стадії окиснення дигідропіридини 7-9 розчиняли в
етанолі та кип’ятили з еквімолярною кількістю концентрованої соляної кислоти і
пероксиду водню (контроль здійснювали методом ТШХ). Для повноти виділення
продукту реакції, суміш витримували 4-5 діб.
Схема 1.
На відміну
від дигідропіридинів які є безбарвними, солі гексагідродициклопентано[b,e]піридинію
забарвлені в яскраво-червоні, темно-пурпурові та оранжеві кольори. Завдяки
цьому можливо візуально спостерігати за їх утворенням. Швидкість перетворення
дигідропіридинів у відповідні солі залежить від кислотності середовища [2].
Так, у присутності оцтової кислоти цей перехід стає помітним через 3-4 години,
а в присутності більш сильних кислот (соляної, перхлоратної) майже відразу
після їх додавання реакційна суміш набуває насиченого червоного чи оранжевого
кольору, проте повний перехід до відповідних солей здійснюється за 1-2 години.
Властивість
дициклопентанодигідропіридинів переходити у відповідні кольорові піридинієві
солі може бути використана для якісного і, можливо, для кількісного визначення
цих сполук. Найбільш інформативними для доказу структури синтезованих сполук є
дані 1Н-ЯМР спектроскопії. Для всіх отриманих солей головною ознакою
є відсутність однопротонного синглету в області 4.30-4.80 м.ч (сигнал протону
8-Н дигідропіридинової системи) – сигналу, характерного для всіх вихідних
сполук, дициклопентанодигідропіридинів. Також для солей
гексагідродициклопентано[b,e]піридинію характерний зсув сигналів
метиленових груп у більш слабкі поля, до 3.24-3.49 м.ч. (порівняйте з
дигідропіридинами: 2.05-2.80 м.ч.). Сигнали олефінових протонів синтезованих
солей навпаки, знаходяться у більш сильних полях – 5.23-5.65 м.ч., ніж
відповідні сигнали в спектрах ПМР дигідропіридинів (6.49-7.44 м.ч.).
Висновки.
Розроблено
зручний і ефективний двоколбовий варіант синтезу піридинієвих солей.
Синтезовано ряди ряди N-арил- і N-алкілгексагідродициклопентано[b,e]піридинієвих
солей.
Література
1.
Саверченко
А.Н., Беккерова З.Р., Каминский В.А., Тиличенко М.Н. Реакция 1,5-дикетонов. Взаимодействие алициклических
1,5-дикетонов с первичными алифатическими аминами. // ХГС. – 1974. – № 2. – С.
243-246.
2.
Улдрикис Я.Р., Кумерова
А.О, Дубур Г.Я. Окисление 1,4-дигидропиридинов. Реакционная способность при
окислении хлоранилом // ХГС. – 1973. – Т. 5. – С. 691-694.