Кириллов В.Ю.1,
д.х.н., проф. Еркасов Р.Ш.2
1Кокшетауский государственный университет им. Ш. Уалиханова, Казахстан
2Павлодарский государственный
университет им. С. Торайгырова, Казахстан
Исследование
структуры E- и Z-изомеров виниловых эфиров оснований Шиффа методами квантовой химии
Виниловые эфиры оснований
Шиффа представляют интерес как полифункциональные мономерные соединения с целью
развития теории и практики функционально замещенных виниловых эфиров
аминоспиртов и дальнейшей разработки на их основе целенаправленных методов
синтеза новых биологически активных производных, обладающих комплексом свойств,
важных для практического применения.
Виниловые эфиры оснований Шиффа образуются в
результате реакции винилового
эфира моноэтаноламина с бензальдегидом и его производными, фурфуролом,
циклогексаном взятыми в эквимольных количествах [1]:
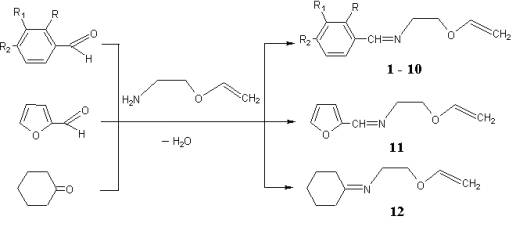
R=R1=R2=H (1), R=R1=H, R2=F (2), R=R1=H R2=O-CH3 (3), R=R2=O-CH3 (4), R=H, R1=R2=O-CH3 (5), R=R2=H, R1=O-CH3 (6), R=R1=H, R2=NO2 (7), R=R2=H, R1=NO2 (8), R1= R2=H, R=OH (9), R=R1=H, R2=N(CH3)2 (10)
Виниловые эфиры оснований Шиффа относятся
к соединениям, содержащим двойную связь между атомами углерода и азота. Двойная
связь между атомами углерода и азота пространственно расположена таким же
образом, как и двойная связь между двумя углеродными атомами. Место четвертого
заместителя занимает свободная электронная пара атома азота. Следовательно, для
виниловых эфиров оснований Шиффа характерно существование син-анти-изомеров (сейчас
их чаще называют (Z,E)-изомерами).
Более
полную информацию о реакционной способности органических соединений дают
расчеты геометрии, относительной стабильности и электронной структуры. Расчеты
газофазных систем наиболее широко распространены, так как их легче выполнить.
Геометрические
характеристики позволяют получить интересную информацию о строении соединений и
поэтому представляют самостоятельный интерес с точки зрения химиков-органиков [2]. Характеристиками геометрического строения
молекул являются: длина связи (нм), валентный угол (ω) и торсионный (двугранный) угол (τ°).
Одним из наиболее
достоверных источников сведений о строении молекул являются расчетные методы квантовой химии,
которые по своей точности часто не уступают экспериментальным методам, а по
разнообразию даваемой информации значительно их превосходят. Материальные
затраты при этом не больше, чем при прецизионных экспериментальных подходах.
Совместное использование расчетных и экспериментальных методов приводит к
наиболее полной картине молекул и к исчерпывающей совокупности данных для
каждой молекулы.
Используя программу Instant JChem v.2.2.1 (ChemAxon, Hungary) [3], основанную на программах ChemAxon's JChem и Marvin, произвели все возможные
стереоизомеры виниловых эфиров оснований Шиффа в 3D-изображении.
Затем структуры изомеров перевели в программу HyperChem v.6.0 [4]. Расчеты проводили полуэмпирическим методом
PM3 с полной оптимизацией геометрии, градиент 0,01. Расчет проводился в рамках
ограниченного метода Хартри-Фока. Далее с использованием пакета программ MOPAC v.7
проводили расчет полуэмпирическим методом PM3 [5-6].
|
Таблица - Теплоты
образования (ΔfH
|
Согласно
квантово-химическим расчетам (таблица) теплота образования E-изомеров
виниловых эфиров оснований Шиффа при стандартных условиях возрастает в ряду 1 < 10 < 8 < 7 < 11 < 3 < 2 < 9. Аналогичная картина наблюдается и
для Z-изомеров данных молекул. Сравнение теплот
образования E- и Z-изомеров показывает, что E-изомеры
более устойчивы, чем Z-изомеры при стандартных условиях. Отрицательный знак ΔfH На рисунках 1-3 представлены геометрическая
и шаростержневая модели, длины
связи, валентные |
||||||||||||||||||||||||||||||||
и торсионные углы молекул E- и Z-изомеров винилового эфира N-(бензилиден) оксиэтиламина (1), винилового эфира N-(фурилиден)
оксиэтиламина (11) и винилового эфира N-(циклогексилиден) оксиэтиламина (12).
Анализ геометрических
параметров оптимизированных структур (рисунки 1-3) E-изомеров соединений 1, 2, 3, 7, 8, 9, 10, 11 показывает, что во всех рассматриваемых
молекулах С=N группа располагается в разных
плоскостях с другими группами (торсионные углы
C(2)-C(7)-N(8)-C(9) лежат в
области -178,830°-179,044°, C(7)-N(8)-C(9)-C(10) -133,496°-137,052°, N(8)-C(9)-C(10)-O(11)
+176,570°-177,342° (исключение составляет соединение 3 -177,708°), C(9)-C(10)-O(11)-C(12)
+81,709-91,761° (исключение составляет соединение 3 +179,507°), C(10)-O(11)-C(12)-C(13)
-0,039°-0,281° (исключение составляют соединение 2 +6,782° и 3 +0,320°));
анализ Z-изомеров также показывает, что в рассматриваемых
молекулах С=N группа располагается в разных
плоскостях с другими группами (торсионные углы
C(2)-C(7)-N(8)-C(9) лежат в
области +1,775°-1,905° (исключение составляют соединение 9 +0,844° и 11 +0,825°),
C(7)-N(8)-C(9)-C(10)
-128,190°-135,694° (исключение составляет соединение 9 -101,013°), N(8)-C(9)-C(10)-O(11) -175,298°-178,209°, C(9)-C(10)-O(11)-C(12) +179,017-179,627°, C(10)-O(11)-C(12)-C(13) +0,323°-0,605°); сравнение торсионных углов Z- и E-изомеров
исследуемых соединений показывает: углы C(7)-N(8)-C(9)-C(10) лежат в
одной области; углы N(8)-C(9)-C(10)-O(11), C(9)-C(10)-O(11)-C(12) и C(10)-O(11)-C(12)-C(13) E-изомера соединения 3 и Z-изомеров лежат в одной области.
Длины связей Z- и E-изомеров
исследуемых соединений, а также соединения 12
C(2)-C(7)
(0,146-0,147 нм), C(7)=N(8) (0,128-0,129 нм), N(8)-C(9) (0,146 нм),
C(9)-C(10)
(0,153-0,154 нм), C(10)-O(11) (0,142-0,143 нм), O(11) –C(12)
(0,136-0,138 нм), C(12)=C(13) (0,133 нм) одинаковы и соответствуют усредненным
значениям геометрических параметров, характерных для данных связей, приведенных
в справочниках [7].
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
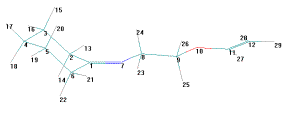
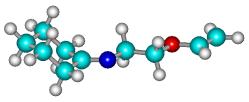
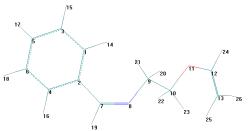
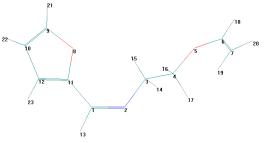
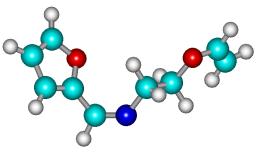
Рисунок 1
– Геометрическая и шаростержневая модели, длины связи, валентные и торсионные
углы молекулы 12
E-изомер
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Z-изомер |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
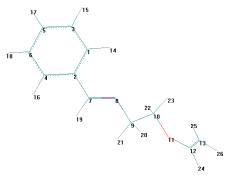
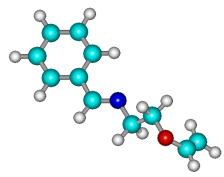
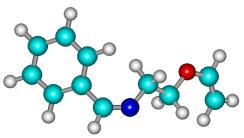
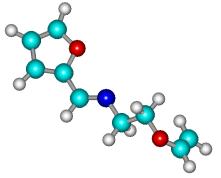
Рисунок 2
- Геометрическая и шаростержневая модели, длины связи, валентные и торсионные углы E- и Z-изомеров
молекулы 1
|
E-изомер |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Z-изомер |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
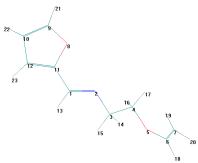
Рисунок 3
– Геометрическая и шаростержневая модели, длины связи, валентные и торсионные
углы E- и Z-изомеров молекулы 11
При практически идентичной
геометрии и столь близких значениях структурных параметров сравниваемых виниловых
эфиров оснований Шиффа различия в их реакционной способности, безусловно,
должны определяться электронными и стерическими свойствами азометиновой группы.
Литература:
1.
Шостаковский
М.Ф., Минбаев Б.У., Кирилюс И.В., Аймаков О.А. Взаимодействие винилового эфира
моноэтаноламина с альдегидами //Изв. АН СССР. Сер. хим. - 1978. - С. 1217-1220.
2.
Бурштейн К.Я., Шорыгин П.П. Квантово-химические расчеты в органической
химии и молекулярной спектроскопии. - Москва, 1989. – 104 с.
5. Stewart J.J.P. MOPAC. Manual (Seventh Edition), 1993. – Р. 277
6.
Stewart J.J.P. Optimization of Parameters for Semi-Empirical Methods
I-Method //J. Comp. Chem. - 1989. - № 10 (221).
7.
Краткий справочник
физико-химических величин. 7-е изд., испр. / Под ред. Мищенко К.П. и Равделя
А.А. - Л.: Химия, 1974. – 200 с.