Бондарчук С. В., Минаев Б. Ф., Фесак А. Ю.
Черкасский национальный университет им. Б. Хмельницкого
Зависимость между электронным строением
ненасыщенных соединений и их активностью в реакции Меервейна
Известно, что
ненасыщенные соединения (НС), содержащие электроно-акцепторные группы в
молекуле являются более активными субстратами, в условиях реакции Меєрвейна, чем
те, которые содержат электронодонорные заместители [1]. Кроме того, потеря
стереоселективности реакции объясняется образованием катион-радикалов НС в
каталитическом цикле с возможностью свободного вращения вокруг С![]() С связи [2]. К тому же, формирование катион-радикального состояния НС
считается важным критерием протекания реакции Меервейна. Понятно, что в таком
случае должна существовать корреляция между энергией высшей занятой
молекулярной орбитали (ВЗМО) и выходом продукта реакции Меервейна.
С связи [2]. К тому же, формирование катион-радикального состояния НС
считается важным критерием протекания реакции Меервейна. Понятно, что в таком
случае должна существовать корреляция между энергией высшей занятой
молекулярной орбитали (ВЗМО) и выходом продукта реакции Меервейна.
Основываясь на
обширных экспериментальных данных [1, 3], нами были проведены квантовохимические
расчеты методом функционала плотности DFT/B3LYP/6-31G(d, p) различных НС, ранее изученных в реакции
Меервейна. Для расчетов использовали программный пакет Gaussian03 [4]. Расчеты
показывают, что зависимость между энергией ВЗМО олефинов, диенов и других НС и
выходом продукта реакции не наблюдается. В то же время, нами была установлена
подобная корреляция выходов с энергиями нижней вакантной молекулярной орбиталью
(НВМО) изученных НС, что возможно либо в случае образования анион-радикала, либо
при возбуждении НС в триплетное состояние.
В качестве модельных
соединений нами были выбраны 12 НС с различной структурой. Модельной реакцией
было принято взаимодействие данных НС с хлоридом п-нитрофенилдиазония (выходы продуктов реакций взяты из работы
[3]). Полученные зависимости изображены
на рисунке 1, расчетные данные собраны в таблице 1.
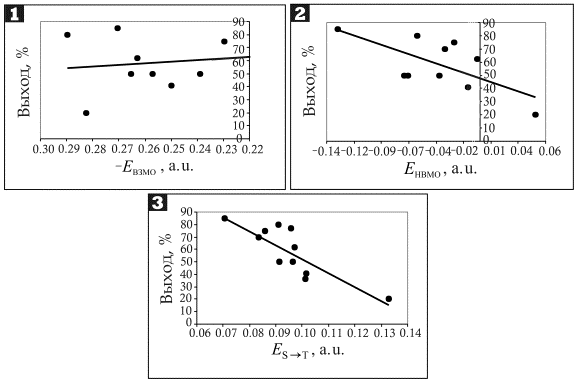
Рис. 1. Зависимость выходов
продуктов реакции Меервейна от энергий ВЗМО (1), НВМО (2) и
триплетного возбуждения (3) субстрата
В условиях реакции образование анион-радикалов НС
невозможно, поэтому вероятным остается вариант триплетного возбуждения субстрата.
Наши расчеты триплет-возбужденных молекул НС дают деформированную геометрию
ненасыщенного фрагмента с двугранным углом RR1С=СR2R3
равным 90° в случае олефинов (симметрия D2d в этилене). Для 1,3-бутадиена в
триплетном состоянии подобное искажение характерно лишь для одного из
ненасыщенных фрагментов. НС, имеющие циклическую природу, в триплетном
состоянии остаются недеформированными.
В то же время, расчеты катион-радикалов НС указывают на
почти плоское строение фрагмента RR1С=СR2R3 и для
этилена угол НССН составляет 27.3°, что хорошо согласуется с экспериментом [5].
Рассчитанный нами потенциальный барьер вращения вокруг связи С![]() С составляет для этилена 0.57 эВ, а для
акриловой кислоты, которая является значительно более активной в реакции
Меервейна, он равен 1.12 эВ. Таким образом, исходя из катион-радикальной модели
становится непонятным, почему акриловая кислота более активна, чем этилен.
Проведенные нами TD DFT расчеты электронных спектров НС указывают на то, что
первым триплетным возбуждением является π→π* (или n→π*) переходы из ВЗМО (или близлежащей n-орбитали) на НВМО. Представления о триплетных возбуждениях НС в
ходе реакции Меервейна подтверждаются хорошей корреляцией выходов с энергией
триплетного возбуджения НС в адиабатическом приближении (рис. 1, 3).
Коэффициент достоверности аппроксимации R2 в данном случае равен
0.6709, что при учете различных условий проведения реакции и подходов к
определению выходов продуктов является надежным показателем.
С составляет для этилена 0.57 эВ, а для
акриловой кислоты, которая является значительно более активной в реакции
Меервейна, он равен 1.12 эВ. Таким образом, исходя из катион-радикальной модели
становится непонятным, почему акриловая кислота более активна, чем этилен.
Проведенные нами TD DFT расчеты электронных спектров НС указывают на то, что
первым триплетным возбуждением является π→π* (или n→π*) переходы из ВЗМО (или близлежащей n-орбитали) на НВМО. Представления о триплетных возбуждениях НС в
ходе реакции Меервейна подтверждаются хорошей корреляцией выходов с энергией
триплетного возбуджения НС в адиабатическом приближении (рис. 1, 3).
Коэффициент достоверности аппроксимации R2 в данном случае равен
0.6709, что при учете различных условий проведения реакции и подходов к
определению выходов продуктов является надежным показателем.
Образование триплетных НС в условиях реакции
Меервейна может происходить за счет обменного взаимодействия парамагнитных
частиц (арильных радикалов или триплетных арильных катионов) с НС [6].
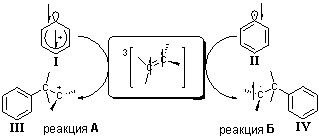
Описанные взаимодействия могут быть представлены в виде схемы 1. Формирование карбкатиона
III (схема 1) характерно для некатализируемого взаимодействия НС с
диазосоединениями, в то время как жирно-ароматические радикалы IV
образовываются в случае катализируемой реакции Меервейна. Реакции А и Б