Горбунов Л.В., Чернова Н.С.
Институт животноводства
НААН, г. Харьков
ОБЕСПЕЧЕНИЕ УСЛОВИЯ
СОПОСТАВИМОСТИ РЕЗУЛЬТАТОВ КРИОКОНСЕРВИРОВАНИЯ
ЧЕРЕНКОВ ПЛОДОВО-ЯГОДНЫХ КУЛЬТУР
Повышение воспроизводимости результатов эксперимента необходимо для
снижения количества опытов при проведении многофакторного эксперимента. Воспроизводимость
результатов опытов зависит от индивидуальных свойств биообъекта и эффективности
этапов его криоконсервирования [8, 9]. Поскольку воспроизводимость результатов
эксперимента является необходимым условием проведения научного исследования, то
изучение закономерностей определяющих сохранности деконсервированного
биообъекта является актуальным в практике низкотемпературного хранения черенков
ягодных культур.
Общепринятый
способ оценки эффективности криоконсервирования производится по состоянию
деконсервированного биообъекта [1, 2, 3]. На способность к развитию черенков плодово-ягодных
культур в условиях in vitro и in vivo
оказывает влияние комплекс факторов, которые условно можно разделить на
биологические и технологические. К биологическим следует отнести: породу, сорт,
выбор побега и срока черенкования [1, 4,
6, 7]. К технологическим факторам заготовка побегов и нарезка
черенков, применение способа прививки почки или черенка на новые растения (для
плодовых пород), приемы, облегчающие корнеобразование, влажность, состав почвы,
применение регуляторов роста (для некоторых плодовых пород и ягодных
кустарников)
[5, 6. 7].
У черенков, взятых из разных мест дерева или
кустарника, способность к образованию корней неодинакова: те которые
заготовлены из побегов нижнего яруса кроны, из волчков или порослевых побегов,
укореняются лучше, чем из побегов верхнего яруса [5, 6, 7]. Черенки из
вегетативных побегов укореняются легче, чем из цветковых, из осевых побегов
слабее, чем из боковых. Установлена прямая зависимость между порядком ветвления
(в пределах от 0 до 3) побега и укоренением [4]. Черенки черной смородины
повышают процент укоренения в зависимости от порядка ветвления от 8%, для
нулевого, до 84% - первого, 93% - второго, 95% – третьего, а для крыжовника 7%,
63, 75%, соответственно. С целью повышения корнеобразования в 2÷4,5 раза
применяются следующие приемы: кольцеобразование, этиоляция (затемнение),
выгонка (повышение температуры, влажности, затемнение) [4, 6, 7].
К настоящему времени
разработано большое разнообразие схем обработки стимуляторами роста разных
сортотипов черенков. Для укоренения одревесневших ягодных черенков наиболее
часто используют: Гетероауксин, Корневин и Эпин-Экстра [5, 6, 7]. Стимуляторы
роста оказывают эффективное действие
на корнеобразование только в том случае, когда учитываются сортотип, возраст и
физиологическое состояние черенка, температура, свет, влажность, субстрат и
другие факторы, оказывающие влияние на образование
корней [5, 6, 7]. При
выборе оптимальной схемы обработки деконсервированных черенков необходимо
использовать только одревесневшие черенки, заготовленные зимой, которые
являются наиболее подходящим материалом для криоконсервирования.
На способность к развитию
деконсервированных черенков так же влияет способы сушки, температурной
адаптации, замораживания-отогрева и регидратации [8, 9]. Учет изменения
жизнеспособности биообъекта на разных этапах его криоконсервирования повышает
воспроизводимость эксперимента и обеспечивает условия сопоставимости
результатов полученных при разных условиях проведения эксперимента [8, 9]. Поэтому для сохранения генофонда растительных клеток
необходимо изучить воспроизводимость результатов криоконсервирования
черенков различных сортотипов и определить эффективность отдельных этапов их
криоконсервирования.
Таким
образом, повышение воспроизводимости результатов сохранности половых клеток
растительного происхождения связано с необходимостью изучения индивидуальных
свойств биообъекта обусловленного его сортовым различием. Следовательно,
изучение закономерностей воспроизводимости результатов криоконсервирования
половых клеток растительного происхождения, является актуальной задачей,
решение которой дает возможность выполнять многофакторное исследование при
малом количестве повторов опыта, что позволяет научно обосновывать новые
подходы к созданию эффективных способов криоконсервирования.
Цель создать
математическую модель, повышающую воспроизводимость результатов полученных на
различных этапах криоконсервирования черенков разных сортов плодово-ягодных
культур.
Материалы и методы исследования
Объектом исследования
были черенки: черной смороды (Ribes nigrum L.) – Дачница. Черенки нарезаны из однолетних побегов и
разделены на отдельные образцы по 10±2 шт., длинной 10 – 12 см и диаметром 0,7 – 1,0
см. Черенки имели от 3 до 5 вегетативных почек. Перед высушиванием образцов
определяли их начальную влажность и жизнеспособность. Для исследования брали образцы с жизнеспособностью
сто процентов.
Контроль жизнеспособности и сохранности черенков проводили
после каждого этапа высушивания и охлаждения. Для этого черенки помещали в
эксикатор, над водой, на 14 дней для осуществления их гидратации при
температуре 5 °С, а потом культивировали в условиях in vitro (в стаканах с водой при температуре t
= 20 ºС) и in
vivo для ягодных культур (укоренение черенков в грунте).
Набухание и развитие почек указывало на жизнеспособность исследуемых образцов.
Процент жизнеспособности оценивался как отношение количества черенков с
распустившимися почками в условиях in
vitro или in vivo к общему числу.
Показатель сохранности оценивали при
помощи морфо-анатомических исследований с использованием биномонокуляра
посредством проведения гистологических срезов почек и черенков (препарирование
для определения площади повреждения по цвету), которые определялись.
Степень влажности для нативных черенков изменяли
от 50 до 30%, при температуре -5±2 ºС, влажности воздуха 85±5 % [2]. Влажность образцов – ŋ (%) определяли взвешиванием
и рассчитывали по формуле:
ŋ = ((m0
-mk)/ m0)×100%, (1),
где: m0 - начальная масса нативного образца, г; mk - конечная масса образца
после обезвоживания до постоянной массы,
г.
Обезвоживание и температурная адаптация
черенков производилась при температуре -5±2 ºС в течении от
1,5 до 2 месяцев. Замораживание черенков
реализовывали охлаждением
со скоростью 0,01 ÷ 0,1 °C/ч до -30 °С, после их выдержки 5 - 7 суток при температуре -10 °С, при помещении образцов, размещенных в бытовых термосах ёмкостью 1,5, в
рефрижератор. Образцы замораживали от температуры -30 до -196 °С
непосредственным их погружением в жидкий
азот со скоростью 600 ÷ 800 °C/мин.
Хранение образцов проводилось в жидком азоте с выдержкой от одних суток до
одного года. Оттаивание образцов со скоростью 70 °C/мин проводили при температуре 20
°С.
В качестве
стимуляторов роста использоваться Корневин.
Исследованы четыре группы, первая после замораживания и вторая без с
применением Корневина и последующем развитием черенков в воде in vitro,
а третья и четвертая в почве in vivo. При приготовлении водных растворов навеску
стимулятора роста предварительно растворяли в небольшом количестве горячей воды
в стеклянной посуде небольшого размера и заливали водой, тщательно помешивая до
полного растворения. Небольшое количество воды с растворенным веществом
доводили до нужного объема. Использовали Корневин в концентрации 50-70 мг на 1
л воды, выдерживая черенки в течении 18-24 часа. Черенки погружать в раствор на
3/4 их длины. Обработку черенков проводили при температуре 20-23 °С в помещении, укрытом от
прямых солнечных лучей.
Статистический анализ полученных
результатов проводили по общепринятым
формулам [10] на основе применения стандартных и разработанных
программ для работы на ЭВМ. Для удобства восприятия полученные значения
жизнеспособности переводили в проценты.
Результаты
исследования и их обсуждение
Анализ проведенных нами экспериментов [8, 9] показал, что вероятность развития
деконсервированных черенков разных пород и сортов плодово-ягодных культур
варьирует от 0 до 100% и зависит от множества биологических и технологических
факторов. Для повышения воспроизводимости результатов предложена математическая
модель оценки эффективности составляющих этапов криоконсервирования биообъекта
учитывающая его индивидуальные особенности. Оценка вероятность жизнеспособности
деконсервированных черенков V [у.е.]
производилась на основе формулы Байеса, что зависит от начального состояния
биобъекта Vo и условных
вероятностей отражающих эффективности отдельных этапов криоконсервирования W:
![]() (2)
(2)
где Wt, Wz, Wr, Wk и Wp – эффективности этапов: сушки и
температурной адаптации черенков; замораживания до температуры жидкого азота;
регидратации; культивирования черенков в условиях in
vitro и in vivo.
На исследование
отбирались черенки с начальной жизнеспособностью 100%. Эффективность
культивирования вычисляли из выражения (2) как Wk=V/Vo, а температурной
адаптации Wt =V/(VoWk). Условия
проведения эксперимента [8, 9] построены таким образом, что эффективности
культивирования в условиях in vitro, сушка, температурная адаптация и регидратация
практически не влияли на жизнеспособность черенков то есть Vo≈Wk≈Wt≈Wr≈1
у.е.
Анализ
экспериментальных данных криоконсервирования различных пород и сортов
исследуемых черенков плодово-ягодных культур показал, что основным фактором,
определяющим низкую воспроизводимость результатов, является эффективность
режима замораживания. Эффективность процедуры замораживания Wz разных пород и
сортов черенков плодово-ягодных культур изменяется от 0 до 1. Для анализа
особенностей режима замораживания конкретного сорта черенков общая величина
эффективности разбита на три составляющих подэтапа:
![]() (3)
(3)
где: w1 , w2 и w3 условные вероятности охлаждения черенков до -10 , -30 и -196 0С.
Эффективности
охлаждения определяли: на первом этапе как отношение жизнеспособности V1 черенков после охлаждения до -100С к их начальному
состоянию Vo из выражений (2 и 3) w1=V1/(VoWkWtWr)=V1/Vo; на
втором этапе как отношение жизнеспособностей при охлаждении до -300С
и -10 0С из выражений (2 и 3) w2=V2/(VoWkWtWrw1)=V2/V1; на
третьем этапе до -196 0С и
-300С из выражений (2 и 3) w3=V3/(VoWkWtWrw1 w2)=V3/V2.
Для определения
закономерностей воспроизводимости результатов криоконсервирования черенков
различных сортов семечковых плодовых деревьев проанализированы полученные нами
данные [8, 9]. Объектом
исследования были черенки: яблони (Malus domestica L.) – Белый налив,
Амулет; Эдэра; Теремок; Радость; Катя; грушы (Pyrus communis L.) летней
- Велика літня, Улюблена Клапа, осенней - Городищенська, Вдала, зимней - Бере
Київська, Зелена Мліївська.
Величина
общей эффективности замораживания-оттаивания ф(3) для различных сортов яблони
варьирует от 0% до 36%, груши 0 – 86% (рис. 1). 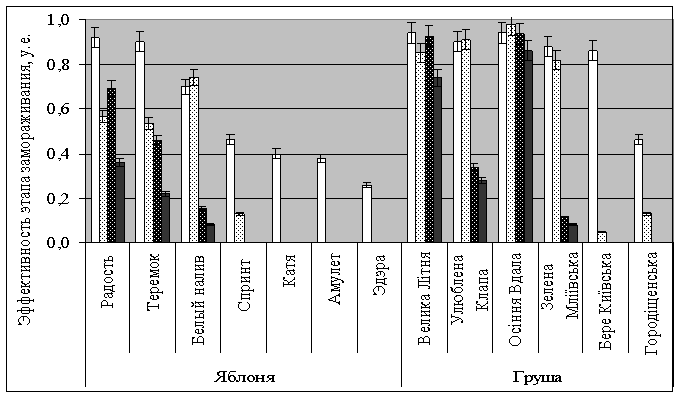
Рис. 1 Значения эффективности этапов охлаждения черенков различных сортов
семечковых плодовых деревьев до: -10 0С
(□) -300С (▒), -196 0С (▓) и общая величина
замораживания-оттаивания до 20 0С (■).
Эффективности
охлаждения до -10 0С имеют разброс для яблони от 26% (сорт
Эдэра) до 92% (Радость) и груши 46%
(Городіщенська) – 94% (Велика Літня, осіння Вдала). Охлаждение на втором этапе
до -30 0С дает разброс
показателей эффективностей для яблони от 0% (Эдэра, Амулет, Катя) до 57%
(Радость) и груши от 0% (Городіщенська, Бере Київська) до 65% (Велика Літня).
Замораживание черенков яблони на третьем этапе до
-196 0С даёт разброс от 0% (Эдэра, Амулет, Катя, Спринт) до 69%
(Радость) и груши от 0% (Городіщенська, Бере Київська) до 93% (Велика Літня).
Причина снижения
жизнеспособности связана с внутриклеточным кристаллообразованием,
подтверждением этому являются показатели сохранности данных образцов. Значимые
расхождения для разных сортов, вероятно, зависят от концентрации сахара во внутриклеточной
среде.
Для повышения
воспроизводимость результатов криоконсервирования черенков различных сортов
косточковых плодовых деревьев исследованы образцы: вишни (Prunus cerasus
L.) – Степная, Амулет, Пам'ять Артеменка, Оптимістка; Ночка; Дюк (вишнево-черешневий
гібрид) - Альфа; черешни (Prunus avium) - Читинськая чёрная, Дончанка,
Легенда Млієва, Дар Млієва; сливы (Prunus domestica L.) ренклод -
Альтана, Пам'ять матері, Опошнянка, угорка - Волошка, Ода; абрикоса (Prunus
armeniaca L.) - Молдавський олімпієць, Кримський медунець.
Величина общей
эффективности замораживания-оттаивания ф(3) для различных сортов вишни
изменяется от 0 до 68%, черешни 0 –
60%, сливы и абрикоса 0% (рис. 2).
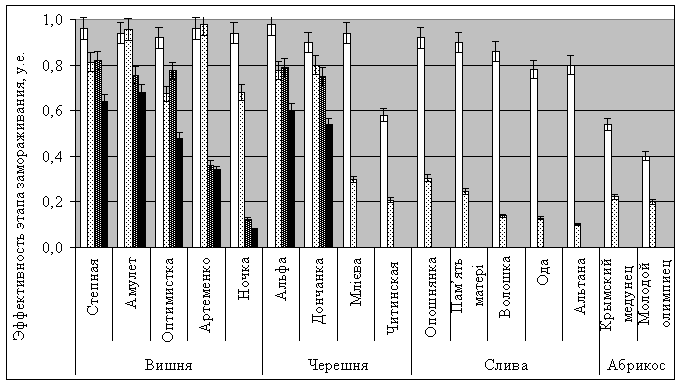
Рис. 2 Значения эффективности этапов охлаждения черенков различных сортов
косточковых плодовых деревьев до: -10 0С
(□) -300С (▒), -196 0С (▓) и общая величина
замораживания-оттаивания до 20 0С (■).
Эффективности
охлаждения до -10 0С дает разброс для вишни от 92% (сорт Оптимистка)
до 96% (Степная, Память Артеменко), черешни от 58% (Читинская) до 98% (Альфа),
сливы от 78% (Ода) до 92% (Опошнянка), абрикоса от 40% (Молодой олимпиец) до
54% (Крымский медунец). Охлаждение на втором этапе до -300С дает разброс показателей эффективностей для
вишни от 67% (Оптимистка) до 98% (Память Артеменко), черешни от 21% (Читинская)
до 80% (Дончанка), сливы от 10% (Альтана) до 30% (Опошнянка), абрикоса от 20%
(Молодой олимпиец) до 22% (Крымский медунец). Замораживание черенков вишни на третьем этапе до -196 0С даёт
разброс от 13%
(Ночка) до 82% (Степная), черешни от 0% (Читинская, Легенда Млієва) до 79%
(Альфа), для сливы и абрикоса 0%
Для оценки
воспроизводимость результатов криоконсервирования черенков различных сортов
ягодных культур исследованы образцы: черной смороды (Ribes nigrum L.) –
Дачница, Китаївська, Софіївська, Ювілей, Радужна, Тітінія, Дар Павлової,
Катюша, Надія, Софія, Альта, Шедевр, Дарунок Млієва, Лєнтяй, Увертюра, Міф, Галинка,
Либідь, Бен Тіран, Бірюлевська, Німфа, Ювілейна Копаня, Краса Львова,
Білоруська солодка, Славута, Віра, Чорна крупноплідна, Аметист, Ожерелье;
красной смородины (Ribes rabrum) -
Китаївська, Джокер, Святкова; крыжовника (Ribes uva-crispa):
Красень, Малахіт, Колобок; малины (Rubus idaeus L.) - Новость Кузмина,
Скромница, Струйка; винограда (Vitis labrusca L.) – Лидия, Ркацетели,
Алиготе, Кобер 5ББ, Траминер розовый.
Поскольку часть
исследуемых сортов имели жизнеспособность нативных образцов ниже 100%, то из
дальнейших опытов они были изъяты. Данными образцами являлись сорта черной
смородины: Радужна, Тітінія, Дар Павлової, Катюша, Надія, Софія, Альта, Шедевр,
Дарунок Млієва, Лентяй, Увертюра, Міф, Галинка, Либідь, Бен Тіран, Бірюлевська,
Німфа, Ювілейна Копаня, Краса Львова, Білоруська солодка, Славута, Віра, Чорна
крупноплідна, Аметист, Ожерелье.
Величина общей
эффективности замораживания-оттаивания ф(3) для различных сортов черной
смородины изменяется от 0% до 92%,
красной 0 – 54%, крыжовника 0 – 48%,
малины 0 – 70% и винограда
составляет 0% (рис. 3).
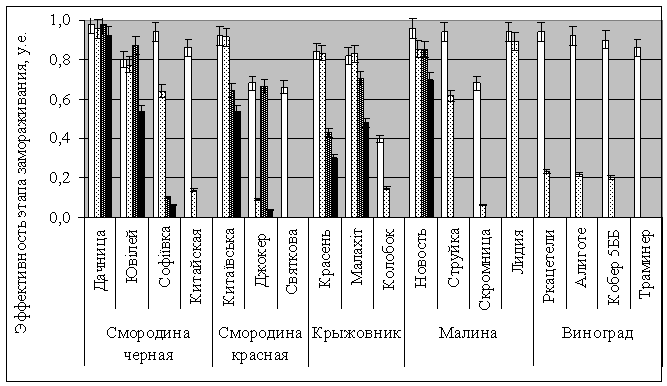
Рис. 3 Значения эффективности этапов охлаждения черенков различных сортов
ягодных плодовых культур до: -10 0С
(□) -300С (▒), -196 0С (▓) и общая
величина замораживания-оттаивания до 20 0С (■).
Эффективности охлаждения до -10 0С дает разброс для черной смородины от 80% (Ювілей) до 98% (Дачница), красной от 66% (Святкова) до 92% (Китаївська), крыжовника от 40% (Колобок) до 84% (Красень), малины от 68% (Скромница) до 96% (Новость Кузьмина), винограда от 86% (Траминер розовый) до 94% (Ркацетели). Охлаждение на втором этапе до -300С дает разброс показателей эффективностей для черной смородины от 14% (Китайская) до 96% (Дачница), красной от 0% (Святкова) до 91% (Китаївська), крыжовника от 15% (Колобок) до 83% (Красень, Малахіт), малины от 6% (Скромница) до 85% (Новость Кузьмина), винограда 0% (Траминер розовый, Кобер 5ББ, Алиготе, Ркацетели). Замораживание черенков для черной смородины на третьем этапе до -196 0С дает разброс значений от 0% (Китайская) до 98% (Дачница), красной от 0% (Святкова) до 67% (Джокер), крыжовника от 0% (Колобок) до 71% (Малахіт), малины от 0% (Скромница, Струйка) до 85% (Новость Кузьмина), винограда 0% (Траминер розовый, Кобер 5ББ, Алиготе, Ркацетели).
На жизнеспособность
деконсервированных черенков значимое влияние оказывает длительность нахождения
образцов в жидкой фазе азота вследствие его проникновения внутрь черенков.
Результаты опытов показали, что содержание черенков малины до 6 месяцев
приводит к полному механическому разрушению образцов при отогреве. Значимо
меньшему влиянию подвержены образцы черной смородины. При хранении образцов в
парах жидкого азота механических разрушений черенков не обнаружилось.
Дальнейшая
апробация предложенной математической модели (выражения 2 и 3) проводилась с
целью определения эффективности этапов криоконсервирования и культивирования. Проведен
опыт с применением гормона роста (корневин см. табл.1) черенков черной
смородины сорта Дачница. Для определения показателей жизнеспособности в каждой
группе использовалось по три серии содержащих по 30 черенков в каждом.
Таблица. 1.
Влияние гормона роста на
развитие до и после консервирования черенков черной смородины сорта Дачница,
оценку эффективности их криоконсервирования и культивирования
|
Развитие в условиях |
Криоконсервирование |
Применение гормона роста
(корневид) |
|||||
|
да |
нет |
||||||
|
Жизнеспособность, % |
Эффективность этапа, % |
Жизнеспособность, % |
Эффективность этапа, % |
||||
|
криоконсервирования |
культивирования |
криоконсервирования |
культивирования |
||||
|
in vitro |
да |
88,9±1,1 |
88,9±1,1 |
40,0±1,9 |
86,7±1,9 |
86,7±1,9 |
20,0±1,9 |
|
нет |
100±0,0 |
100±0,0 |
|||||
|
in vivo |
да |
33,3±1,9 |
83,3±0,8 |
37,5±2,2 |
16,7±1,9 |
83,0±1,7 |
19,2±1,8 |
|
нет |
40,0±1,9 |
20,0±1,9 |
|||||
Жизнеспособность
деконсервированных черенков поставленных на культуру в воду (in vitro) после
обработки гормоном роста составила Vdk=88,9±1,1% и без Vdk= 86,7±1,9%. Вероятность развития черенков в контроле
(без замораживания) при использовании
гормона составила
Vk=100±0,0% и
без Vk=100±0,0%.
Эффективность криоконсервирования вычисляли из выражения Wd=Vdk/Vk из формулы (2)
описывающей полную вероятность жизнеспособности после культивирования без криоконсервирования
Vk=VoWk и после Vdk=VoWdWk. Начальная жизнеспособность
образца Vo=1 у.е. Эффективность криоконсервирования
составила в группе с гормоном роста Wd=88,9±1,1% и без Wd=86,7±1,9%. Подобные величины получены при вычислении
вероятности развития черенков в условиях in vivo Wd=83,3±0,8 и без Wd=83,0±1,7% Wd=Vdp/Vp получено из выражения (2) Vdp=VoWdWp.
Развитие
деконсервированных черенков в грунте (in vivo)
с гормоном составило Vdp=33,3±1,9 и без Vdp=16,7±1,9%. Развитие в контрольных группах составило Vp=40,0±1,9 и Vp=20,0±1,9 %, соответственно.
Эффективность развития черенков в условиях in vivo, без
криоконсервирования, определяется из выражения Vp=VoWp. Поскольку
начальная жизнеспособность черенков Vo=1 у.е. то при использовании
гормона Vp=Wp=40,0±1,9 и без Vp=Wp=20,0±1,9. Данные величины отличаются в два раза и
отражают влияние гормона роста на развитие черенков. Такие же величины получены
при оценке эффективности культивирования деконсервированных черенков Wp=Vdp/Vd.
Полученные
результаты показывают, что жизнеспособность деконсервированных черенков черной
смородины Дачница может многократно
отличается между собой и зависит от условий криоконсервирования и развития в
условиях in vitro или in vivo, применения гормона роста. Для черенков черной
смородины Дачница разброс составил от 16,7 до 40%. Тогда как относительные показатели, характеризующие
эффективность криоконсервирования дают разброс значений в 3,8 - 40 раз ниже, от
83,0 до 88,9% и культивирования 19-20 % и с гормоном роста 37,5-40%.
Показано, что у деконсервированных
черенков корни появляются одновременно как у обработанных, так и у контрольных,
но все же стимулятор роста способствует образованию более мощной корневой
системы. Полученные данные согласуются с результатами проведенного сравнения
влияния Корневина и Эпин-Экстра на укореняемость [6, 7] одревесневших черенков
красной смородины и винограда, которая повышалась на 13-17% по сравнению с
водой. Установлено, что применение стимулятора роста Корневин не только
усиливает образование корней и формирование корневой системы в целом, но и
вызывает усиленный рост побегов одревесневших черенков черной смородины.
Для
составления и последующего выдерживания регламента технологии
криоконсервирования черенков предложено использовать обобщенные показатели
эффективности криоконсервирования черенков сорта у которых Wz. Для этого берут за основу максимальную величину эффективности (3)
относительно которой выражают все остальные сорта:
![]()
Таким
образом, воспроизводимость результатов
криоконсервирования черенков плодово-ягодных культур значимо зависит от их
сорта, способов криоконсервирования и культивирования. На основе проведенных
исследований предложена математическая модель (выражения 2 и 3) оценки
эффективности отдельных этапов криоконсервирования черенков различных сортов.
Представленная модель дает возможность составления регламента осуществления
контроля и оптимизации процесса криоконсервирования черенков разных пород и
сортов плодово-ягодных культур.
Авторы выражают благодарность сотрудникам лаборатории
сохранения НЦГРРУ Института растениеводства им. В.Я. Юрьева за помощь в
проведении данной работы.
ВЫВОДы
1 Представлена математическая модель
оценки эффективности отдельных этапов криоконсервирования черенков различных
пород и сортов, которая дает возможность составления регламента осуществления
контроля и оптимизации биотехнологического процесса.
2 Различные породы и сорта черенков
плодово-ягодных культур имеют одинаковые величины эффективности этапов сушки и
температурной адаптации, культивирования в условиях in vitro, но
значимо разные показатели, определяющие
режим охлаждения черенков.
3 Разброс значений
жизнеспособности деконсервированных черенков черной смородины Дачница, при развитии в условиях in vivo, составил от 16,7 до 40%, эффективностей
криоконсервирования 83,0 - 88,9 %, культивирования в грунте 19-20 % с гормоном роста 37,5-40%.
Литература
1. Вержук В.Г., Филиппенко
Г. И., Тихонова Н.Г., Жестков А.С. Способы криосохранения
генплазмы плодовых культур на примере смородины, жимолости и крыжовника // Биофизика живой клетки. – 2008. – т. 9. – с. 35 – 36.
2. Горбунов Л.В. Шиянова
Т.П. Криоконсервирование черенков плодово-ягодных культур // Пробл.
криобиологии. – 2009. – Т 18, №3. – С. 147–154.
3. Popov A.S., Popova E.V., Nikishina T.V.,
Vysotskaya O.N. Cryobank of plant genetic resources in Russian Academy of
Sciences // International Journal of Refrigeration. – 2006. – Vol. 29. – P.
403-410.
4 Васюта В.М., Рыбак Г.М., Клименко С.В. Справочник садовода. – Киев Наукова думка 1990 – с40-42
5. Турецкая Р.Х.
Вегетативное размножение растений с применением стимуляторов роста / Р.Х.
Турецкая, Ф.Я. Поликарпова. М., 1968.
6. Гурьянова Ю.В. Укоренение
одревесневших черенков винограда некоторых сортов с применением стимуляторов
корнеобразования // Вестник МичГАУ. – 2007. - №1. - С.27-32.
7. Хроменко В.В., Картушин
А.Н. Эффективность регуляторов роста при размножении древесных
плодовых и ягодных культур // Научно-практический журнал АгроXXI.- 2007. - № 7–9. – С. 26-27.
8 Горбунов Л.В. Воспроизводимость
результатов криоконсервирования черенков различных сортов семечковых плодовых
деревьев // Проблемы криобиологии. – 2009.-№4. – С.473-480.
9 Горбунов Л.В. Повышение результатов
воспроизводимости результатов исследования криоконсервирования биообъекта //
Проблемы криобиологии. – 2010.-№3. – С.246-254.
10. Лакин Б. Ф. Биометрия. – М.: Высш. шк., 1990. – 254 с.