Соколова Л.А.1, Сейлханов Т.М.1,
Поплавский Н.Н.1,
Искакова Т.К.2,Пралиев К.Д.2,
Сейлханов О.Т.1
1Кокшетауский государственный университет им. Ш.Уалиханова,
г.Кокшетау
2Институт химических наук им. А.Б.Бектурова, г. Алматы
Интерпретация 1Н ЯМРспектров
1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)-пиперидин-4-ола и его комплекса с β-циклодекстрином
Интерпретированы 1Н ЯМР спектры
производного пиперидина – 1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола и
его комплекса с β-циклодекстрином.
Введение
На сегодняшний день особый интерес в области
химии гетероциклических соединений уделяется насыщенным
шестичленным моно- и бициклическим азотистым гетероциклам, что объясняется
наличием широкого спектра биологического действия у данного класса
соединений[1]. Высокая фармакологическая активность азациклов, в частности
производных пиперидина, вызвала огромных поток исследований по синтезу и
изучению физико-химических свойств, а также оценке их биологического действия
[2-5].
В разработке новых лекарственных веществ также
велика роль супрамолекулярной химии, предметом исследования которой являются кавитанды (cavitand) –молекулы в форме контейнеров определенной формы,
способные вступать во взаимодействия
«гость-хозяин» с молекулами (частицами) комплементарной формы и размера за счет
имеющейся внутри молекулы «хозяина» структурированной пустоты [6]. Наиболее
перспективным является использование в качестве кавитандов циклодекстринов,
обладающих такими преимуществами как относительно легкая биоразлагаемость,
нетоксичность и дешевизна[7-10].
Целью настоящей работы является интерпретация 1Н
ЯМР спектров 1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола (БАС) и его комплекса с β-циклодекстрином (ЦД) для
последующего установления структуры полученного комплекса.
Экспериментальная
часть
Объектом исследования является
1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ол и его комплекс включения с β-циклодекстрином, синтезированные в
лаборатории химии синтетических и природных лекарственных веществ АО «Институт
химических наук им. А.Б. Бектурова».
Спектры ЯМР 1H
и 13C регистрировали на спектрометре «Jeol» JNM-ECA-400
(400 и 100,8 МГц, соответственно), внутренний стандарт Me4Si,
растворители: CDCl3 и DMSO-d6.
Результаты
и обсуждения
На сегодняшний день 1Н ЯМР-спектроскопия является одним из
высокоэффективных методов экспресс-анализа и может предоставить более полную
информацию о строении исследуемых веществ, что, в свою очередь, является
неотъемлемой частью изучения внутри- и межмолекулярных
взаимодействий
и установления взаимосвязи между пространственным строением и
фармакологическими свойствами. В связи с этим данный метод был выбран для
интерпретация структуры 1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола и
его комплекса включения.
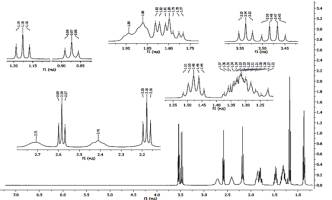
Рисунок
1. 1Н ЯМР спектр 1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола
в CDCl3
В спектре 4-гептинилпиперидола в CDCl3 (рисунок 1) в сильном поле
проявляются интенсивные триплетные сигналы с химическим сдвигами 0,87 и 1,18
м.д., отвечающие протонам метильных групп гексинильного и этоксиэтильного
заместителей. В диапазоне 1,2-1,38 м.д. наблюдаются сигналы протонов
метиленовых групп при С17 и С18. Протоны при С16
резонируют в области 1,48 м.д. в виде четкого квинтета. В более слабом поле
проявляются триплетные сигналы протонов при С15 с химическим сдвигом
2,18 м.д. Сигналы метиленовых протонов этоксиэтильного заместителя при С7,
непосредственно связанном с атомом азота проявляются в виде триплета при 2,58
м.д., а квартет и триплет с химическими сдвигами 3,48 и 3,54 м.д. принадлежат
10-Н и 8-Н, соответственно.
Из-за быстрой инверсии пиперидинового цикла в
режиме записи спектра попарно эквивалентные аксиальные и экваториальные протоны
3,5-Н при 1,82 и 1,89 м.д.и 2,6-Н в области 2,41 и 2,71 м.д. имеют вид
уширенных мультиплетов, причем аксиальные протоны проявляются в более сильном
поле по сравнению с экваториальными протонами.
Использование в качестве растворителя
диметилсульфоксида несколько меняет общую картину (рисунок 2). Из сравнения
двух спектров можно сделать заключение, что наиболее сильное экранирование
испытывают протоны заместителей при атоме азота.
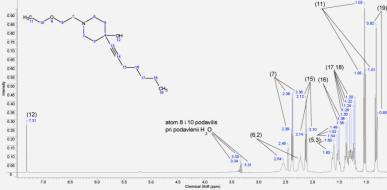
Рисунок
2. 1Н ЯМР спектр 1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола
в DMSO-d6
Протоны этоксиэтильного заместителя в ДМСО также
резонируют в более слабом поле по сравнению со спектром
1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола в дейтерохлороформе, причем
протонам метиленовой группы, непосредственно связанной с гетероатомом
шестичленного цикла, отвечает сигнал при 2,38 м.д. Необходимо отметить, что
сигналы протонов при углеродах С8 и С10 с химическими сдвигами
3,31 и 3,34 м.д. имеют небольшую интенсивность, а синглет с химическим сдвигом
7,31 м.д. отвечает протону гидроксильной группы.
Для установления строения комплекса
1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола были исследованы спектры
циклического олигосахарида β-циклодекстрина, в составе которого фрагменты
D-глюкопиранозы соединены α-1-4-гликозидными связями.
Ниже
представлены протонные спектры β-циклодекстрина (А),
1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола (Б) и его комплекса включения(В)
(рисунок 3).
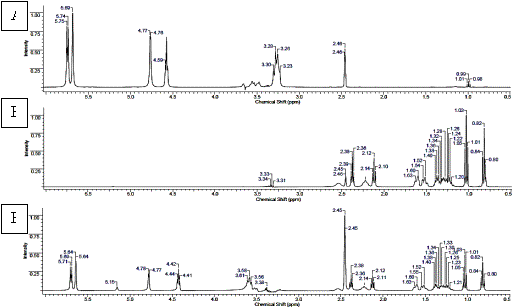
Рисунок 3. 1Н ЯМР спектры А)
β-циклодекстрина; Б) 1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола;
В) комплекса
1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-олас β-циклодекстрином.
Протонный спектр β-циклодекстрина
представляет собой сигналы 6 групп протонов в области 5,75; 5,69; 4,77; 4,57;
3,28 и 2,46 м.д. (рисунок 3А).
В таблицах 1 и 2 представлены значения
химических сдвигов протонов β-циклодекстрина,
1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола и его комплекса включения с
β-циклодекстрином.
Таблица
1. Значения химических сдвигов в 1Н ЯМРспектрах
β-циклодекстринаи его комплекса
с1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-олом в ДМСО
|
Соединение |
Химические сдвиги протонов, м.д. |
|||||
|
С1 |
С2, 6 |
С3 |
С4 |
С5 |
С6 |
|
|
ЦД |
5,74 |
2,46 |
4,77 |
4,59 |
3,28 |
5,69 |
|
Комплекс |
5,71 |
2,45 |
4,78 |
4,44 |
3,58 |
5,64 |
|
Dd |
–0,03 |
–0,01 |
+0,01 |
–0,15 |
+0,30 |
–0,05 |
Из таблицы 1 видно, что наибольшее
дезэкранирование испытывают протоны при С5 молекулы
β-циклодекстрина. Это указывает на некое взаимодействие, возникающее между
молекулами β-циклодекстрина и
1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола.
Для
более детального исследования возможности образования комплекса сравним спектры
1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола и его комплекса (таблица1,
рисунок 3Б, В).
Таблица
2. Значения химических сдвигов в 1Н ЯМР-спектрах
1-(2-этоксиэтил)-4-гепт-1-ин-1-илпиперидин-4-ола и его комплекса с
β-циклодекстрином в ДМСО
|
Соеди-нение |
Химические сдвиги протонов, м.д. |
|||||||||||
|
Н2,6 |
Н3,5 |
Н7 |
Н8 |
Н10 |
Н11 |
Н12 |
Н15 |
Н16 |
Н17 |
Н18 |
Н19 |
|
|
БАС |
2,45 |
1,63 |
2,38 |
3,33 |
3,33 |
1,03 |
7,31 |
2,12 |
1,38 |
1,28 |
1,22 |
0,82 |
|
Комп-лекс |
2,45 |
1,63 |
2,38 |
3,58 |
3,58 |
1,03 |
5,15 |
2,12 |
1,38 |
1,28 |
1,23 |
0,82 |
|
Dd |
0 |
0 |
0 |
+0,25 |
+0,25 |
0 |
–2,16 |
0 |
0 |
0 |
+0,01 |
0 |
Так, на основании разности величин химических
сдвигов сигналов протонов в спектре ЯМР 1Н можно сказать, что
наиболее дезэкранированными оказываются протоны, находящиеся в непосредственной
близости с атомом кислорода N-этоксиэтильного
заместителя, что, по-видимому, связано с их специфическим W-расположением.
Таким образом, на основании проведенной
интерпретации протонных спектров можно сделать следующие выводы:
Ø
разница
в химических сдвигах 1Н глюкопиранозных звеньев в спектре комплекса β-циклодекстрин
–1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола по сравнению со спектром
β-циклодекстрина подтверждает взаимодействие данных
соединений и образование комплекса включения;
Ø
сдвиг сигналов ядер С(3)–H и С(5)–H,
расположенных во внутренней полости β-циклодекстрина, в сторону слабого поля (+Δδ) указывает на вхождение 1-(2-этоксиэтил)-4-гепт-1-ин-1-илпиперидин-4-ола
вполость β-циклодекстрина;
Ø
незначительная
разница в химических сдвигах протонов при атомах углерода С2 и С4
молекулы β-циклодекстрина
доказывает вхождение 1-(2-этоксиэтил)-4-(гепт-1-ин-1-ил)пиперидин-4-ола в полость β-циклодекстрина через более широкий
край молекулы;
Ø
на
образование комплекса указывают сдвиги сигналов при атомах углерода N-этоксиэтильного
заместителя, находящихся в непосредственной близости от атома кислорода.
Литература.
1
Беликов
В.Г. Фармацевтическая химия. - М.: Медпресс-информ, 2007.- 624 c.
2
Casy A.F., Chatten L.G., Khular K.K. Synthesis and stereochemistry of
3-methyl analogues of pethidine // J. Organ. Chem. – 1969. - №18. - P. 2491-2495.
3
Ackerman W.E., Juneja M.M., Coiciough C.W., Guilter J.M. A comparison of
epidural fentanyl, buprenorphin and butorfanol for the menegment of post
cesarian section pain // Anesth. Rev. - 1989.
- Vol. 16, №3.- P. 37-40.
4
Пралиев К.Д. С- и N-замещенные моно- и бициклические пиперидины: синтез,
стереохимия, превращения и свойства. Новые синтетические анальгетики и
анестетики // Материалы 1-й межд. конф. «Химия и биологическая активность
азотистых гетероциклов и алкалоидов». - Москва, 2001. – Т. 1, - С. 130-138.
5
Патент 126908.
РФ. Гидрохлорид 1-(2-этоксиэтил)-4-фенил-4-пропионилоксипиперидина, обладающий
анальгетической активностью / Пралиев К.Д., Ю В.К., Соколов Д.В., Босяков Ю.Г.,
Куриленко В.М., Хлиенко Ж.Н., Моисеева Л.М. Четвериков В.П., Тетеньчук Э.В.,
Нурахов С.Н.; oпубл. 29.07.94.
6
Martin E.M. Del Valle. Cyclodextrins
and their uses: a review // Process biochemistry. - Vol. 39, №. 9. - 2004. - P.
1033-1046.
7
Демина
Н.Б., Астахова А.В. Современные технологии лекарственных форм: получение, исследование
и применение комплексов включения лекарственных веществ с циклодекстринами
(обзор) // Хим.-фарм. журн. - 2004. - № 2. - С. 46-49.
8
Баталова
Т.А., Доровских В.А., Сергиевич А.А., Пластинин М.Л., Грачев М.К., Курочкина
Г.И., Лысенко С.А. Противовоспалительная активность нового синтетического
соединения из бета-циклодекстрина и ацетилсалициловой кислоты //
Дальневосточный медицин.журн. – 2009 .- № 4. - С. 104-106.
9
Предпат. №18703. РК. Комплекс включения
гидрохлорида 1-(2-этоксиэтил)-4-фенил-4-пропионилоксипиперидина с β-циклодекстрином /Кемельбеков У.С., Пралиев К.Д., Бекетов К.М., Ю В.К.,
Лукьянова М.С., Колтунова А.А., Воронина Е.И.; опубл. 15.08.2007, Бюл. №8. –5
с.
10 Кемельбеков
У.С., Бекетов К.М., Фасхутдинов М.Ф., Пралиев К.Д.
Изучение комплексообразованияпросидола с β-циклодекстрином//
Хим. журн. Казахстана. – 2007 . - №3 . - С. 103-109.