ЗАКОНОМЕРНОСТИ
СОРБЦИИ ЙОДИД-ИОНОВ
ИЗ РАСТВОРОВ
НА АКТИВНЫХ УГЛЯХ
Безрукова
С.А., Буйновский А.С., Селявская Е.В.
Северский технологический институт НИЯУ
МИФИ,
636036, г. Северск, Томской обл.,
пр.Коммунистический, 65
e-mail: zvetoc@mail.ru
Закономерности сорбции йода из растворов
исследовались во многих работах не только в связи с теоретическим значением
этого вопроса, но также и потому, что промышленное получение йода в основном
осуществляется сорбцией из технологических растворов активными углями (АУ).
Между тем сложность исследования явлений сорбции йода в чистом виде из-за
легкости взаимных превращений его анионных и молекулярных форм не позволяют во
многих случаях однозначно судить о закономерностях сорбционного процесса и о
влиянии на него тех или иных факторов [1-4].
В настоящей работе изучено влияние среды
раствора, времени контакта АУ с раствором, массы навески сорбента и окислителя
(H2O2) на закономерности сорбции йодид-ионов из водных
растворов.
Методика эксперимента
заключалась в растворении навески сорбента в анализируемом растворе,
непосредственно сорбции, фильтрации и анализе фильтрата на содержание йодид-ионов
методом двойных стандартных добавок. Сорбцию проводили в статических условиях.
В качестве анализируемого раствора использовали стандартные растворы
йодид-ионов концентрации 40-200 мкг/дм3, в качестве сорбента был
использован АУ марки БАУ, отличающийся высокой сорбционной способностью и
сильно развитой общей пористостью. Характеристика
параметров пористой структуры АУ различных марок представлена в табл. 1.
Для поддержания необходимого значения рН
вносили добавку 1 М H2SO4 или
10%-ного раствора NaOH.
Таблица 1 - Характеристика
параметров пористой структуры АУ
|
Марка угля |
Объем пор, см3/г |
Насыпная плотность, г/см3 |
||
|
Суммарный |
Микропор |
Мезопор |
||
|
КАД-иодный |
0,6-0,7 |
0,26-0,29 |
0,04-0,06 |
0,38 |
|
АГ-3 |
0,8-1 |
0,24-0,28 |
- |
0,45-0,48 |
|
АР-3 |
0,7 |
0,33 |
0,07 |
- |
|
БАУ |
1,65-1,8 |
0,22-0,25 |
0,08-0,1 |
0,22-0,24 |
Отмечено, что наиболее существенное
влияние на полноту сорбции оказывает кислотность раствора. Результаты
определения йодид-ионов в нейтральной, щелочной и кислой средах до и после
обработки АУ представлены в табл. 2-4.
Таблица
2 - Результаты определения йодид-ионов в нейтральной среде
|
Концентрация йодид-ионов,
мкг/ дм3 |
Sr |
Погрешность, % отн |
|
|
Введено |
Найдено |
||
|
Раствор
до обработки АУ |
|||
|
40,0 |
39,4 |
0,07 |
1,5 |
|
50,0 |
50,7 |
0,06 |
1,5 |
|
70,0 |
70,5 |
0,03 |
0,7 |
|
100,0 |
100,8 |
0,03 |
1,5 |
|
Раствор
после обработки АУ |
|||
|
40,0 |
46,8 |
0,11 |
17,0 |
|
50,0 |
52,3 |
0,04 |
4,6 |
|
70,0 |
75,4 |
0,05 |
7,8 |
|
100,0 |
104,5 |
0,04 |
4,5 |
Из данных,
представленных в табл. 2 видно, что содержание йодид-ионов в растворе до и
после обработки активированным углем в нейтральной среде не изменяется и находится
в пределах погрешности.
Результаты определения
йодид-ионов в щелочной среде (табл. 3) до и после обработки активированным
углем также, как и в нейтральной, находятся в пределах погрешности.
Таблица
3- Результаты определения йодид-ионов в щелочной среде
|
Концентрация
йодид-ионов, мкг/ дм3 |
Sr |
Погрешность, % отн |
|
|
Введено |
Найдено |
||
|
Раствор до обработки АУ |
|||
|
50,0 |
49,8 |
9,78 |
0,4 |
|
70,0 |
71,3 |
9,30 |
1,8 |
|
100,0 |
100,8 |
9,87 |
0,8 |
|
Раствор
после обработки АУ |
|||
|
50,0 |
54,2 |
8,93 |
8,4 |
|
70,0 |
76,9 |
8,46 |
9,9 |
|
100,0 |
109,5 |
8,93 |
9,5 |
Однако
отмечено, что потенциал ИСЭ в растворе до обработки АУ имеет положительные
значения, а после смещается в область отрицательных значений. При введении добавки
стандартного раствора не происходит резкого изменения потенциала индикаторного
электрода (необходимое при определении концентрации методом двойных стандартных
добавок), что снижает чувствительность и точность определения йодид-ионов
потенциометрическим методом.
Таблица
4-Результаты определения йодид-ионов в кислой среде
|
Концентрация йодид-ионов,
мкг/ дм3 |
Sr |
Погрешность, % отн |
|
|
Введено |
Найдено |
||
|
Раствор до обработки АУ |
|||
|
70,0 |
67,5 |
1,50 |
3,5 |
|
100,0 |
93,5 |
1,06 |
6,5 |
|
150,0 |
153,6 |
1,79 |
2,4 |
|
200,0 |
204,2 |
1,44 |
2,1 |
|
Раствор после обработки
АУ |
|||
|
70,0 |
16,2 |
1,73 |
- |
|
100,0 |
25,2 |
1,11 |
- |
|
150,0 |
74,9 |
1,82 |
- |
|
200,0 |
99,7 |
1,50 |
- |
Результаты определения
йодид-ионов в кислой среде (табл. 4) показали, что в диапазоне концентраций от
50-100 мкг/ дм3 содержание йодид-ионов после обработки раствора АУ
уменьшается в среднем на 80%, а в диапазоне от 150 до 200 мкг/ дм3
на 50%. На основании этого можно предположить вероятную сорбцию йодид-ионов в
кислой среде.
В
кислой среде АУ является сильным восстановителем, вследствие чего одновременно
с поглощением молекулярного йода может идти его восстановление до йодид-иона,
который не удерживается сорбентом (рНопт = 2).
Для объяснения
механизма адсорбции на углях предложено несколько теорий, предполагающих
действие ван-дер-ваальсовых сил (физическая адсорбция), образование химических
комплексов, электрохимическое взаимодействие.
Из-за наличия поверхностных групп
становится возможной химическая сорбция на поверхности углей по механизму
ионного обмена, что в случае йодид-ионов можно представить в виде следующей
схемы:
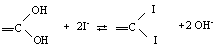
Авторами [1]
установлено, что при низких значениях рН на поверхности АУ за счет адсорбции
кислорода образуется пероксид водорода, который переводит йодид-ионы в
молекулярное состояние, вследствие чего происходит сорбция по донорно-акцепторному
механизму.
В работе
[4] сорбция йода из водных растворов объясняется образованием комплексов с
переносом заряда в системах йод-растворитель-углеродный сорбент. Действительно,
хорошо известна способность молекулярного йода образовывать комплексы с переносом
заряда с различными органическими соединениями [5], причем в этих комплексах он
выступает в качестве эффективного акцептора электронов. Можно поэтому думать,
что главная причина высокого сродства молекулярного йода к поверхности угля по
сравнению с анионами I- при его сорбции из водных и некоторых органических
растворов состоит в образовании достаточно прочного поверхностного комплекса с
переносом заряда.
В качестве
донора электронов в таких комплексах, очевидно, будет выступать p-сопряженная система полиядерных ароматических
соединений в графитоподобных микрокристаллитах скелета угля.
При исследовании влияния количества
сорбента на полноту сорбции йода были использованы массы навески АУ 2, 4 и 6
граммов. Зависимость изменения концентрации йодид-ионов от времени при
различной массе сорбента представлена на рис. 1.
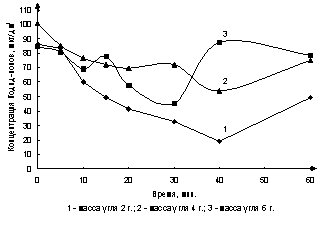
Рис. 1. Зависимость изменения концентрации йодид-ионов
при различной массе сорбента
Из графиков видно, что с увеличением массы
АУ, сорбция йодид-ионов ухудшается. Показано, что при использовании навески
массой 2 г максимально можно сорбировать 80% йодид-ионов при t= 40 мин. Увеличение массы сорбента (mАУ= 6 г, t ≈ 30 мин) приводит к уменьшению сорбции до 50%,
а при более длительной обработке раствора (t
> 40 мин) йодид-ионы возможно сорбировать лишь на 10%.
С целью повышения степени сорбции
йодид-ионов нами проведены исследования по влиянию окислителя на данный процесс
в кислой среде.
При сорбции йода широкое применение нашли
такие окислители, как нитрит натрия и пероксид водорода
[1]. Реакция окисления нитритом натрия протекает по уравнению
2 HNO2 + 2I- + 2H+ = I2 + 2
H2O + 2NO.
При рН » 2 окислителем является не ион нитрита, а свободная
азотистая кислота, в нейтральной и щелочной среде реакция не идет.
Как показано в работе [6] в присутствии
сильных кислот реакция между нитритом и йодидом протекает мгновенно, а в
буферных растворах при рН
= 4,5 скорость реакции пропорциональна концентрации нитрита и йодида. При
увеличении их концентрации реакция каталитически ускоряется. При избытке
нитрита степень окисления не увеличивается, а с повышением температуры скорость
окисления йодида нитритом снижается.
Окисление йодид-ионов пероксидом водорода
протекает в соответствии со следующей реакцией [1]
H2O2 + 2I- + 2H+ = I2 + 2H2O.
Исследования сорбции йодид-ионов на АУ в
кислой среде в присутствии Н2О2 проводили по следующей методике: готовили стандартный раствор
йодид-ионов концентрации 100 мкг/дм3, вносили добавку 1 М H2SO4 до рН = 1-2. Затем проводили сорбцию 3-х параллельных
проб с добавлением в каждую пробу по 1 мл Н2О2.
Так при низкой концентрации серной кислоты
в отсутствии окислителя сорбция йода максимально составила 50% при времени
контакта 30 мин. С течением времени отмечалось смещение рН раствора в более
нейтральную область, при котором сорбции йодид-ионов не наблюдалось.
Также отмечено влияние окислителя на
полноту сорбции йода: в случае неполного окисления йодид-ионов до элементного
йода полнота сорбции уменьшается. В отсутствии солей окисление йодида протекает
нацело при рН = 1-2. С увеличением рН максимальная степень окисления йодида падает.
На рис.2 представлена зависимость
количества сорбированных йодид-ионов от времени в отсутствии и присутствии
окислителя.
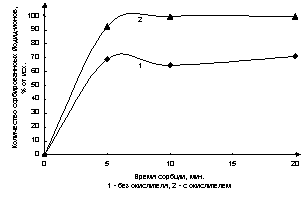
Рис. 2. Количество сорбированных йодид-ионов в % от
времени
Доказано, что в присутствии окислителя
сорбция йодид-ионов увеличивается в среднем на 20%. При этом время сорбции
сокращается до 10 мин.
Заключение
Исследовано влияние
среды раствора, времени контакта АУ с раствором, массы навески АУ и окислителя
на закономерности сорбции йодид-ионов из водных растворов. Определены
оптимальные условия проведения процесса: t = 10 мин, рН = 2, добавка H2O2.
СПИСОК
ЛИТЕРАТУРЫ
1 Ксензенко В.И.,
Стасиневич Д.С. Химия и
технология брома, йода и их соединений. Учебное пособие для вузов. М.: Химия,
1995. 432 с.
2 Русьянова Н.Д.
Углехимия. М.: Наука, 2003. 316 с.
3 Сальникова Е.В.,
Мурсалимова М.Л., Стряпков А.В.
Методы концентрирования и разделения микроэлементов. Учебное пособие. –
Оренбург.: ГОУ ОГУ, 2005. – 157 с.
4 Свионтковски А.// Адсорбция и адсорбенты. 1980. №8. С. 20.
5 Теренин А.Н. Молекулярные соединения и спектр междумолекулярного
переноса электрона. – Успехи химии, 1995, 24, № 2. С. 121.
6 Позин М.Е. Технология минеральных солей. – М.: Химия,
1974. 792 с.