УДК 622+772 Шумилова Лидия Владимировна
док-р техн.наук, профессор
Забайкальского государственного университета
ДЕСТРУКЦИЯ УПОРНЫХ
МИНЕРАЛОВ ПРИ ВОЗДЕЙСТВИИ ЭНЕРГИИ АКТИВАЦИИ ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИХ РЕАКЦИЙ
ОКИСЛЕНИЯ
Предложена рабочая гипотеза механизма предварительной подготовки
труднообогатимого золотосодержащего сырья к выщелачиванию благородных металлов.
Дано объяснение способа интенсификации процесса окисления упорных материалов и условий
повышения эффективности последующего извлечения золота при сорбционном цианировании,
что достигается окислением сульфидных минералов в две стадии: физико-химическим
(на основе направленных фотоэлектрохимических воздействий) и биоокислением. Обоснована
научная новизна процесса, которая заключается в том, что перед бактериальным
окислением осуществляют предварительную подготовку материала путем обработки
минеральной массы реагентами, содержащими активные формы кислорода, полученными
в результате фотохимического и электрохимического синтеза из первичных газов,
химических соединений и воды.
Упорные минералы, дисперсное
золото, активные формы кислорода, фотоэлектрохимическое воздействие, биоокисление,
энергия активации, деструкция, интенсификация выщелачивания.
Ключевые слова: упорное золоторудное минеральное сырье содержит золото нанодиапазона 10-9…10-7 м.,
которое составляет, как правило, 0,0001 % от общей массы минеральных
комплексов, однако и при таких содержаниях его извлечение представляет
значительный практический интерес.
Одним из главных путей
повышения эффективности процесса выщелачивания золота из труднообогатимого
сырья является интенсификация процесса вскрытия упорной матрицы химическими,
биологическими, физическими методами [3,4,7,8,9]. Для
решения проблемы обеспечения подготовки труднообогатимых руд и техногенного
сырья к выщелачиванию благородных металлов весьма перспективными представляются
методы двухстадиального окисления.
Автором
предложена рабочая гипотеза, заключающаяся в том, что для повышения
эффективности процесса деструкции упорных минералов и увеличения скорости
окисления необходимо кислород заменить на его активные формы: озон, перекись водорода, димеры и тримеры перекиси водорода. [5]. Интенсификация
процесса окисления упорных материалов и повышение эффективности последующего
извлечения золота при сорбционном цианировании достигается окислением в две
стадии: физико-химическим (на основе направленных фотоэлектрохимических воздействий)
и биоокислением микроорганизмами Acidithiobacillus ferrooxidans и Acidithiobacillus thiooxidans. Сущность процесса заключается в
том, что перед бактериальным окислением осуществляют предварительную окисляющую
сульфидные материалы подготовку путем обработки минеральной массы реагентами,
содержащими активные формы кислорода, полученными в результате фотохимического
и электрохимического синтеза из первичных газов, химических соединений и воды.
При рассмотрении
кинетики химических реакций следует отметить, что для совершения элементарного
акта химического процесса молекулы должны обладать запасом энергии, достаточным
для преодоления активационного барьера, разделяющего реагенты и продукты.
Следовательно, чтобы при определённых условиях увеличить число превращающихся
молекул, нужно передать исходным молекулам некоторое дополнительное количество
энергии, то есть активировать их.
Передача энергии может
быть осуществлена с помощью облучения реагентов под действием света
(фотохимические реакции – фотосинтез). Ещё в 1817 г. Ф. И. Гротгус заметил, что
на химическую реакцию оказывает влияние свет, причём вызывает реакцию только то
излучение, которое поглощается данной средой. Излучением фотохимических реакций
занимался К. А. Тимирязев. Он пришёл к выводу, что содержание образующегося при
фотохимической реакции продуктов пропорционально количеству поглощённой энергии
[2].
Фотосинтез состоит из
двух основных стадий. Первая из них, называемая световой стадией, связана с
поглощением фотонов. Этот процесс осуществляется с огромной скоростью,
возможно, за время 10 -12-10-8 с. Большей частью активация
молекул осуществляется рядом химических превращений передачи энергии в форме
теплоты, которые в совокупности образуют темновую стадию (в отсутствии света) и
лимитируют процесс в целом.
Важным принципом
фотохимии является закон Штарка – Эйнштейна, который говорит, что каждый
поглощённый фотон активирует только одну молекулу. А. Эйнштейн постулировал,
что вся энергия кванта сообщается при поглощении света одному-единственному
электрону, вследствие чего этот электрон поднимается на более высокий энергетический
уровень[2].
Сильные
окислители минеральной матрицы: перекись водорода, озон, атомарный хлор,
хлорсодержащие и другие реагенты, которые можно применять каждый в отдельности.
Озон и перекись водорода более сильные окислители, чем диоксид хлора или свободный
хлор.
Извлечение ультрадисперсного золота требует предварительного
изменения микроструктуры минералов-носителей (в первую очередь повышения пористости
и формирования сети микротрещин) и микроагрегации атомов элементов-примесей.
Перекись водорода является уникальным окислителем, который обладает высокой
окисляющей способностью и католическим действием, активно участвует в процессах
комплексообразования. С течением времени остаточная перекись распадается на
воду и кислород (Н2О2→Н2О+О). Стабильность
и химическая активность перекиси водорода определяется как способом ее
получения, так и концентрацией в растворе определенных ионных комплексов, в том
числе гидроксил-ионов и ионов гидроксония. Для повышения извлечения сложных
форм ультрадисперсного золота наиболее эффективно использование следующих
пероксидных химических реагентов: 1) перекись водорода; 2) приготовленный
активный пероксидно-цианидный раствор (при определенных условиях перекись
водорода не окисляет цианид), что более предпочтительно с экономической точки
зрения по сравнению с п. 1; 3) метастабильные пероксидно-гидроксидные и (или)
пероксидно-гидроксильные комплексы (наряду с
группой сопутствующих активных ион-радикальных соединений водорода с
кислородом), синтезированные на основе направленных фотоэлектрохимических
воздействий.
Первичная
метастабильная перекись водорода наиболее просто может быть образована в водном
растворе путем его электролиза, фотолиза, насыщения озоном. Активная окисляющая
комплексообразующая среда формируется при оптимальном соотношении
метастабильной и условно стабильной форм перекиси и групп гидроксидных,
пероксидных (nН2О2 · mН2О) и гидроксониевых
сопутствующих соединений.
На
основании вышеизложенного сделан вывод о том, что наиболее эффективно, в том
числе с экономической точки зрения, для окисления упорных геоматериалов
применять полиреагентные комплексы, полученные на основе активных форм
кислорода, образованных посредством генерации озона из кислорода воздуха с
последующим продуцированием перекиси водорода под воздействием ультрафиолетового
излучения.
Ультрафиолетовое
излучение (энергия ≈ 10 эВ, длина волны 10…400 нм) при поглощении веществом в области
1000…10000 А° обуславливает изменения в
электронном состоянии молекул (электронные спектры), которые возникают в
результате переходов между электронными уровнями. Энергия переходов составляет
более 4∙105 Дж. При поглощении такой энергии одновременно
происходит изменение в колебательном и вращательном состояниях.
В многоатомной молекуле,
содержащей электроны в различных состояниях (связывающие, не связывающие и
разрыхляющие молекулярные орбиты в зависимости от энергетических уровней
электронов), под действием ультрафиолетового излучения происходят
многочисленные переходы из основного состояния в различные возбужденные
состояния. Когда величина кванта hν (h = const – постоянная Планка, ν – частота)
электромагнитной волны мала, то перевести электрон с основного в возбужденное
состояние за счет перехода электрона с одного на другой колебательный или
вращательный уровень, можно за счёт поглощения кванта. Близкие по энергиям
переходы, соответствующие возбуждению только колебательных и вращательных
уровней, возникают при облучении молекул мощным источником света за счёт фотоэффекта – процесса взаимодействия кванта с атомом
вещества, при котором одному из электронов передается вся энергия кванта При
этом электрон выбивается за пределы атома с кинетической энергией
Te =E ─ Ii , (1)
где E – энергия кванта; Ii – потенциал ионизации i-й оболочки атома.
Вероятность фотоэффекта
характеризуется атомным коэффициентом фотопоглощения τа, который представляет собой относительное
ослабление пучка ультрафиолетовых лучей
сечением 1 см2, приходящееся на один атом вещества.
Для точных расчетов
используют формулы Вальтера [6]:
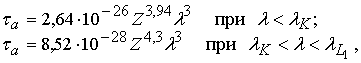 (2)
(2)
где ![]() -
длина волны, соответствующая К- и L-краям поглощения вещества с атомным номером Z; λ – длина волны фотонов.
-
длина волны, соответствующая К- и L-краям поглощения вещества с атомным номером Z; λ – длина волны фотонов.
Энергия
активации гетерогенно-каталитических реакций образуется за счет возникновения
активных центров и зарождения цепи химических процессов, которые являются инициированными в рассматриваемой
термодинамической системе за счет фотоэлектрохимического
воздействия извне. Химические
процессы образования активных полиреагентных комплексов на основе
фотоэлектрохимических воздействий и окисления сульфидных минералов молекулярным
кислородом, его активными формами протекают по цепным реакциям.
Цепные
реакции в рассматриваемой системе включают несколько элементарных стадий
продолжения цепи: физико-химическое окисление на основе фотоэлектрохимических
воздействий, бактериальное окисление, цианидное выщелачивание. Рассмотрим
кинетику разветвленных реакций и упрощенную модель [2] (рисунок 1).
В зависимости от
характеристики активированной молекулы (или активных частиц, на которые она
распадается), квантовый выход может принимать различные значения, например, от
тысячных долей до миллиона. Характеристика же активированных молекул или
активных частиц зависит в основном от времени их жизни, что, в свою очередь,
связано с их стабильностью. Чем дольше существует активированная молекула или
активная частица, образовавшаяся при её диссоциации, тем с большем квантовым
выходом осуществляется фотохимическая реакция.
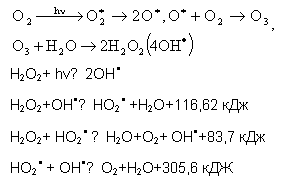

Рисунок 1
Схема механизма разветвленной цепной реакций образования активных
полиреагентных комплексов на основе перекиси водорода
Образовавшаяся в
результате поглощения излучения активированная молекула может вести себя
по-разному, вызывая протекание следующих процессов: простой стехиометрической
реакции с образованием целого числа или доли молей продукта реакции; цепной
реакции, при этом одна активированная молекула распадается на активные частицы,
которые вызывают многократное повторение реакции; потеря энергии активированной
молекулы (например, в процессе люминесценции), при этом активированная молекула
исчезает, не давая жизнь химическому акту; рекомбинация активированной
молекулы, приводящая к гибели активной частицы.
С квантовым выходом
γ=1 протекает большее число реакций. Как правило, это обычные химические
процессы, где молекула реагента получила дополнительную энергию не в виде
теплоты (как в темновых процессах), а в виде излучения.
Например: в реакции образования
пероксида водорода квантовый выход γ=1, в реакции образования озона квантовый
выход γ>1;
Фотохимические реакции с
квантовым выходом γ>>1 обычно протекают по механизму цепных
процессов, где кванты света образуют первичную возбуждённую частицу, которая
далее создаёт цепь (вторичная реакция) так, с квантовым выходом ~ 50
осуществляется фотохимический распад пероксида водорода.
Например, параметры в
реакции образования 2H2O2→2H2O+O2: квантовый выход 20-500.
Согласно
гипотезе в процессе окисления упорных сульфидных минералов для образования
активных центров используются два катализатора: первый - фотоэлектрохимические воздействия (ФЭХВ1), второй
живой возобновляемый - бактерии Acidithiobacillus ferrooxidans и Acidithiobacillus thiooxidans (BIOX2).
Так как окисление сульфидных минералов сопровождается
образованием плотного слоя труднорастворимого продукта реакции, поэтому
лимитирующей стадией процесса является диффузия вещества через этот слой.
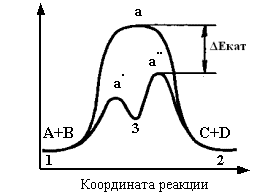
Рисунок 2. Схема хода реакции
в отсутствие и в присутствии катализаторов ФЭХВ1+BIOX2: 1 – исходные компоненты реакции А и В (Fe2+, As3+, S2...); 2 – конечные продукты реакции С и
D (Fe3+, As5+, SO42-…);
3 – промежуточное соединение
катализатора с компонентами реакции; 1а2
– путь реакции окисления сульфидов бактериями A.fer, A.th в классических
условиях BIOX (без
катализатора ФЭХВ1); 1а'3а''2
– путь реакции окисления сульфидов бактериями A.fer, A.th, развивающимися в
благоприятных условиях BIOX
(с катализатором ФЭХВ1)
Повышая
концентрацию кислорода, или его активных форм в пограничном слое Т-Ж фаз,
которые обладают повышенной реакционной способностью, можно увеличить степень
окисления сульфидных минералов и площадь поверхности выщелачиваемого металла и
тем самым создать благоприятные условия (содержание
элементной серы, концентрация Fe2+ и Н+)
для последующего
биоокисления. При этом каталитическое действие реакций с применением
двухстадиального окисления (катализаторы ФЭХВ1+BIOX2) минерального субстрата
достигается изменением (уменьшением) реакционного пути процесса (рисунок2).
![]()
Согласно схеме (рисунок 1), дифференциальные уравнения,
описывающие изменение концентрации ![]() и накопления
и накопления ![]() , запишутся следующим образом:
, запишутся следующим образом:
![]() ;
; ![]() . (3)
. (3)
Следовательно, до тех пор, пока ![]() , концентрация активных центров и скорость реакции нарастают
медленно. Когда
, концентрация активных центров и скорость реакции нарастают
медленно. Когда ![]() , тогда
, тогда ![]() и
и ![]() растут по экспоненциальному закону,
достигая больших значений в процессе глубоких методов окисления упорных
минералов. Поэтому в цепных разветвленных реакциях наступает изотермическое
самовозгорание смеси или взрыв. Период
времени
растут по экспоненциальному закону,
достигая больших значений в процессе глубоких методов окисления упорных
минералов. Поэтому в цепных разветвленных реакциях наступает изотермическое
самовозгорание смеси или взрыв. Период
времени ![]() от начала реакции –
это период индукции. Такой
режим протекания цепной разветвленной реакции соответствует самоускоряющемуся (автоускоряющемуся), а
сам процесс – автоускорением, т.е. после
прекращения генерирования активных центров их концентрация и скорость реакции
растут по экспоненциальному закону. Пусть в момент времени
от начала реакции –
это период индукции. Такой
режим протекания цепной разветвленной реакции соответствует самоускоряющемуся (автоускоряющемуся), а
сам процесс – автоускорением, т.е. после
прекращения генерирования активных центров их концентрация и скорость реакции
растут по экспоненциальному закону. Пусть в момент времени ![]() после начала реакции
после начала реакции ![]() падает до нуля, а
концентрация активных центров достигает значения
падает до нуля, а
концентрация активных центров достигает значения ![]() , тогда после
интегрирования (3) получим:
, тогда после
интегрирования (3) получим:
![]() ;
; ![]() ;
; ![]() . (4)
. (4)
Отсюда следует, что исходное даже весьма незначительное
число активных центров (активных форм кислорода) под действием катализатора
ФЭХВ1 может вызвать лавинообразный рост их числа и скорости самой реакции с
последующим увеличением интенсивности процессов биоокисления и выщелачивания
золота. Рассмотрим случай ![]() , т.е.
, т.е. ![]() . Это означает, что обрыв цепей превалирует над
разветвлением. Соотношения (4) примут вид:
. Это означает, что обрыв цепей превалирует над
разветвлением. Соотношения (4) примут вид:
![]() ;
; ![]() .
(5)
.
(5)
При больших t
концентрация и скорость
реакции стремятся к пределам:
![]() ;
; ![]() . (6)
. (6)
В течение того времени, пока ![]() ,
,![]() ,
,![]() и
и ![]() постоянны,
постоянны, ![]() и
и ![]() не изменяются. Зависимости n и v от времени, отвечающие соотношениям
(5), приведены на рисунке 3 а, б.
не изменяются. Зависимости n и v от времени, отвечающие соотношениям
(5), приведены на рисунке 3 а, б.
б) а)
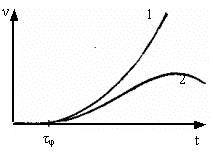

Рисунок 3. Схема цепной разветвлённой реакции:
а) автоускорение:
1– взрыв под воздействием катализатора ФЭХВ1; 2 – взрыва нет;
![]() – период индукции; б) развитие во времени в случае
– период индукции; б) развитие во времени в случае ![]() .
.
Если в момент времени ![]() генерация активных центров
прекратится, то
генерация активных центров
прекратится, то ![]() , получаем:
, получаем:
![]() .
(7)
.
(7)
Отсюда следует, что прекращение генерирования активных
центров (озона из кислорода воздуха) вызывает уменьшение ![]() и
и ![]() , т.е.
процесс затухает. Таким образом, согласно изложенному, в разветвленных цепных
реакциях при
, т.е.
процесс затухает. Таким образом, согласно изложенному, в разветвленных цепных
реакциях при ![]() процесс
квазистационарен, при
процесс
квазистационарен, при ![]() процесс быстрый,
самоускоряющийся, переходящий во взрыв. Критическое условие
процесс быстрый,
самоускоряющийся, переходящий во взрыв. Критическое условие ![]() разделяет области
медленного и быстрого течения реакции.
разделяет области
медленного и быстрого течения реакции.
Энергетические
показатели – важнейшие в характеристике деструкции минералов в их взаимодействии
с микроорганизмами. В осуществлении реакций, являющихся жизнеобеспечивающими,
на определяющее место выходят кинетические параметры, связанные с высокой
скоростью биологических процессов и диффузией, т.е. с переносом реагирующих
веществ. Для повышения уровня кинетики биоокисления требуется значительное снижение
высоты исходного энергетического барьера реакций, преодолеваемого в результате
приложения к реагирующим единицам энергии активации, которое интенсифицирует их
столкновение друг с другом, необходимое для возбуждения процесса
взаимодействия.
Микроэлементы,
полученные под воздействием ФЭХВ1 (О2, H+, Fe2+, S0) снижают
энергию активации и, следовательно, высоту исходного энергетического барьера
реакции, меняя общий характер (дизайн) энергетической траектории процесса. В
биокостных взаимодействиях реакции реализуются в условиях снижения энергий
активации за счет специфической функции каталитических агентов живой материи –
ферментов (энзимов), ускоряющих реакции, но не расходуемых при этом и не
входящих в состав конечных продуктов. На рисунке 4 схематично показана зависимость
энергетического дизайна реакции и высоты ее барьера от участия ферментов –
ферментативная реакция осуществляется в 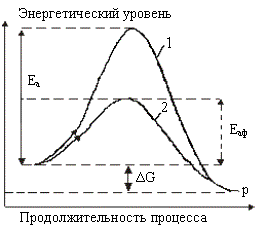 условиях резко сниженного
энергетического барьера.
условиях резко сниженного
энергетического барьера.

Отсюда следует, что активные центры, инициированные в
процессе фотоэлектрохимических воздействий (катализатор ФЭХВ1), способствуют
образованию новых активных центров при последующем биоокислении сульфидных
минералов (катализатор BIOX2).

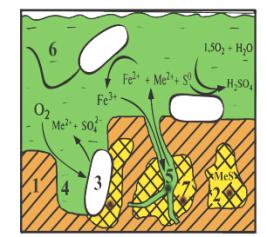 Последующее
эффективное бактериальное окисление сульфидных минералов с нановключениями золота,
инкапсулированного в упорной части матрицы достигается за счет изменения микроструктуры
поверхности минералов-носителей. В результате двухстадиального окисления образуется
сеть микротрещин и формируются макро-, микро- и нанопоры. Нанопустоты в пористых
геоматериалах выполняют роль нанореакторов, что обеспечивает увеличение площади
поверхности минералов и доступ выщелачивающих растворов к ценному компоненту (рисунок 6).
Последующее
эффективное бактериальное окисление сульфидных минералов с нановключениями золота,
инкапсулированного в упорной части матрицы достигается за счет изменения микроструктуры
поверхности минералов-носителей. В результате двухстадиального окисления образуется
сеть микротрещин и формируются макро-, микро- и нанопоры. Нанопустоты в пористых
геоматериалах выполняют роль нанореакторов, что обеспечивает увеличение площади
поверхности минералов и доступ выщелачивающих растворов к ценному компоненту (рисунок 6).
Бактериальные клетки сорбируются и
прочно закрепляются на поверхности сульфидных минералов. Под действием
химических агентов кислорода и трехвалентного железа, а также биологических
агентов ферментативных систем бактерий, элементы кристаллической решетки минерала
– железо и сера – подвергаются окислению, при этом поверхность минерала
разрушается. Образующееся при этом двухвалентное железо входит в состав
активного центра фермента как связующее звено между минералом и ферментом,
находясь с обоими в соединении и удерживая субстрат около активного центра. За
счет создания благоприятных условий катализатором BIOX2 процесс становится автоускоренным.
Последующий распад этого комплекса дает конечный продукт окисления –
трехвалентное железо. Подобному бактериальному окислению подвергается
сульфидная сера, конечным продуктом ферментативного окисления которой является
сульфат-ион.
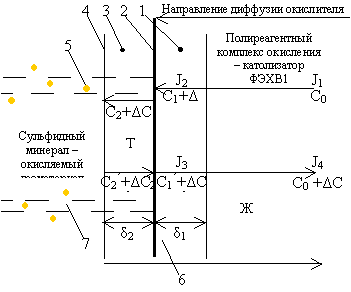
Рисунок 6.
Схема протекания процесса окисления сульфидных минералов: 1 –
внешнедиффузный слой толщиной б1;
2 – граница раздела фаз
жидкое-твёрдое; 3 –
внутридиффузионный слой толщиной б2;
4 – реакционная поверхность; С0,
С1, С2 – концентрация окислителя
соответственно в объёме раствора, на границе раздела фаз, на реакционной
поверхности; С’2,
С’1, С’0 – концентрация
продукта реакции соответственно на реакционной поверхности, на границе
раздела фаз, в объёме раствора; J1, J2, J3, J4 – количество окислителя, переносимого в единицу
времени к единице поверхности; 5 – нановключения золота; 6 – бактерии; 7 – поры
Схема
протекания процесса двухстадиального окисления сульфидных минералов на границе
раздела фаз (Т-Ж) с применением полиреагентного комплекса окислителей и
бактериальных культур представлена на рисунке 6
![]()
![]()
Следовательно, при воздействии катализатора ФЭХВ1 на
раствор реагентов, образуются активные соединения окислителей, которые, благодаря
многообразию форм, повышают вероятность предварительного окисления поверхности
сульфидных минералов, а в процессе последующего биоокисления под воздействием
катализатора BIOX2
осуществляется доокисление сульфидной матрицы.
Таким
образом, скорость возникновения и энергия активации гетерогенно-каталитических
реакций достигается за счет инициирования образования активных центров
(активных форм окислителей) на основе направленных фотоэлектрохимических
воздействий и протекания цепных разветвленных химических реакций окисления
сульфидов в режиме автоускорения и лавинообразного роста (взрыва) их числа, что
способствует интенсификации последующего биоокисления при подготовке к
выщелачиванию упорного сырья.
Библиографический
список
1.
Мухин,
К.Н. Экспериментальная ядерная физика [Текст]/ К.Н.Мухин// В двух томах. Т. I. Физика атомного ядра. Учебник для
вузов. Изд.3-е. - М.: Атомиздат,1974. –587 с.
2.
Никольский
Б.П. Физическая химия. Ответственный редактор академик. – Ленинград:
Издательство Ленинград «Химия» Ленинградское отделение, 1987. – 880 с.
3.
Седельникова,
Г.В. Современные технологии глубокой переработки руд благородных металлов.
Инновационные процессы в технологиях комплексной, экологически безопасной
переработки минерального и нетрадиционного сырья (Плаксинские чтения) //
Материалы Междунар. совещ. – Новосибирск: Ин-т горного дела СО РАН, 2009. – С.
49-50.
4.
Секисов
А.Г. Повышение экологической эффективности разработки рудных месторождений с
учетом взаимосвязи геоэкологических и технологических процессов: автореф. дисс.
… д-ра техн. наук / А.Г. Секисов. – М.: МГГРУ 2004 – 32 с.
5.
Шумилова
Л.В. Комбинированные методы кюветного и кучного выщелачивания упорного
золотосодержащего сырья на основе направленных фотоэлектрохимических
воздействий [Монография] / Л.В. Шумилова, Ю.Н. Резник – Чита: Изд-во ЗабГУ,
2012. – 405 с.
6.
Якубович
А.Л., Зайцев Е.И., Пржиялговский С.М. Ядерно-физические методы анализа
минерального сырья. – М.: Атомиздат. –1982. –264 с.
7.
Australia // Int. Gold Mining Newslett. – 1992.
– 19, № 3. – P. 38-39.
8. Bio-oxidation
– revolutionizing the gold industry // Mining J. – 1995. – 324. – № 8329. – P.
240-241.
9. Biooxidation
of two arsenical refractory gold concentrates and gold cyanidation / Z.
Yongzhu, L. Yiуuan,
Z. Tiancong, Q.Rongqing// Extract. Met. Gold and Base Metals. – Melbourne,
1992. – P. 345-348.

Л. В. Шумилова