Химия и химические технологии / 5. Фундаментальные проблемы создания новых материалов и технологий
*Цыба Ю.В.,
к.х.н. *Бондарев Н.В., к.х.н. **Зайцева И.С.
*Национальный
университет имени В.Н. Каразина, Харьков, Украина
**Харьковская
национальная академия городского хозяйства, Украина
Статистический анализ
экспериментальных данных
и термодинамика диссоциации карбоновых кислот
Результаты экспериментальных исследований
температурной зависимости констант химических равновесий в различных средах
являются основой для расчета термодинамических характеристик; проведения
сопоставительного сольватационно-термодинамического анализа влияния эффектов
среды на силу электролитов, устойчивость и прочность образующихся комплексов,
выход продукта реакции.
Цель
данной работы – на примере (табл. 1) системы бензойная кислота вода – диоксан (0.05 мол. доли DО) [1] изложить
методологические основы статистического анализа экспериментальных данных для
оценки стандартных термодинамических характеристик химических превращений в растворах.
Таблица 1. Значения константы диссоциации бензойной кислоты (рКm, моляльная шкала концентраций) в растворителе вода – диоксан (0.05 мол. доли DО) при разных температурах
|
|
Бензойная кислота – вода – диоксан (0.05
мол. доли DО) |
||||||||
|
Т, К |
283.15 |
288.15 |
293.15 |
298.15 |
303.15 |
308.15 |
313.15 |
318.15 |
323.15 |
|
рКd(m) |
4.908 ± 0.006 |
4.887 ± 0.004 |
4.872 ± 0.005 |
4.858 ± 0.003 |
4.851 ± 0.004 |
4.851 ± 0.007 |
4.850 ± 0.006 |
4.852 ± 0.005 |
4.857 ± 0.004 |
1. Статистический анализ констант диссоциации
бензойной кислоты.
Предположение 1. Константа диссоциации кислоты не зависит от температуры.
Тогда среднеарифметическое нескольких (n)
независимых определений ![]() равно
равно ![]() . Доверительный интервал
D оценивается по уравнению
. Доверительный интервал
D оценивается по уравнению ![]() , где
, где ![]() –
коэффициент Стьюдента при доверительной вероятности р0 = 0.95;
–
коэффициент Стьюдента при доверительной вероятности р0 = 0.95; 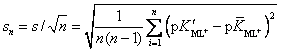 – стандартная ошибка;
– стандартная ошибка;
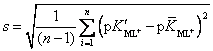 = 0.02025 – среднеквадратичное (стандартное) отклонение. s2 = 4.1·10-4 –
дисперсия.
= 0.02025 – среднеквадратичное (стандартное) отклонение. s2 = 4.1·10-4 –
дисперсия. ![]() = 4.865 ± 2.31·
= 4.865 ± 2.31·![]() = 4.865 ± 2.31·
= 4.865 ± 2.31·![]() =4.865 ± 0.016. Критерий
Стьюдента
=4.865 ± 0.016. Критерий
Стьюдента ![]() =
= ![]() = 2.31.
= 2.31.
Доверительный интервал
константы диссоциации (рКd
= – lg Kd) бензойной
кислоты, вычисленной как среднеарифметическое (![]() ) независимых измерений при разных температурах, в два – три
раза превышает доверительные интервалы для экспериментально найденных констант
диссоциации. Следовательно, предположение об отсутствии температурной
зависимости константы диссоциации бензойной кислоты отвергается.
) независимых измерений при разных температурах, в два – три
раза превышает доверительные интервалы для экспериментально найденных констант
диссоциации. Следовательно, предположение об отсутствии температурной
зависимости константы диссоциации бензойной кислоты отвергается.
Предположение 2.
Константа диссоциации кислоты линейно зависит от температуры ![]() (табл. 2).
(табл. 2).
Таблица 2. Параметры
регрессионного анализа температурной зависимости константы диссоциации бензойной
кислоты в растворителе вода – диоксан
(0.05 мол. доли DО)
|
|
||||
|
|
Estimate |
Standard. |
t(набл)(7) |
p-level |
|
a |
5.2288 |
0.099 |
52.74 |
0.000000 |
|
b |
-0.001200 |
0.000327 |
-3.67 |
0.007935 |
При
этом остатки не подчиняются нормальному распределению и превышают доверительные
интервалы констант диссоциации бензойной кислоты.
Предположение 3. Температурная зависимость термодинамических констант
диссоциации слабых электролитов аппроксимируется уравнением Харнеда-Робинсона ![]() (табл. 3).
(табл. 3).
Таблица 3. Параметры регрессионного анализа температурной зависимости константы диссоциации бензойной кислоты в растворителе вода – диоксан (0.05 мол. доли DО)
|
|
||||
|
|
Estimate |
Standard. |
t(набл)(6) |
p-level |
|
A1 |
2099.752 |
103.6474 |
20.2586 |
0.000001 |
|
A2 |
-8.659 |
0.6856 |
-12.6288 |
0.000015 |
|
A3 |
0.022 |
0.0011 |
19.1846 |
0.000001 |
При этом остатки нормально распределены и не превышают
доверительных границ константы диссоциации бензойной кислоты.
2. Выбор оптимального уравнения температурной зависимости константы
диссоциации кислоты по критерию Фишера.
F - критерий Фишера вычисляется по формуле ![]() , где
, где ![]() – бóльшая дисперсия,
– бóльшая дисперсия, ![]() – меньшая дисперсия. Если вычисленное значение критерия Fнабл =
– меньшая дисперсия. Если вычисленное значение критерия Fнабл =![]() /
/![]() больше критического Fкр(νi, νj, p0)
для определенного уровня значимости (p0
= 0.95) и соответствующих чисел степеней свободы для числителя (νi – число степеней свободы
бóльшей дисперсии) и знаменателя (νj – число степеней свободы меньшей дисперсии), то дисперсии
считаются различными. В противном случае дисперсии считаются однородными и
отдать предпочтение ни одному из методов описания температурной зависимости
нельзя. Это означает, что полученные различия могли иметь случайный характер.
больше критического Fкр(νi, νj, p0)
для определенного уровня значимости (p0
= 0.95) и соответствующих чисел степеней свободы для числителя (νi – число степеней свободы
бóльшей дисперсии) и знаменателя (νj – число степеней свободы меньшей дисперсии), то дисперсии
считаются различными. В противном случае дисперсии считаются однородными и
отдать предпочтение ни одному из методов описания температурной зависимости
нельзя. Это означает, что полученные различия могли иметь случайный характер.
Сопоставление
дисперсий первого и второго предположений дает (ν1 = 9 – 1 = 8;
ν2= 9 – 2 =7). Из таблицы значений критерия Фишера (F – критерия) Fкр(8, 7, 0.95) = 3.73, а ![]() = 4.1·10-4/1.6·10-4
= 2.56.
= 4.1·10-4/1.6·10-4
= 2.56.
Fкр(8,
7, 0.95) > Fнабл(8, 7,
0.95) – дисперсии однородные.
Из
сопоставления дисперсий второго и третьего
предположений следует (ν2 = 9 – 2 =7; ν3 = 9 –
3 = 6): Fкр(7,
6, 0.95) = 4.21, а Fнабл(7,
6, 0.95) = ![]() = 1.6·10‑4/2.7·10-6
= 59.3. Fнабл(7, 6, 0.95)
> Fкр(7, 6, 0.95) –
дисперсии неоднородные, дисперсия в числителе больше, чем дисперсия в
знаменателе.
= 1.6·10‑4/2.7·10-6
= 59.3. Fнабл(7, 6, 0.95)
> Fкр(7, 6, 0.95) –
дисперсии неоднородные, дисперсия в числителе больше, чем дисперсия в
знаменателе.
Таким
образом, из рассмотренных случаев оптимальным является описание температурной
зависимости константы диссоциации слабой кислоты уравнением Харнеда-Робинсона.
3. Оценка значимости
параметров A1, A2, A3 уравнения регрессии Харнеда-Робинсона проведена сопоставлением наблюдаемых
коэффициентов Стьюдента ![]() с критическими (табличными) при данной доверительной вероятности,
как правило 0.95, и (n – k – 1)
степенях свободы. Если | tнабл | > tкр, то коэффициенты A1, A2, A3 значимы.
В рассматриваемом случае нулевая гипотеза H0:
Ai = 0 отвергается
(табл. 3), т.е. коэффициенты Ai значимы – не являются статистическими нулями.
с критическими (табличными) при данной доверительной вероятности,
как правило 0.95, и (n – k – 1)
степенях свободы. Если | tнабл | > tкр, то коэффициенты A1, A2, A3 значимы.
В рассматриваемом случае нулевая гипотеза H0:
Ai = 0 отвергается
(табл. 3), т.е. коэффициенты Ai значимы – не являются статистическими нулями.
4. Стандартные термодинамические характеристики диссоциации бензойной кислоты (кДж×моль-1) рассчитаны по уравнениям:
– энергии Гиббса
![]() = 2.303RT pKd = 19.1471×10-3(A1 + A2T + A3T2)
= 2.303RT pKd = 19.1471×10-3(A1 + A2T + A3T2)
– энтальпии
диссоциации
![]() = RT2(¶ lnKd/¶ T)p =
19.1471×10-3(A1 – A3T2)
= RT2(¶ lnKd/¶ T)p =
19.1471×10-3(A1 – A3T2)
– энтропии диссоциации (Дж×моль-1×K-1)
![]() = – (
= – (![]() /¶ T)p = –19.1471(A2 + 2A3T)
/¶ T)p = –19.1471(A2 + 2A3T)
Температурная зависимость стандартных энергий Гиббса диссоциации
кислот аппроксимирована полином второй степени (табл. 4) в исследуемом
температурном интервале DrGo = A + В(T
-298.15)+ С(T-298.15)2
Таблица 4 Параметры регрессионного анализа температурной
зависимости энергии Гиббса диссоциации бензойной кислоты в растворителе вода – диоксан (0.05 мол. доли DО)
|
n = 9 |
A |
B |
C |
s |
r |
tкр(6) |
DT |
|
|
27.745 |
0.0822 |
0.00041 |
0.01 |
0.999 |
2.446 |
40 |
|
si |
0.005 |
0.0003 |
0.000022 |
||||
|
tнабл(6) |
5995.4 |
248.6 |
18/9 |
Доверительные
границы для термодинамических характеристик равновесий
диссоциации кислоты рассчитаны по соотношениям: DrGo ± 2.303RTdlgK; dlgK = ±0.01 (dDrGo = ± 0.06 кДж/моль);
DrSo = –![]() = –( В + 2С·DT);
= –( В + 2С·DT);
DrSo ± tкр(6)· (sB+2sCDT) = ± 5 Дж/(моль·К); TDrSo ± 1.5 кДж/моль; dDrHo = dDrGo + TdDrSo, DrHo ± 1.6 кДж/моль
Литература:
1. Лебедь В.И., Бондарев Н.В. ЖФХ., 1982, 56, 30-33