Химия и химические технологии / 5.
К.т.н. Родионов И.В.
Саратовский государственный технический
университет
О
механизме и кинетике анодирования титановых
имплантатов
в сернокислых электролитах
Введение
Большинство исследований электрохимического оксидирования
металлов посвящено созданию защитных покрытий на гладких поверхностях, полученных
шлифованием и полированием. Такие металлические поверхности имеют высокую
однородность структуры и химической активности, обеспечивающую одинаковое
протекание окислительных процессов по всей площади обрабатываемой поверхности.
В результате формируется покрытие с повышенными значениями плотности, прочности
и комплекса защитных свойств, обусловливающими его необходимые эксплуатационные
характеристики.
Механизм
образования и роста указанных оксидных покрытий определяется химическим
составом и кристаллическим строением металла, видом применяемого электролита и
технологическим режимом обработки. Такое многообразие внутренних и внешних
факторов, влияющих на процесс создания покрытий, обусловливает существенные
отличия в характере окисления металлов и свойствах получаемых металлооксидов.
Поэтому при исследовании электрохимического формирования защитных оксидных
покрытий на металлах с использованием различных электролитов и значений
заданного режима, устанавливаются соответствующие механизм и кинетика образования
поверхностных оксидов, а также закономерности изменения их функциональных
параметров. Это позволяет определить уровень влияния условий обработки и
электрохимических процессов, протекающих на межфазной границе «металл –
электролит», на создание физико-химических и механических свойств
покрытия.
Кроме защитных покрытий металлов электрохимическая технология позволяет
получать специальные биопокрытия на изделиях имплантационного назначения,
функционирующих в различных тканях и средах организма [1-3]. Так, при получении
биосовместимых морфологически гетерогенных оксидных покрытий на костных
титановых имплантатах необходимо учитывать не только указанные физико-химические и технологические
условия оксидирования, но и состояние поверхности металла перед обработкой,
оказывающее существенное влияние на процессы окисления и функциональные свойства
покрытия. Так, на шероховатой поверхности можно получать прочные покрытия
повышенной толщины с высокими значениями открытой пористости и адгезии, тогда
как на гладкой поверхности толстослойное покрытие легко разрушается и
отслаивается от основного металла. Вместе с тем, исходная пескоструйно обработанная поверхность имплантатов,
обладающая шероховатой структурой и повышенной химической активностью, в
значительной степени определяет процесс образования покрытия и его структурных
характеристик, поскольку они связанны с параметрами микрорельефа окисляемой
поверхности.
Предшествующие исследования анодного оксидирования металлов практически
не содержат сведений о формировании покрытий на шероховатых металлических
поверхностях с множеством локальных пластических микродеформаций. Основное
внимание при этом уделялось оксидированию гладких поверхностей с получением
покрытий, обладающих высокими механическими, диэлектрическими и защитными
свойствами, но возможности создания покрытий с качествами биомеханической
совместимости не рассматривались. Поэтому исследование механизма и кинетики
оксидирования шероховатых титановых имплантатов в широко распространенных
сернокислых электролитах позволит установить электрохимические закономерности и
особенности образования покрытия с биоинтеграционными свойствами, а также
расширить представления о применении технологии анодирования в производстве
высококачественных костных имплантационных систем из титана и его сплавов.
Для выявления параметров процесса сернокислотного анодирования пескоструйно
обработанных, шероховатых титановых имплантатов необходимо определить влияние
режима и условий их обработки на механизм и кинетику формирования структуры и
свойств оксидных покрытий. Ввиду этого в работе исследуются кинетические
зависимости параметров электролиза, а также рассматриваются соответствующие
электрохимические процессы, протекающие на поверхности металла и в электролите.
В проводимом исследовании учитывалось влияние составов
используемых сернокислых электролитов и режимов обработки на изменение показателей
электролиза и физико-химических процессов образования оксидного покрытия.
Анализ механизма и кинетики сернокислотного анодирования титана
 Анодирование
титановых пластинчатых образцов с шероховатой пескоструйно обработанной поверхностью
в электролитах №1 – 200 г/л H2SO4 и №2 – 200 г/л H2SO4 + 50 г/л CuSO4·5Н2О при сравнительно небольших значениях анодной
плотности тока i=5
мА/см2 и продолжительности τ=2-5 мин приводит к тому, что по
мере роста покрытия в толщину, при температуре электролитов 25-550С,
происходит сдвиг потенциала анодирования ∆Е в положительную область
до величин 18-26 В и 17-24 В, соответственно для электролитов №1, №2 (рис. 1).
При дальнейшем увеличении продолжительности обработки потенциалы анодирования
стабилизируются при всех выбранных значениях температуры электролитов.
Анодирование
титановых пластинчатых образцов с шероховатой пескоструйно обработанной поверхностью
в электролитах №1 – 200 г/л H2SO4 и №2 – 200 г/л H2SO4 + 50 г/л CuSO4·5Н2О при сравнительно небольших значениях анодной
плотности тока i=5
мА/см2 и продолжительности τ=2-5 мин приводит к тому, что по
мере роста покрытия в толщину, при температуре электролитов 25-550С,
происходит сдвиг потенциала анодирования ∆Е в положительную область
до величин 18-26 В и 17-24 В, соответственно для электролитов №1, №2 (рис. 1).
При дальнейшем увеличении продолжительности обработки потенциалы анодирования
стабилизируются при всех выбранных значениях температуры электролитов.
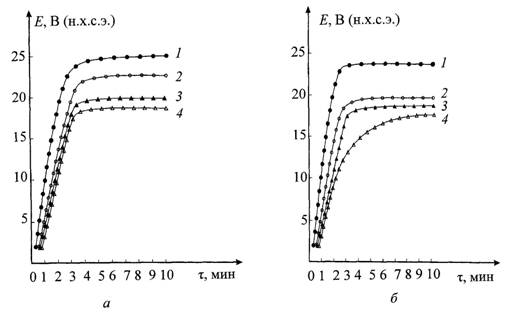
Рис. 1. Температурно-кинетические
зависимости потенциалов анодирования титана при плотности тока 5 мА/см2:
а -200 г/л H2SO4;
б - 200 г/л H2SO4 + 50 г/л CuSO4·5Н2О: 1 - 250С; 2 - 350С;
3 - 450С; 4 - 550С
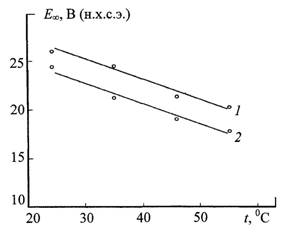
В первом приближении установившиеся потенциалы
анодирования Е∞ линейно уменьшаются при увеличении
температуры электролитов с температурным коэффициентом ∂Е∞/∂Т
= - 0,27 В/К (рис. 2, кривая 1) или ∂Е∞/∂Т
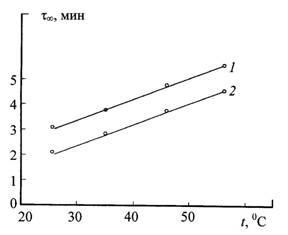
= - 0,23 В/К (рис. 2, кривая 2). Время установления τ∞
этих стационарных потенциалов, напротив, увеличивается с повышением температуры
электролитов и возрастает с примерно одинаковым температурным коэффициентом
∂τ∞/∂Т = 0,07 мин/К (рис. 3).
 Отсюда
следует, что анодирование пескоструйно обработанного титана в обоих сернокислых
электролитах сопровождается существенным сдвигом значений потенциала
анодирования ∆Е в положительную область, а добавка сульфата меди
оказывает заметное влияние на кинетику процесса и характер протекания
электролиза.
Отсюда
следует, что анодирование пескоструйно обработанного титана в обоих сернокислых
электролитах сопровождается существенным сдвигом значений потенциала
анодирования ∆Е в положительную область, а добавка сульфата меди
оказывает заметное влияние на кинетику процесса и характер протекания
электролиза.
|
Рис. 2. Температурная зависимость
установившегося потенциала анодирования титана при плотности тока 5 мА/см2: 1 – электролит 200 г/л H2SO4; 2 – электролит 200 г/л H2SO4 + 50 г/л CuSO4·5Н2О |
Рис. 3. Температурная зависимость
времени установления стационарного потенциала анодирования при плотности тока
5 мА/см2: 1 – электролит 200 г/л H2SO4; 2 – электролит
200 г/л H2SO4 + 50 г/л CuSO4·5Н2О |
Для расчета температурной зависимости скорости формирования j∞ оксидного покрытия в момент стабилизации потенциала анодирования Е∞ можно применить закон Фарадея в виде:
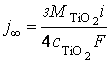 , (1)
, (1)
где η - выход по току, ![]() и
и ![]() - молекулярная масса и плотность диоксида TiO2, F
= 96500 Кл/моль.
- молекулярная масса и плотность диоксида TiO2, F
= 96500 Кл/моль.
Коэффициент z = 4 в знаменателе выражения (1) отвечает реакции анодного
окисления титана:
![]() (2)
(2)
с равновесным потенциалом ![]() = - 1,16 В по н.х.с.э., намного более отрицательным, чем
установившиеся потенциалы анодирования Е∞ = 17-26 В по
н.х.с.э., что указывает на высокую вероятность протекания реакции образования
диоксида TiО2.
= - 1,16 В по н.х.с.э., намного более отрицательным, чем
установившиеся потенциалы анодирования Е∞ = 17-26 В по
н.х.с.э., что указывает на высокую вероятность протекания реакции образования
диоксида TiО2.
При значениях выхода
по току η=1, молекулярной
массе диоксида ![]() = 80 г/моль и его плотности
= 80 г/моль и его плотности ![]() = 4,1 г/см2 расчет по формуле (1) дает результаты,
из которых следует, что переходные скорости формирования покрытия не зависят от
температуры электролита, добавки CuSO4·5Н2О и составляют j∞
= 2,5 нм/с (рис. 4, кривая 1). Полученный результат объясняется температурной
компенсацией переходного количества электричества iτ∞ (рис. 4, кривая 2) и
падением напряженности поля U∞ в оксидном покрытии
(рис. 4, кривая 3).
= 4,1 г/см2 расчет по формуле (1) дает результаты,
из которых следует, что переходные скорости формирования покрытия не зависят от
температуры электролита, добавки CuSO4·5Н2О и составляют j∞
= 2,5 нм/с (рис. 4, кривая 1). Полученный результат объясняется температурной
компенсацией переходного количества электричества iτ∞ (рис. 4, кривая 2) и
падением напряженности поля U∞ в оксидном покрытии
(рис. 4, кривая 3).
Представленные данные позволяют определить окончание продолжительности
анодирования титана, необходимой для получения оксидного покрытия с минимальной
для биоинтеграции величиной толщины, составляющей ![]() = 10-15 мкм. Расчеты показывают, что эта продолжительность составляет
порядка
= 10-15 мкм. Расчеты показывают, что эта продолжительность составляет
порядка ![]() = 67-70 мин при i = 5
мА/см2, η = 1 и практически не зависит от температуры
электролита. Но учитывая, что в реальных условиях электролиза имеет место
анодное растворение титана, протекающее при равновесном потенциале,
равном
= 67-70 мин при i = 5
мА/см2, η = 1 и практически не зависит от температуры
электролита. Но учитывая, что в реальных условиях электролиза имеет место
анодное растворение титана, протекающее при равновесном потенциале,
равном ![]() = - 1,14 В (н.х.с.э) по реакции
= - 1,14 В (н.х.с.э) по реакции
![]() ,
(3)
,
(3)
 то часть количества электричества,
пропускаемого через анод, расходуется на его растворение и значение выхода по
току η при этом заметно уменьшается, за счет чего существенно
возрастает продолжительность анодирования. Таким образом, основное влияние на
рост толщины покрытия оказывает величина анодной плотности тока.
то часть количества электричества,
пропускаемого через анод, расходуется на его растворение и значение выхода по
току η при этом заметно уменьшается, за счет чего существенно
возрастает продолжительность анодирования. Таким образом, основное влияние на
рост толщины покрытия оказывает величина анодной плотности тока.
Рис. 4. Температурные зависимости
переходной скорости роста j∞ покрытия (1), переходного
количества электричества iτ∞
(2) и переходной напряженности электрического поля U∞ (3),
полученные анодированием титана в электролитах №1 (а) и №2 (б)
при i = 5
мА/см2
Для
определения времени окончания анодирования можно использовать
профилометрические данные по относительной шероховатости пескоструйно
обработанных и анодированных поверхностей титана Өпо и Өа. Учитывая,
что конкуренция между реакциями анодного оксидирования и растворения приводит к
известному из практики анодной электрополировки титана эффекту сглаживания
микронеровностей поверхности, то выход по току η можно оценить по
соотношению:
η = Өа / Өпо,
где относительная шероховатость поверхности Ө
рассчитывается по формуле:
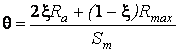 ,
,
где
ξ≤1 –
статистическая доля частиц абразива меньшего радиуса (при пескоструйной
обработке) и Sm – средний шаг местных выступов профиля, мкм.
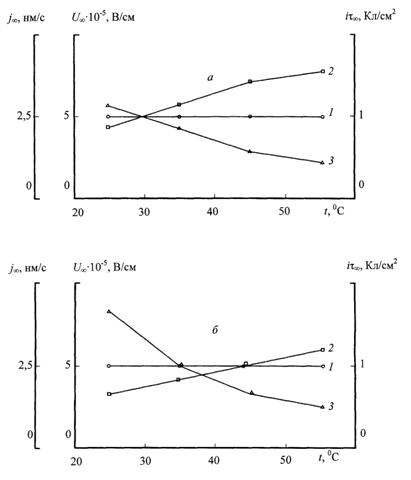
Соответствующее определение значений относительной шероховатости Ө и выхода по току η показало, что реакция анодного растворения титана (3) действительно конкурирует с реакцией анодного оксидирования (2) и потребляет примерно половину количества электричества, пропущенного через анод при среднем значении выхода по току, равном η = 0,47 (табл.). При небольших значениях анодной плотности тока это приводит к более чем двукратному возрастанию времени окончания электролиза до величины порядка 2 ч.
Таблица
Величины
Ө и η по
данным профилометрии
|
Вид обработки
поверхности |
Пескоструйная |
Анодирование в электролите №1 |
Анодирование в электролите №2 |
|
Ө |
0,47 |
0,23 |
0,21 |
|
η |
- |
0,49 |
0,45 |
Действительно, оптико-микроскопическое измерение толщины
покрытий на поперечных микрошлифах анодированных образцов, показало достижение
ее значений до существенных величин, составляющих 20-30 мкм за продолжительность
обработки τ = 4-6 ч в электролите №1 при плотности тока 5-10 мА/см2,
соответственно. Анодирование титана в электролите №2 при тех же значениях
анодной плотности тока, приводило к созданию покрытий указанной толщины за
более короткое время, составляющее 2-3 ч. С возрастанием плотности тока до 50
мА/см2 толщина покрытий достигала 10 мкм при анодировании титана в
электролите №1 и 50 мкм при анодировании в электролите №2 за продолжительность
обработки 0,3 ч. Такая разница в значениях толщины обусловлена активирующим
действием добавки CuSO4 на титановый анод за счет чего интенсифицировался
процесс формирования покрытия и увеличивалась скорость роста его толщины j∞ в электролите №2.
Из
этого можно сделать вывод, что при электрохимическом оксидировании титановых
имплантатов необходимо задавать повышенные значения анодной плотности тока,
позволяющие формировать покрытия с приемлемой для биоинтеграции толщиной в
течение небольшой продолжительности электролиза.
Для
дальнейшего исследования механизма и кинетики сернокислотного анодирования
титана следует рассмотреть вольтамперные характеристики (ВАХ) его анодного поведения в электролитах №1 и №2
при продолжительности обработки τ
= 5 мин, гарантирующей стационарность потенциалов анодирования Е∞
(рис. 5).
|
|
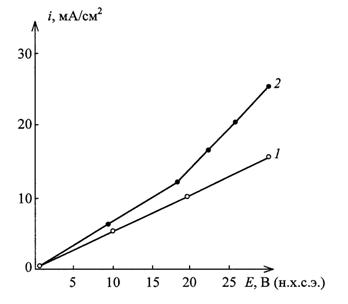
Рис. 5. Вольтамперные характеристики анодного
поведения пескоструйно обработанного титана при t=550С и τ=5 мин: 1 – электролит 200 г/л H2SO4; 2 – электролит 200 г/л H2SO4 + 50 г/л CuSO4·5Н2О |
Представленные
вольтамперные характеристики обусловлены линейностью в интервале анодной
плотности тока i=0-10 мА/см2 и слабо отличаются
друг от друга. Это соответствует и близким значениям удельных электропроводностей
получаемых оксидных покрытий, равным σ1 = 3,7·10-8
Cм/см при анодировании в электролите №1 и σ2
= 4,0·10-8 Cм/см при
анодировании в электролите №2.
Полученные
данные согласуются с моделью омического контроля анодных реакций (2) и (3)
твердофазной миграцией катионов Ti4+ через оксидный слой в условиях относительно малой
напряженности электрического поля в нем, составляющей U∞ = (2,3-8)·105 В/см (рис. 4, кривая 3). Однако, при повышенных
значениях анодной плотности тока, превышающих i≥10 мА/см2, удельная
электропроводность оксидных покрытий, получаемых в электролите №2 (кривая 2),
возрастает примерно в 2,5 раза и достигает величины σ2 = 10-7 Cм/см. Тем самым, добавка катионов Cu2+
активирует титановый анод и оказывает деполяризующее действие.
Наиболее
вероятный механизм такого эффекта реализуется по электрохимической реакции:
![]() , (4)
, (4)
с величиной равновесного потенциала ![]() = 0,48 В по н.х.с.э., которая при потенциале анодирования Е
≥ 18,8 В по н.х.с.э. начинает обеспечивать необратимую химическую реакцию
образования оксида меди:
= 0,48 В по н.х.с.э., которая при потенциале анодирования Е
≥ 18,8 В по н.х.с.э. начинает обеспечивать необратимую химическую реакцию
образования оксида меди:
![]() . (5)
. (5)
Данный оксид обладает достаточно большой дырочной
проводимостью, частично шунтирующей малую дырочную проводимость диоксида TiO2
при включении примесных частиц CuO в фазовый состав оксидного покрытия.
Совокупность
полученных экспериментальных результатов интерпретируется с помощью изложенных
ниже представлений о механизме и кинетике анодного оксидирования титана.
Известно,
что переходные многовалентные металлы, в частности титан, при анодном
растворении не отдают все свои валентные электроны в одном элементарном акте.
Поэтому, для титана можно предложить следующую четырехстадийную схему анодного
растворения:
![]() ,
(6)
,
(6)
![]() , (7)
, (7)
![]() ,
(8)
,
(8)
![]() .
(9)
.
(9)
Такая схема реакций характеризуется отрицательными
(по н.в.э) значениями равновесных электродных потенциалов, равными ![]() = -1,75 В – для реакций (6), (7),
= -1,75 В – для реакций (6), (7), ![]() = -0,37 В – для реакции (8) и
= -0,37 В – для реакции (8) и ![]() = -0,04 В – для реакции (9). Реакции анодного растворения
титана (6)-(9) вероятнее всего протекают с участием компонентов электролита
анодирования. Для сернокислых растворов такими электроактивными компонентами
являются анионы
= -0,04 В – для реакции (9). Реакции анодного растворения
титана (6)-(9) вероятнее всего протекают с участием компонентов электролита
анодирования. Для сернокислых растворов такими электроактивными компонентами
являются анионы ![]() , катионы Н+ (Н3О+) и
молекулы воды. В связи с этим схема реакций растворения титана (6)-(9) может
быть модифицирована с учетом участия в них компонентов сернокислого электролита
анодирования следующим образом:
, катионы Н+ (Н3О+) и
молекулы воды. В связи с этим схема реакций растворения титана (6)-(9) может
быть модифицирована с учетом участия в них компонентов сернокислого электролита
анодирования следующим образом:
![]() , (10)
, (10)
![]() , (11)
, (11)
![]() , (12)
, (12)
![]() .
(13)
.
(13)
Анализ
электрохимических реакций (10)-(13) показывает, что компоненты сернокислого
электролита выступают в качестве катализаторов реакций (6)-(9) и ускоряют их,
не сдвигая электродные равновесия в системе. Поэтому, на основании приведенных
выше значений стандартных электродных потенциалов можно заключить, что наиболее
быстрой реакцией будет являться реакция образования TiОН (10). Поскольку
сернокислые электролиты анодирования имеют большую концентрацию катионов
водорода Н+, то на границе титана с электролитом наиболее высока
активность адсорбированных катионов одновалентного титана Ti+,
образующихся по химической реакции:
![]() .
.
В
параллельном анодном процессе протекает реакция окисления ![]() до пероксидного
аниона:
до пероксидного
аниона:
![]() ,
,
характеризуемая стандартным равновесным электродным
потенциалом, равным ![]() = 0,88 В по н.в.э. Далее образуется анион кислорода
= 0,88 В по н.в.э. Далее образуется анион кислорода ![]() по реакции:
по реакции:
![]() .
.
Основная реакция анодного оксидирования титана реализуется в виде
химического окисления одновалентного катиона титана Ti+
анионом кислорода ![]() :
:
![]() (14)
(14)
Если в
электролите присутствует активирующая добавка CuSO4, то
при анодировании протекает параллельная химическая реакция образования более
электропроводного оксида CuO (5).
По
мере роста титанооксидного покрытия в толщину описанные выше процессы анодного
растворения и оксидирования переходят с поверхности титана в объем покрытия и
начинают контролироваться твердофазной ионной миграцией катионов титана и
анионов кислорода, для выражения которой можно записать соответствующие
уравнения Нернста-Планка:
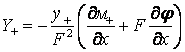 (15)
(15)
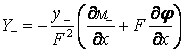 , (16)
, (16)
где х – нормальная координата, отсчитываемая
от поверхности оксидного покрытия, Y+ и Y–, σ+ и σ–, μ+ и μ–
– потоки катионов титана и анионов кислорода, катионные и анионные удельные
электропроводности оксидного покрытия, химические потенциалы катионов титана и
анионов кислорода в соединении TiO2, соответственно, φ – потенциал
внутрипленочного электрического поля и F = 96487 Кл/моль – постоянная Фарадея.
С учетом условия электронейтральности оксидного покрытия в виде равенства:
Y+ – Y– = 0 (17)
из формул (15), (16) можно исключить градиент
внутрипленочного электрического потенциала φ:
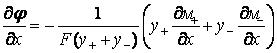 ,
,
получив в результате уравнение для потока миграции
анионов кислорода ![]() :
:
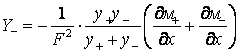 .
.
Если принять, что удельная электропроводность катионов титана в оксидном
покрытии намного больше удельной электропроводности анионов кислорода σ+ >> σ–, то
предыдущее выражение легко упрощается:
![]() . (18)
. (18)
Интегрируя уравнение (18) по х, получаем:
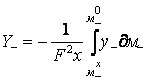 , (19)
, (19)
где ![]() – химический потенциал анионов
– химический потенциал анионов ![]() на поверхности
оксидного покрытия и
на поверхности
оксидного покрытия и ![]() – химический потенциал анионов
– химический потенциал анионов ![]() на глубине покрытия х.
на глубине покрытия х.
При небольшой концентрации анионов ![]() удельная электропроводность
покрытия σ–
связана с коэффициентом его твердофазной диффузии D и описывается законом Нернста-Эйнштейна:
удельная электропроводность
покрытия σ–
связана с коэффициентом его твердофазной диффузии D и описывается законом Нернста-Эйнштейна:
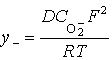 ,
,
где ![]() – концентрация анионов
– концентрация анионов ![]() , R = 8,314
Дж/(моль·К) и Т – абсолютная температура анодирования.
, R = 8,314
Дж/(моль·К) и Т – абсолютная температура анодирования.
Поэтому уравнение (19) можно выразить в виде:
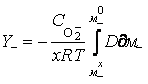 . (20)
. (20)
С другой стороны поток миграции анионов кислорода можно определить и через
скорость движения фронта миграции анионов ![]() :
:
![]() ,
(21)
,
(21)
где τ – продолжительность анодирования.
Примем параболический закон движения фронта миграции анионов ![]() в виде:
в виде:
![]() ,
(22)
,
(22)
где k – константа скорости роста
толщины покрытия.
Тогда, после приравнивания уравнений (20) и (21) с учетом (22), получаем
выражение для константы скорости роста покрытия:
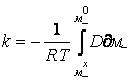 .
.
При небольшой концентрации анионов кислорода ![]() величина коэффициента
твердофазной диффузии D покрытия
не зависит от его концентрации и химического потенциала. Поэтому, с учетом
того, что активность анионов
величина коэффициента
твердофазной диффузии D покрытия
не зависит от его концентрации и химического потенциала. Поэтому, с учетом
того, что активность анионов ![]() в титанооксидном слое
совпадает с их малой концентрацией
в титанооксидном слое
совпадает с их малой концентрацией ![]() из предыдущего уравнения
можно записать:
из предыдущего уравнения
можно записать:
![]() ,
(23)
,
(23)
где ![]() и
и ![]() – твердофазные концентрации анионов
– твердофазные концентрации анионов ![]() на поверхности оксидного
покрытия и в его глубине х.
на поверхности оксидного
покрытия и в его глубине х.
Поскольку
на основании выражения (22) константа скорости роста покрытия
прямопропорциональна квадрату его глубины и обратнопропорциональна
продолжительности анодирования k = x2/2τ, то после потенциирования уравнения (23) получаем
формулу для определения твердофазной концентрации анионов ![]() на глубине покрытия х:
на глубине покрытия х:
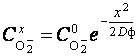 .
.
Таким образом, концентрация анионов кислорода уменьшается с квадратом
глубины их проникновения х2 и увеличивается с повышением
продолжительности анодирования τ по экспоненциальному закону. Кроме этого,
она сильно возрастает с увеличением температуры анодирования t и коэффициента твердофазной диффузии D, нарастающим со степенью структурной дефектности
формирующегося оксидного покрытия.
Для дальнейшего исследования кинетики анодирования титана целесообразно
задаться некоторой эффективной глубиной λ миграции анионов ![]() и определить их
среднюю концентрацию
и определить их
среднюю концентрацию ![]() по этой глубине:
по этой глубине:
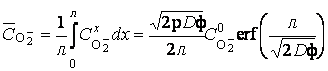 ,
,
где 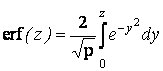 – функция
ошибок.
– функция
ошибок.
Можно
принять, что в пределах 0 ≤ х ≤ λ скорость
линейного роста оксидного покрытия в толщину j пропорциональна средней концентрации анионов
кислорода ![]() :
:
j
= k![]() ,
,
что соответствует протеканию реакции (14) по
закономерностям кинетики реакций первого порядка при избытке твердофазной
концентрации катионов титана.
Тогда
на основании линейности вольтамперной характеристики сернокислотного
анодирования титана, обусловленной омическим контролем, можно записать
выражение для потенциала анодирования Е:
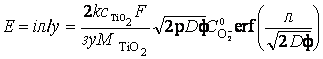 , (24)
, (24)
где i –
анодная плотность тока, σ – суммарная ионная и электронная проводимость
покрытия из диоксида TiO2, ![]() и
и ![]() – плотность и молекулярная масса покрытия, η ≤
1 – выход по току.
– плотность и молекулярная масса покрытия, η ≤
1 – выход по току.
Принято, что основное падение величины потенциала происходит в пределах эффективной
глубины проникновения λ анионов кислорода.
Величина анодной плотности тока i рассчитывается по закону Фарадея:
 .
(25)
.
(25)
Анализ
полученного кинетического уравнения представляет интерес для анодирования
титана при малых и больших значениях продолжительности, поскольку функция
ошибок ![]() при
при ![]() и еrf (z) = 1 при z ≥ 2.
и еrf (z) = 1 при z ≥ 2.
При
небольшой продолжительности анодирования τ = τ0 ≤ λ2/8D из выражения (24) получается параболический закон
роста потенциала Е с ![]() :
:
 , (26)
, (26)
соответствующий нарастающим участкам
экспериментальных кривых Е – τ (рис. 1 а, б) и
эффективной глубине проникновения λ анионов кислорода по всей малой
толщине оксидного покрытия.
При больших значениях продолжительности
электролиза τ = τ∞>> λ2/2D и повышенной толщине покрытия происходит установление
потенциала анодирования Е∞ до стационарных величин и он
перестает зависеть от τ ≥ τ∞. Поэтому из
уравнения (24) выражаем стационарный потенциал Е∞:
1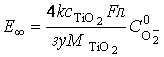
![]() , (27)
, (27)
который также соответствует экспериментальным данным
и эффективной глубине проникновения λ анионов кислорода лишь в небольшую
приповерхностную область растущего анодно-оксидного покрытия (рис. 1).
Линейное уменьшение стационарного потенциала Е∞ с
температурой анодирования титана объясняется ростом ионной компоненты удельной
электропроводности оксидного покрытия σ, входящей в знаменатель уравнения (27) (рис. 2).
Увеличение продолжительности обработки и температуры электролита отвечает
снижению потенциала анодирования Е на начальных стадиях процесса (рис.
1) и повышению времени его установления τ∞ до стационарных
значений (рис. 3), что также связано с температурным увеличением
электропроводности покрытия σ по соотношению (26).
Температурная независимость линейной скорости роста j титанооксидного покрытия в толщину определяется
постоянством значения выхода по току η согласно закону Фарадея (25)
(рис. 4). Таким образом, рассмотренные электрохимические аспекты оксидирования
в полной мере описывают явления и процессы, протекающие на поверхности титана,
в оксидном покрытии и электролите, согласуются с данными эксперимента и
обобщают представления об анодной обработке титановых имплантатов.
Кроме этого, исследование механизма и кинетики сернокислотного анодирования
пескоструйно обработанного титана в обоих используемых электролитах, а также
установленные закономерности формирования оксидных покрытий позволяют
определить необходимые технологические условия и режим электролиза для создания
анодированных костных имплантатов с требуемыми качествами биосовместимости.
Литература
1. Родионов И.В., Серянов Ю.В. Применение технологии анодного оксидирования при создании биосовместимых покрытий на дентальных имплантатах // Вестник Саратовского государственного технического университета, №2 (12), 2006. С. 77-87.
2. Родионов И.В.
Способ получения анодно-оксидных покрытий на титановых имплантатах с качествами
биологической совместимости / Маtеriály IV
Mezinárodní vĕdecko-praktická
konference
«Evropská
vĕda
XXI
století
– 2008». Praha, Czech
Republic: Publishing House «Education and Science» s.r.o. Díl 12 (Chemie
a chemická technologie). S. 18-20.