Химия и химические технологии/4.
Химико-фармацевтическое производство
Аспирант Новикова С.А.,
к.х.н. Глазова Н.В.
Санкт-Петербургская
химико-фармацевтическая академия, Россия
Исследование взаимодействий
сверхсшитых макропористых сорбентов
с панкреатической дезоксирибонуклеазой
Производство
ферментных препаратов является одним из перспективных направлений современной
биотехнологии. Ферментные препараты широко используются в медицине, косметологии
и др. Выбор гидролитического фермента ДНК-азы обусловлен тем, что ДНК-аза
обладает выраженным противовоспалительным и противовирусным действием при лечении
гнойно-воспалительных процессов различной локализации и этиологии. Особый
интерес представляет активность ДНК-азы в отношении вирусов герпеса трех подгрупп
[1].
В
работе изучены равновесные закономерности сорбции ДНК-азы на модифицированных и
немодифицированных сверсшитых полистирольных сорбентах, а также иммобилизация
фермента на современных нанообъектах: липосомах и гликосферах.
В работе была использована ДНК-аза
производства ООО «Самсон-Мед». Были использованы сорбенты фирмы «Пьюролайт»
С-160 и АР-500. Все эксперименты проводили в статических условиях.
Сорбенты С-160 и АР-500
являются представителями нового класса ионообменных смол. Сорбенты такого типа
представляют интерес, т.к. эти сорбенты имеют одинаковые по размеру поры
(мезопоры). Специфичность этих сорбентов обусловлена особыми условиями синтеза
сорбентов, и как следствие, их структурой. Стиросорбы обладают высокой
статической и динамической емкостью, химической и механической устойчивостью,
высокими кинетическими характеристиками [2]. Как было показано, сорбенты
обладают большой гидрофобностью, что может вызывать затруднения десорбции
белков. Была проведена обработка сорбентов раствором катапола, за счет чего
поверхность была модифицирована поливинилпирролидоном и катамином, который
закрыл часть гидрофобной поверхности и вводит заряженные группировки.
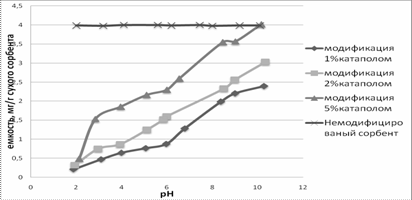
Рисунок
1.Зависимость емкости сорбции ДНК-азы от рН равновесного раствора на сорбенте
АР-500 с модифицированной и немодифицированной поверхностью
Как видно из рисунка 1, на молекулярном сорбенте
АР-500 с немодифицированной поверхностью не наблюдается изменения емкости
сорбции от рН равновесного раствора из-за отсутствия функциональных групп,
способных к ионизации. При достаточно высокой емкости сорбции невозможна
десорбция без использования органических растворителей. Однако, вид зависимости
существенно меняется при введении заряженных группировок. Емкость сорбции
ДНК-азы уменьшается в кислой области значений рН (при рН<рI) и возрастает в
щелочной области рН (при рН>рI), что обусловлено возникновением электростатических
молекул белка с положительно заряженными группировками катамина. Сорбция
следует проводить в щелочной области, а десорбцию – в кислой, где ДНК-аза
наиболее стабильна.
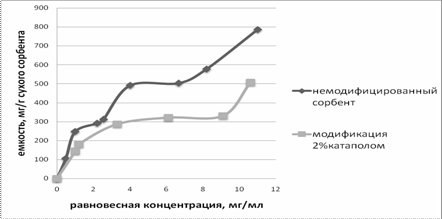
Рисунок
2. Изотермы сорбции ДНК-азы на сорбенте АР-500 с модифицированной и немодифицированной поверхностью
Как видно из рисунка 2, изотермы имеют вид изотерм БЭТ
на неионогенном сорбенте АР-500 как для модифицированного, так и для
немодифицированного. При выводе изотермы БЭТ применяются основные положения
модели локализованной сорбции по Ленгмюру. Это можно представить как образование
над каждым сорбируемым центром вертикальных столбиков из молекул сорбата. С
изменением поверхности носителя увеличивается количество диссоциирующих
функциональных групп, дополнительных центров связывания, благодаря чему
расширена локализованная сорбция. Из полученных данных видно, что на
модифицированном сорбенте можно провести десорбцию без использования
органического растворителя за счет изменения рН.
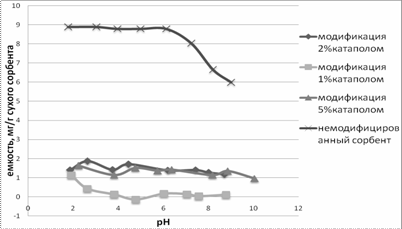
Рисунок
3.Зависимость емкости сорбции ДНК-азы от рН равновесного раствора на сорбенте
С-160 с модифицированной и немодифицированной поверхностью
Изменение вида емкости сорбции от рН наблюдается при
сорбции фермента на модифицированном сульфокатионите С-160. Максимальная
емкость сорбции ДНК-азы на сорбенте С-160 расположена в кислой области. Процесс
десорбции возможен в щелочной области рН(8-11), но будет затруднен, что связано
с большой гидрофобной поверхностью этого носителя. Поэтому возможно потребуется
введение органического растворителя для разрыва гидрофобных связей и облегчения
процесса десорбции.
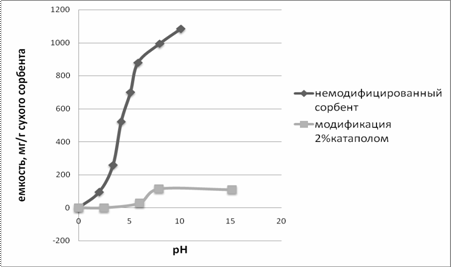
Рисунок
4.Изотермы сорбции ДНК-азы на сорбенте С-160 с модифицированной и немодифицированной
поверхностью
Как видно из рисунка 4, изотерма на ионите С-160 имеет
вид «S» образной, кооперативной изотермы. Как известно из литературных данных,
при достижении определенной равновесной концентрации сорбата в растворе происходит
изменение механизма сорбции. При сорбции происходит взаимное влияние сорбируемых
молекул друг на друга. Труднее сорбируются первые молекулы, а последующие
молекулы влияют друг на друга, облегчая процесс сорбции. Для носителя с
модифицированной поверхностью, значительно уменьшается емкость сорбции и
степень кооперативности, что говорит о нецелесообразности использования такого
модификатора в данном случае
В результате данной работы было исследованы равновесные
закономерности сорбции ДНК-азы на модифицированных и немодифицированных сорбентах,
показана перспективность использования структур с модифицированной поверхностью
для выделения и очистки гидролитического фермента.
Литература:
1. Шапот
В.С. «Нуклеазы» - Издат. «Медицина», Москва 1968 г.
2.
Белякова Л. Д., Василевская О. В., Цюрупа М. П., Даванков В.
А. Адсорбционные и хроматографические свойства полимерных сорбентов типа
«Стиросорб».// ЖФХ. 1995. Т.69. №4. С.696-700.