Головань А.В., Загородня С.Д., Опанасенко О.І.
Інститут мікробіології і вірусології ім. Д.К.
Заболотного НАН України
ДОСЛІДЖЕННЯ АПОПТОЗСТИМУЛЮЮЧОЇ ДІЇ ПРЕПАРАТІВ
АКТИВНИХ ПРОТИ ВІРУСУ ЕПШТЕЙНА - БАРР
Останніми
роками було досягнуто значного прогресу в з’ясуванні
молекулярних
механізмів вірусного онтогенезу. Зокрема, стало відомо, як функціонують і
взаємодіють між собою продукти вірусних
і клітинних онкогенів, а також продукти генів – супресорів пухлинного росту .
Ці дані дозволили розпочати розробку противірусних препаратів, придатних для
використання в онкологічній практиці.
Вважається ,
що приблизно 15% пухлин людини мають вірусну етіологію [3]. Інфікування
клітин онкогенними вірусами in vitro веде до утворення скупчень ( фокусів)
клітин зі зміненою морфологією, які здатні до багатошарового росту на
субстраті. Ці та деякі інші набуті клітинами властивості стають незворотніми і
в ряді випадків уже не вимагають подальшої присутності онкогенних вірусів у
клітинах. У процесі такої трансформації змінюється не лише морфологія клітини,
але й їх функції[1].
Важливо
відмітити, що деякі онкогенні вірусу асоційовані з розвитком пухлин певного
типу, тоді як інші віруси беруть участь у патогенезі різних злоякісних
новоутворень. Очевидно, ці властивості зумовлені тропізмом вірусів до клітин
певного типу[2]. Незаперечним « лідером » тут вважається вірус Епштейна-Барр
(ЕBV), здатний інфікувати Т – і В – лімфоцити, епітеліальні клітини і навіть
клітини гладких м’язів. ЕVB властивий для лімфоми Беркітта, деяких Т –
клітинних лейкозів, пухлин В – клітинної природи, пов’язаних із вродженим чи
набутим імунодефіцитом, з недиференційованим раком носоглотки, шлунка, легені,
слинної, навколо вушної, молочної залоз[4].
Значення
вірусу EBV у формуванні злоякісного
фенотипу клітин лімфоми було продемонстроване Дж. Комано та співав. З EBV – позитивної лінії Akata клітин лімфоми Беркітта
методом кінцевих розведень були відібрані клони, що не містили EBV, які потім піддавалися повторному
зараженню цим вірусом. Як виявилось, такі клони ( на відміну від неінфікованих
вірусом EBV ) здатні рости на
середовищі з напіврідким агаром і утворювати пухлини in vivo. При цьому EBV – позитивні клони клітин
лімфоми Беркітта проявляли значно більшу резистентність до апоптозу, ніж EBV – негативні колонії
клони . Тому автори прийшли до
висновку, що для розвитку злоякісного фенотипу і стійкості до апоптозу в
клітинах лімфоми Беркітта необхідна постійна присутність EBV [6].
ЕBV –
герпесвірус, здатний імморталізувати В – лімфоцити людини in vitro . Цей вірус
може також трансформувати in vivo нормальні В – клітини , які знаходяться в
стані спокою ( у тому числі циркулюючі В – лімфоцити ), в імунобласти[5]. Для клітин людини трансформуююча ( імморталізуюча ) здатність цього віруса
суттєво превищує можливості відомих трансформуючих вірусів [6]. Вивчення впливу антивірусних препаратів на
розвиток пухлин є актуальним питанням на сьогодні.
Мета
роботи: дослідження апоптозстимулюючої дії препаратів активних проти ЕBV.
Матеріали і методи:
Об’єктом нашого дослідження був рівень впливу
похідних цитидину (6 – азацитидин (( 6-АЦ) і
2'-3'- секо- 5-метил-6-АЦ) на репродукцію ЕVB та процес апоптозу в культурі
лімфобластоїдних клітин. Досліджувані препарати синтезовано в Інституті
молекулярної біології і генетики НАНУ та люб’язно надана для досліджень. В роботі була використана культура клітин Raji
– В - лімфоцити людини, трансформовані ЕBV, які мають в своєму геномі 63 копії
вірусного генома, але не продукують вірусні частки, а лише окремі ранні
антигени.
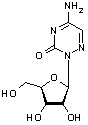
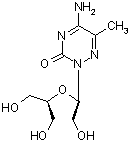
Структурні
формули досліджуваних речовин представлені на рисунку 1.
|
|
|
|
6-азацитидин, 2-b-D-рибофуранозил-5-аміно-1,2,4-триазин-3(2Н)-он (6-АЦ) (препарат №1); мол. масса -244,2; |
2'-3'- секо-5-метил-6-АЦ (препарат №2); мол. масса
-260,25; |
Рис.1 Структурні формули досліджуваних речовин
- 6 – АЦ та 2'-3'- секо-5-метил-6-АЦ
В роботі використовували
наступния метод отримання
фрагментованої ДНК:
- клітини,
попередньо інфіковані вірусом були розділені центрифугуванням при 1500 об/хв на 2 фракції(О – осад ;S –
супернатант);
- в
послідовності до культури інфікованих клітин
були додані необхідні реагенти(10 % і РНК-аза, протеїнкіназа, 3 мМ Na-ацетат, етанол) з
наступним їх центрифугуванням;
- осад
розчиняли в буфері та наносили на 1,5 % агарозу з етидій бромідом, після чого проводили електрофорез при 120 В (
10 мА)
- переносили
гель на скло трансілюмінатора і розглядали отримані результати в
ультрафіолетовому світлі.
Згідно з
методичними рекомендаціями з доклінічних дослідженнь потенційних антивірусних
препаратів in vitro, речовина, показник SI ( індекс селективності), якої вище за 16, є перспективною для подальших розробок.
Показники SI
для похідних цитидину 6 – АЦ і
«секо»-6-АЦ SI : 240 і 180 відповідно [Nesterova N.,.Dyachenko N,
Alexeeva I., Zagorodnaya S., Baranova G. Studying of AntiEpstein-Barr Virus
Activity of 6-Azacytidine and its Acyclic Derivative// Antiviral research.-2003
.-P. 71]. Це дозволило встановити рівень перспективності препаратів для
дослідження їх апоптозмодулюючих властивостей.
Результати та їх
обговорення:
ВЕБ-інфекція характеризується трьома фазами: гостра, латентна та активація.
Периферійна кров та органи лімфоїдної тканини є як правило місцями спокою для
латентно інфікованих ВЕБ лімфоцитів. Однак, якщо організм зазнає імуносупресії,
латентно інфіковані клітини реактивуються, відновлюють клітинну проліферацію та
вірусну реплікацію. Симптоми реактивованої ВЕБ-інфекції відрізняються від
симптомів первинного інфікування, так як асоціюються в основному зі злоякісними
пухлинами.
Зростання кількості захворювань, які пов’язують з ВЕБ інфекцією
підкреслює важливість розробки
ефективної вакцини, яка зможе захистити проти захворювання або для
вірус-асоційованих злоякісних пухлин це розробка антивірусних агентів, які б
могли знищувати уражені вірусом клітини, зокрем стимулюючи апоптоз. Похідні цитидину 6 – азацитидин і
2'-3'-секо-метил-6-азацитидин є перспективними для вивчення апоптозмодулюючих
властивостей.
При дослідженні впливу препаратів на розвиток апоптозу в
клітині інфікованій вірусом Епштейна-Барр застосовували електрофоретичне
розділення ДНК з метою виявлення апоптозспецифічної фрагментації. Препарати
використовували в таких концентраціях: 50, 125, 250 мкг/мл. У результаті
проведення електрофорезу в агарозному
гелі на трансілюмінаторі в ультрафіолетовому світлі були отримані
даніпредставлені на рисунку 2.
![]()
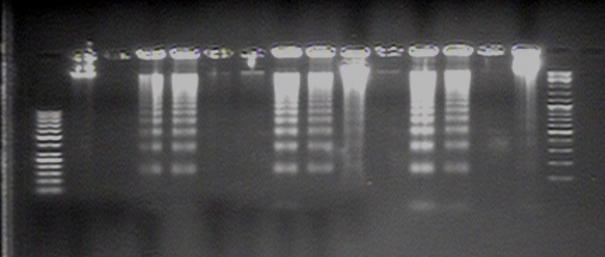
Рис.2
Фрагментація ДНК
М - маркер 50-1000 п.н.; м -
маркер 200-10000 п.н.; 1 – контроль клітин ,(О); 2 – клітини, інфіковані
вірусом ,(О); 3 - контроль клітин з
внесеною досліджуваною речовиною 6АС(50 мкг/мл), (S); 4 - клітини, інфіковані вірусом з 6АС(50 мкг/мл), (S); 5 - контроль клітин
з 6АС(50 мкг/мл), (О); 6 - клітини, інфіковані вірусом з 6АС(50 мкг/мл), (О); 7 - контроль клітин з секо 6АС(240 мкг/мл), (S); 8 - клітини,
інфіковані вірусом з секо 6АС(240
мкг/мл), (S); 9 - контроль клітин з
секо 6АС(240 мкг/мл), (О); 10 -
клітини, інфіковані вірусом секо 6АС(240
мкг/мл), (О); 11 - контроль клітин з
секо 6АС (50 мкг/мл ), (S); 12 - клітини,
інфіковані вірусом з секо 6АС( 50
мкг/мл), (S); 13 - контроль клітин з секо
6АС( 50 мкг/мл), (О); 14 - клітини, інфіковані вірусом з секо 6АС (50 мкг/мл), (О).
Отже, як видно з представленого рисунку фрагментація
спостерігається при додаванні обох
препаратів в різних концентраціях. Препарат
2'-3'- секо-5-метил-6-АЦ проявляє активність в концентраціях
240 мкг/мл та 50 мкг/мл, препарат 6 – АЦ в концентрації 50 мкг/мл. На рівні
позначки маркерів можна побачити поділки рівня фрагментації. Це свідчить про те, що досліджувані речовини
є перспективними для подальшого вивчення та модернізацій.
ВИСНОВКИ
1. Було розглянуто механізм
процесу апоптоза в клітині, інфікованій EBV.
2. Досліджено апотозмодулюючі властивості досліджуваних
препаратів (6 – АЦ та 2'-3'-
секо-5-метил-6-АЦ)
2. Було
встановлено залежність рівня апоптозу в інфікованих препаратах від концентрації
внесеного препарату.
Література
1.
Молчанець О.В. Основи вірусного канцерогенезу: Курс лекцій для студентів
біологічного факультету. К.: Фітосоціоцентр,2007.- С. 130 – 140.
2. Посевая Т.А., Цукерман В.Г. и
др. //Вопр. вирусол. 1991; 1: - С. 78.
3. Савцова З.Д., Гриневич Ю.А., Вирусные инфекции,
ассоциированные с онкологическими заболеваниями человека.// Сучасні інфекції,
2000, №3, - C. 70-83.
4. Фільченко
О.О., Стойка Р.С. Апоптоз і рак: від теорії до практики.- Т.,ТДМУ, 2006, 374 с.
5. Boucher Ch., Galasso G.A. Practical Guidelines in Antiviral Therapy// Elsevier, Amsterdam. - 2002. – Р. 344.
6. Gershburg E., Pagano J.S. et al. Epstein – Barr virus
infection: prospects for treatment// Jornal of antimicrobial chemotherapy
antiviral.- 2005;56: - Р. 277 – 281.