Химия и
химические технологии. Кинетика и катализ
к.х.н.
Н.В. Тарабанько, к.х.н. Н.В. Коропачинская, д.х.н. В.Е. Тарабанько
Институт
химии и химической технологии СО РАН, Красноярск
Об
использовании ванадиевых катализаторов
для окисления хлористого водорода в молекулярный хлор
Развитие
промышленности и значительное ухудшение состояния окружающей среды требуют
разработки и внедрения безопасных и ресурсосберегающих технологий. Современные
научные разработки направлены на решение подобных задач. Практически каждое
промышленное предприятие имеет возможности частичного или даже полного
замыкания циклов, связанных с переработкой собственных отходов или обработкой
отходов другого производства, для дальнейшего использования в качестве сырья в
известных технологиях. Данная работа направлена на решение проблемы рециклинга
молекулярного хлора.
Хлор
является важнейшим реагентом в процессах
1) синтеза
хлорорганических соединений и некоторых не содержащих хлор органических
продуктов:
R–H + Cl2 → R–Cl + HCl; R–NH2
+ (CO + Cl2)фосген → R–NCO + 2 HCl
HO-Ar-R-Ar-OH + 2NaOH + COCl2
→ (-Ar-R-Ar-O-CO-O-) + 2NaCl + 2H2O
2) хлорной
металлургии, характеризующейся большей производительностью и универсальностью
по сравнению с традиционно применяемыми методами переработки полиметаллических
руд [1]:
MeOn
+ nCO + nCl2 → MeCl2n↑ + nCO2
(хлориды разделяются перегонкой)
MeCl2n + nH2 → Me +
2HCl
Большой проблемой
данных технологий является переработка побочного продукта – хлористого
водорода. Это вещество находит ограниченный спрос на рынке. Основной способ его
утилизации в настоящее время – щелочная нейтрализация. В то же время,
регенерация молекулярного хлора из хлористого водорода и возвращение его в
процесс производства выглядит достаточно перспективной.
Наиболее
привлекательным путём решения этой задачи представляется каталитическое
окисление HCl кислородом, так называемый Дикон-процесс:
4HCl + O2 = 2Cl2 + 2H2O.
Затраты электроэнергии
на его осуществление могут быть на порядок ниже по сравнению с
распространёнными электролитическими методами [2].
Большинство известных катализаторов реакции Дикона
проявляют низкую производительность при умеренных температурах и низкую
стабильность при высоких температурах:
|
Катализатор |
Температура,°С |
Производительность по хлору, |
Данные о стабильности |
|
CuCl2 на SiO2 |
350 |
50 [3] |
Полностью испаряется при 420°С [4] |
|
CuO-Cr2O3 |
350 |
85 |
Полностью испаряется при 450 °С |
|
CoO-Cr2O3 |
350 – 425 |
150 – 250 |
Теряет 2/3 массы при 450°С |
|
V2O5 |
400 |
20 |
Нет данных |
|
Cr2O3 |
400 |
Более 440 |
Чувствителен к отравлению
железом |
|
RuO2 на TiO2 [2] |
200 – 380 |
Более 1000 |
Нет данных |
Целью
данного исследования являлись поиск высокопроизводительных катализаторов
Дикон-процесса на основе оксида ванадия(V), а также обеспечение условий их стабильной работы.
Катализаторы, использованные в работе:
1) Ванадий-хлоридный катализатор: смесь, содержащая
71,1 % V2O5, 13,2 % LiCl и
15,7 % KCl по массе, подвергалась спеканию при 370 °С в течение
3 ч.;
2) Промышленный катализатор сернокислотного
производства ИК‑1‑6: 9 % V2O5,
35 % пиросульфатов K + Na, нанесённые на SiO2.
Эксперименты проводились в проточном цилиндрическом
стеклянном реакторе с неподвижным слоем катализатора.
Установлено, что катализаторы на основе пятиокиси
ванадия вообще, а также ванадиевые катализаторы сернокислотного производства в
частности, высокоактивны в отношении реакции Дикона; а также проявляют
значительно большую стабильность, чем этого можно ожидать на основании работы
[4].
Активность ванадий-хлоридной системы достигает
780 г хлора на кг катализатора в час при 350 °С во
внешнедиффузионном режиме, что уступает только активности рутениевых
катализаторов [8 – 9]. Промышленно используемый катализатор сернокислотного
производства ИК–1-6 проявляет активность в реакции Дикона [10 – 12], а время
достижения равновесной конверсии хлористого водорода соизмеримо с таковым для
реакции окисления SO2 на данном катализаторе [13] (рис. 1).
Максимальная достигнутая производительность катализатора ИК-1-6 составляет
660 г хлора на кг катализатора в час при 400 °С.
Существенным недостатком ванадиевых катализаторов
является их высокая летучесть. В зависимости от условий, скорость потери массы
ванадий-хлоридного катализатора составляет 10 – 60 % активного компонента в
час. Ванадий-сульфатный катализатор ИК-1-6 более стабилен, летучесть активного
компонента не превышает 5% в час Наряду с потерей массы в процессе эксплуатации
наблюдается также и снижение активности (рис. 2). В дальнейшем был найден
способ преодоления проблемы летучести ванадия.
Потеря активного компонента происходит, очевидно, в
результате образования летучего VOCl3:
V2O5 + 6HCl = 2VOCl3 + 3H2O
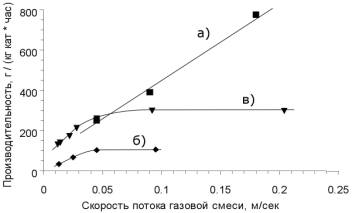
Рисунок 1. Зависимость
производительности катализаторов по хлору от скорости газового потока: а)
хлоридный катализатор, 350 °С; б) ИК-1-6, 300 °С; в) ИК-1-6,
350 °С. Масса катализатора 1 г, фракция 0,63 - 1 мм.
Концентрация HCl 20%. Продолжительность единичного эксперимента по измерению
активности – 15 мин.
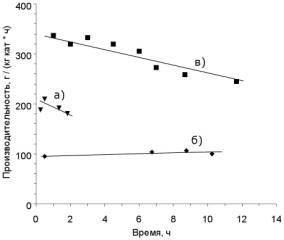
Рисунок 2.
Сравнительная стабильность катализаторов в реакции окисления HCl: а) хлоридный
катализатор, 5 г, 350 °С б) ИК-1-6, 300 °С; в) ИК‑1‑6,
350 °С. Скорость потока 6,3 н.л/ч, концентрация HCl 20 %. Фракция
катализатора 0,63
– 1мм. Внутренний диаметр реактора 7 мм, масса катализатора
1 г.
В соответствии с законом действующих
масс равновесное давление паров ванадийокситрихлорида, определяющее летучесть
ванадиевых катализаторов, будет резко уменьшаться по мере роста конверсии
хлористого водорода, Таким образом, катализаторы на основе пятиокиси ванадия
должны быть наиболее стабильными в условиях Дикон-процесса при достижении
высокой конверсии субстрата:
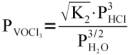
В условиях, когда конверсия хлористого водорода
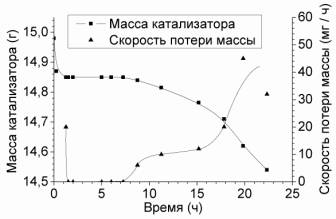
превышает 60 %, удаётся добиться нулевой потери массы катализатора в течение,
по крайней мере, 6 часов (рис. 3). При этом происходит удаление ванадия из
нижних слоёв катализатора и гидролиз образующегося ванадийокситрихлорида в
более высоких слоях по мере роста конверсии. Далее возрастающая скорость потери
массы обусловлена, очевидно, ограниченной скоростью гидролиза VOCl3
и уменьшением высоты активного ванадийсодержащего слоя, в пределах которого
должен произойти гидролиз VOCl3.
|
|
Рисунок 3. Зависимость массы катализатора ИК–1-6 и
скорости потери массы от продолжительности эксперимента. Начальная масса
катализатора 14,98 г, фракция 0,63 – 1 мм. |
|
|
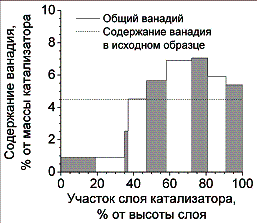
Рисунок 4. Распределение ванадия по высоте слоя
катализатора ИК–1-6 после 20 часов работы. Общая высота слоя 96 мм, начальная
масса катализатора 14,98 г, фракция 0,63 – 1 мм. |
Предлагаемый механизм переноса ванадия приводит к представленному
на рисунке 4 перераспределению активного компонента в направлении выхода из
реактора.
Перенос ванадия происходит достаточно медленно (не
наблюдается снижения массы катализатора в течение 6 часов), что позволяет
создать стабильно работающую каталитическую систему, периодически изменяя
направление движения реакционной смеси в реакторе [11 – 12].
Таким образом:
1. Впервые показана возможность применения
ванадий-оксидных катализаторов в реакции окисления хлористого водорода
кислородом. Активность полученных катализаторов (780 г/(кг кат*ч) при 350 °С) превосходит показатели всех
описанных в литературе катализаторов Дикон-процесса, за исключением рутениевых
систем.
2. Установлено, что промышленно применяемый
катализатор сернокислотного производства ИК-1-6 активен в реакции Дикона, и
демонстрирует скорость окисления хлористого водорода, соизмеримую со скоростью
окисления сернистого газа на этом катализаторе.
3. В опровержение имеющихся литературных данных о
совершенной нестабильности ванадий-оксидных систем в условиях реакции Дикона
[4], найдены условия устойчивой работы таких катализаторов.
4. Преодолено принципиальное препятствие на пути
промышленной реализации Дикон-процесса – нестабильность катализаторов окисления
хлористого водорода.
Литература.
1. Парфёнов О.Г., Пашков
Г.Л. Проблемы современной металлургии
титана. Новосибирск: Издательство СО РАН. 2008, 279 с.
2. Iwanaga K., Seki K., Hibi T., Issoo K., Suzuta T., Nakada M., Mori Y.,
Abe T. The Development of Improved Hydrogen Chloride Oxidation Process
// Sumitomo Kagaku 2004, 1, p. 4-12.
3. Riegel H., Strangio V.A. Production of chlorine. US Pat.
4119705, 1978.
4. Hisham M.W.M., Benson S.W. Thermochemistry of the Deacon Process
// J. Phys. Chem. 1995, 99, p.6194-6198.
5. Фещенко
Л.В., Власенко В.М., Чернобривец В.Л., Курилец Я.П. Окисление хлористого
водорода на кобальт-хромовом катализаторе // Журнал прикладной химии. 1991. Т. 64. С. 2040-2044.
6. Rohrmann C.A. Production of chlorine from chloride salts. US
Pat. 4269817. 1981.
7. Kiyoura T., Kogure Ya., Nagayama T., Kanaya K. Manufacturing
process of chlorine. US Patent 4 822 589, 1989.
8. Tarabanko V.E., Tarabanko N.V., Zhyzhaev A.M., Koropachinskaya N.V. A
Novel Vanadium Catalyst for Oxidation of Hydrogen Chloride with Dioxygen // J. of Siberian Federal University.
Chemistry, 2009, 1, p. 11-18.
9. Тарабанько
В.Е., Тарабанько Н.В., Коропачинская Н.В. Способ получения хлора
окислением хлористого водорода / Пат.
РФ №
2373139, БИ № 30 от 20.11.2009.
10. Tarabanko N.V., Tarabanko V.E. A New Vanadium Catalyst for
Chlorine Production by Hydrogen Chloride Oxidation // J. of Siberian Federal University. Chemistry, 2009, 2, p.
219-222.
11. Tarabanko V.E., Tarabanko N.V., Koropachinskaya N.V.
Using Vanadium Catalysts for Oxidation of Hydrogen Chloride with Molecular
Oxygen / Catalysis in Industry // 2010, 2, No. 3. P.
259-265.
12. Кустов А.Д., Парфёнов О.Г., Тарабанько
В.Е., Тарабанько Н.В. О получении хлора из хлористого водорода / Химия в
интересах устойчивого развития // 2010, 18, № 3. С. 339-346.
13. Боресков
Г.К.. Интенсификация сернокислотной системы // Химическая пром-ть, 1985,
1, с. 35-37.