Кириллов В.Ю.1,
д.х.н., проф. Еркасов Р.Ш.2
1Кокшетауский государственный университет им. Ш. Уалиханова, Казахстан
2Павлодарский государственный
университет им. С. Торайгырова, Казахстан
Электронное строение
О,О'-диалкил
α-аминоалкилфосфонатов и -тиофосфонатов
Среди многочисленных классов органических соединений аминофосфонаты
занимают особое место, проявляя широкий спектр биологической активности. Также
аминофосфонаты способны образовывать комплексные
соединения, в которых выступают в качестве моно-, би- и полидентатных лигандов.
Центрами координации служат электронодонорные атомы азота и фосфорильного
кислорода.
Благодаря выше перечисленным свойствам, исследования в
области α-аминоалкилфосфонатов продолжают развиваться. Одним из
перспективных направлений являются исследования О,О'-диалкил
α-аминоалкилфосфонатов и –тиофосфонатов. Данные соединения синтезированы по «иминному»
варианту реакции Пудовика – присоединение О,О'-диалкилфосфитов и –тиофосфитов к
виниловым эфирам оснований Шиффа в отсутствие растворителя с использованием в
качестве катализаторов бензола, толуола, п-толуолсульфокислоты:
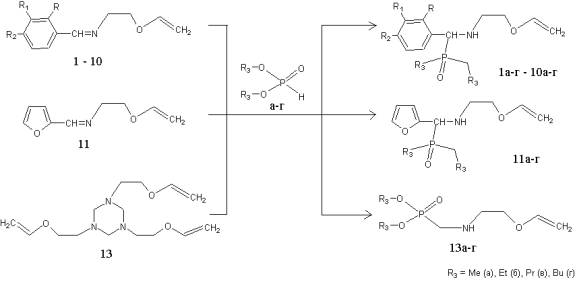
R=R1=R2=H (1), R=R1=H, R2=F (2), R=R1=H R2=O-CH3 (3), R=R2=O-CH3 (4), R=H, R1=R2=O-CH3 (5), R=R2=H, R1=O-CH3 (6), R=R1=H, R2=NO2 (7), R=R2=H, R1=NO2 (8), R1= R2=H, R=OH (9), R=R1=H, R2=N(CH3)2 (10)
Электронное
строение играет важную роль в исследовании соединений. Характеристиками электронного строения молекул являются электронная плотность, эффективные заряды на атомах,
граничная плотность электрона на атомах, дипольный момент, энергии граничных
орбиталей ВЗМО и НВМО, жесткость и мягкость молекулы, молекулярный
электростатический потенциал. Энергии и характер ВЗМО и НВМО оказывают большое
влияние на химические свойства соединений. Это связано с тем, что электроны,
наиболее легко перемещаемые к реагенту – это наименее слабо связанные электроны
ВЗМО. С другой стороны, реагент свои электроны может разместить, в первую
очередь, на НВМО молекулы, как самой энергетически выгодной из незанятых
орбиталей [1]. По теореме
Купманса энергии ВЗМО и НВМО молекулы приближенно равны потенциалу ионизации и
сродству к электрону, соответственно. Определение нуклеофильных и электрофильных
свойств молекулы осуществляется по
знаку энергии НВМО (нижней вакантной МО) молекулы:
знак «+» – нуклеофил; знак «-» - электрофил.
Используя программу Instant JChem v.2.2.1 (ChemAxon, Hungary) [2], основанной на программах ChemAxon's JChem и Marvin,
произвели все возможные стереоизомеры О,О'-диалкил α-аминоалкилфосфонатов и -тиофосфонатов в 3D-изображении. Затем
структуры изомеров перевели в программу HyperChem v.6.0 [3]. Расчеты проводили полуэмпирическим методом
PM3 с полной оптимизацией геометрии, градиент 0,01. Цель оптимизации геометрии
заключается в отыскании наиболее устойчивого состояния структур. Расчет
проводился в рамках ограниченного метода Хартри-Фока. Далее с использованием
пакета программ MOPAC v.7 проводили расчет полуэмпирическим методом PM3 [4-5].
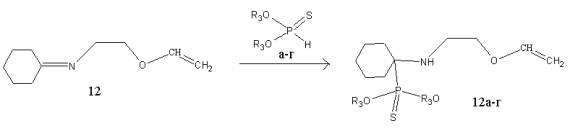
Для
молекул α-аминоалкилфосфонатов 1а-г
– 11а-г, образованных при
взаимодействии виниловых эфиров оснований Шиффа с О,О'-диалкилфосфитами,
характерна оптическая изомерия, так как имеется атом углерода, у которого все
заместители отличаются друг от друга. Например, соединения (R)-1б и (S)-1б
являются оптическими изомерами. Для соединений 12а-г и 13а-г оптическая
изомерия не характерна.
Анализируя полученные результаты выявлено, что в молекулах
О,О'-диалкил α-аминоалкилфосфонатов
и -тиофосфонатов
наибольший полный
отрицательный заряд сконцентрирован на атомах фосфорильного кислорода и фосфорильной
серы, наименьший – на атомах азота, атомы фосфора имеют положительный заряд (таблицы
1, 2).
Таблица 1 -
Энергия граничных орбиталей и эффективные заряды на некоторых атомах (R)- и (S)-изомеров О,О'-диалкил
{1-[2-(винилокси)этиламино]бензил} фосфонатов
|
Соеди- нение |
(R) |
(S) |
||||||||||
|
εВЗМО, эВ |
εНВМО, эВ |
q (C), е.з.э. |
q (N), е.з.э. |
q (P), е.з.э. |
q (O), е.з.э. |
εВЗМО, эВ |
εНВМО, эВ |
q (C), е.з.э. |
q (N), е.з.э. |
q (P), е.з.э. |
q (O), е.з.э. |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
1а |
-9.367 |
-0.125 |
-0.386 |
-0.054 |
2.047 |
-0.863 |
-9.350 |
-0.093 |
-0.410 |
-0.034 |
2.042 |
-0.852 |
|
1б |
-9.385 |
-0.102 |
-0.370 |
-0.038 |
2.042 |
-0.848 |
-9.383 |
-0.167 |
-0.409 |
-0.026 |
2.054 |
-0.863 |
|
1в |
-9.396 |
-0.111 |
-0.370 |
-0.039 |
2.047 |
-0.847 |
-9.262 |
-0.147 |
-0.413 |
-0.022 |
2.055 |
-0.863 |
|
1г |
-9.378 |
-0.140 |
-0.381 |
-0.052 |
2.054 |
-0.858 |
-9.376 |
-0.166 |
-0.396 |
-0.028 |
2.049 |
-0.857 |
Молекулы О,О'-диалкил
{1-[2-(винилокси)этиламино]метил} фосфонатов являются нуклеофилами и имеют
отличные ВЗМО и НВМО от всех остальных исследуемых нами фосфонатов, так как
сказывается отсутствие бензольного кольца в молекулах (таблица 2, рисунок 1).
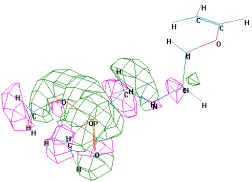
Граничные орбитали молекул О,О'-диалкил {1-[2-(винилокси)этиламино] циклогексил}
тиофосфонатов имеют совершенно другую форму. Это объясняется наличием в их
молекулах циклогексана и серы (таблица 2, рисунок 2).
Таблица 2 -
Энергия граничных орбиталей и эффективные заряды на некоторых атомах О,О'-диалкил
{1-[2-(винилокси)этиламино]метил} фосфонатов (13а-г) и О,О'-диалкил
{1-[2-(винилокси)этиламино] циклогексил} тиофосфонатов (12а-г)
|
Соеди- нение |
εВЗМО, эВ |
εНВМО, эВ |
q (C), е.з.э. |
q (N), е.з.э. |
q (P), е.з.э. |
q (O), е.з.э. |
Соеди- нение |
εВЗМО, эВ |
εНВМО, эВ |
q (N), е.з.э. |
q (P), е.з.э. |
q (S), е.з.э. |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
13а |
-9.471 |
0.349 |
-0.475 |
-0.029 |
2.060 |
-0.853 |
12а |
-9.131 |
-1.529 |
-0.040 |
1.623 |
-0.727 |
|
13б |
-9.418 |
0.287 |
-0.501 |
-0.020 |
2.064 |
-0.873 |
12б |
-8.923 |
-1.298 |
-0.070 |
1.663 |
-0.687 |
|
13в |
-9.419 |
0.278 |
-0.502 |
-0.022 |
2.066 |
-0.871 |
12в |
-9.136 |
-1.548 |
-0.035 |
1.636 |
-0.733 |
|
13г |
-9.474 |
0.278 |
-0.479 |
-0.019 |
2.060 |
-0.876 |
12г |
-8.980 |
-1.360 |
-0.091 |
1.663 |
-0.693 |
Граничные орбитали (R)- и (S)-изомеров фосфонатов рассмотрены на
примере О,О'-диэтил
{1-[2 (винилокси)этиламино] бензил} фосфоната. Из данных таблицы 1 и рисунков 3
и 4 видно, что данные соединения являются электрофилами и имеют сходные низшие
вакантные молекулярные орбитали, высшие же орбитали у них различаются. Введение
в бензольное кольцо различных заместителей и увеличение длины углеводородного
радикала при фосфорильной группе фосфонатов не меняет картины.
Анализируя пиктограммы ВЗМО фосфонатов и тиофосфонатов
исследуемых соединений можно увидеть, что они содержат неподеленные пары
электронов на атомах фосфорильного кислорода и серы и на атоме азота (рисунки
1-4).
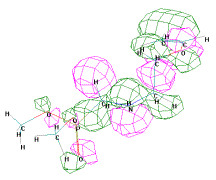
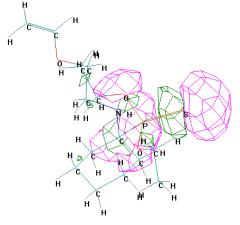
ВЗМО = -9,471 эВ НВМО = 0,349 Эв
Рисунок 1 - Граничные орбитали молекулы О,О'-диметил
{1-[2-(винилокси)этиламино]метил} фосфоната
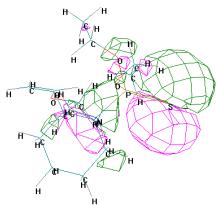
ВЗМО = -8,923
эВ
НВМО = -1,298 эВ
Рисунок 2 - Граничные орбитали молекулы О,О'-диэтил
{1-[2-(винилокси)этиламино] циклогексил} тиофосфоната
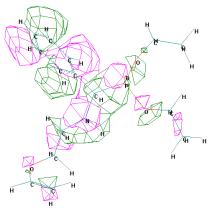
ВЗМО = -9,385 эВ НВМО =
-0,102 эВ
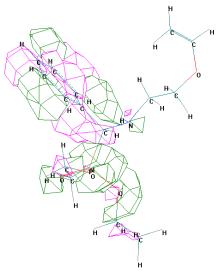
Рисунок 3 - Граничные орбитали молекулы (R)-О,О'-диэтил
{1-[2 (винилокси)этиламино] бензил} фосфоната ((R)-1б)
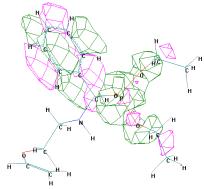
ВЗМО = -9,383 эВ НВМО =
-0,167 эВ
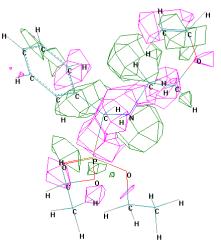
Рисунок 4 - Граничные орбитали молекулы (S)-О,О'-диэтил
{1-[2 (винилокси)этиламино] бензил} фосфоната ((S)-1б)
Основные вклады в ВЗМО фосфонатов и
тиофосфонатов дают 2p-АО фосфорильного кислорода, 3p-АО серы, 2p-АО азота. Такая структура ВЗМО способствует
образованию водородных связей типа Р=О···Н-Х и Х-Н···N-Н с протонодорными молекулами Н-Х.
Таким образом, электронное строение
молекул О,О'-диалкил α-аминоалкилфосфонатов и –тиофосфонатов дает
возможность получить информацию о строении и реакционной способности
соединений.
Литература:
1.
Глинка Н. Л.
Общая химия. - Москва: Интеграл – Пресс, 2002. - С. 131, 141.
4.
Stewart J.J.P. MOPAC. Manual
(Seventh Edition). - 1993. - Р. 277.
5.
Stewart J.J.P. Optimization of Parameters for Semi-Empirical Methods
I-Method //J. Comp. Chem. - 1989 - № 10 (221).