Баран
Б.А., Бубенщикова Г.Т., Хрящевський В.М.
ВПЛИВ ХОЛОДНОЇ ПЛАЗМИ НА ПРОЦЕС БРОДІННЯ
Для отримання етанолу віддавна використовують спиртове
бродіння органічних продуктів, що містять вуглеводи, під впливом ферментів
дріжджів і бактерій. Сучасна промислова технологія отримання етанолу з харчової
сировини містить такі стадії:
·
Підготовка та подрібнення сировини – зерна,
картоплі тощо.
·
Ферментація, тобто, ферментативне розщеплення
крохмалю до цукрів, здатних бродити. З цією метою застосовують препарати
α–амілази.
·
Бродіння.
·
Ректифікація.
Технологи
та науковці багато уваги приділяють дослідженню процесів ферментації і бродіння
з метою їх інтенсифікації, зокрема, впливу на них деяких фізичних факторів. В
роботі [1] наведені дані про вплив магнітного та електричного полів на бродіння
глюкози і сахарози. Показано, що попередня дія високочастотного електричного
поля на вихідні розчини вуглеводів значно збільшує швидкість бродіння. В даній
роботі досліджено вплив високочастотного електричного поля (холодної плазми) на
процес бродіння, однак, за вихідну речовину взято крохмаль.
Електричним
полем діяли на дистильовану воду протягом 1 години. Потім до 150 мл такої води
додавали 5 г крохмалю та 10 мл розчину амілази. Тривалість ферментації – 2 год.
Контрольний розчин приготовлений на дистильованій воді без дії електричного
поля. Постійне перемішування суміші здійснювалося на апараті для струшування.
Після ферментації в суміш додавали 1г сухих пекарських дріжджів. Швидкість
процесу оцінювали за об’ємом СО2, який виділявся під час бродіння.
Результати дослідів подані на рис.1. Як видно з рисунку, попередня дія
електричного поля на воду інтенсифікує процес бродіння, однак, цей процес
суттєво відрізняється від бродіння
сахарози в аналогічних умовах [1].
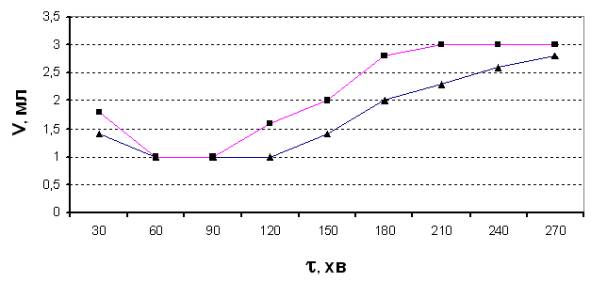 Рис.1. Виділення СО2 з бродильної
суміші в часі після двогодинної ферментації (■ – після дії холодної
плазми на воду; ▲- контрольний розчин)
Рис.1. Виділення СО2 з бродильної
суміші в часі після двогодинної ферментації (■ – після дії холодної
плазми на воду; ▲- контрольний розчин)
Дослід було дещо змінено, а власне – додано 1 мл амілази та час ферментації
скорочено до 1 години. Результати цього досліду подано на рис.2.
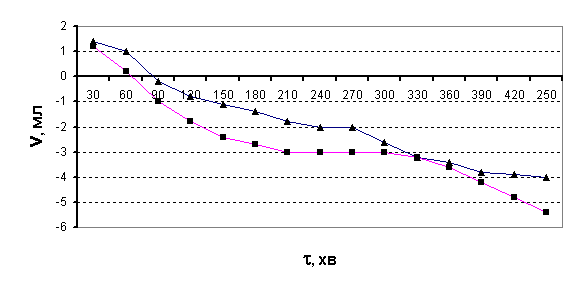 Рис.2.
Виділення СО2 з бродильної суміші в часі після годинної ферментації
(■ – після дії холодної плазми на воду; ▲- контрольний розчин)
Рис.2.
Виділення СО2 з бродильної суміші в часі після годинної ферментації
(■ – після дії холодної плазми на воду; ▲- контрольний розчин)
В цьому випадку на початку досліду також спостерігається виділення СО2,
однак пізніше об’єм газової суміші над бродильним розчином починає
зменшуватися. Таке явище може відбуватися за рахунок поглинання кисню, а це
означає, що процес бродіння проходить за іншим механізмом. В зв’язку з цим нами
було проведено бродіння розчину крохмалю в присутності α–амілази, але без
попередньої ферментації (рис.3).
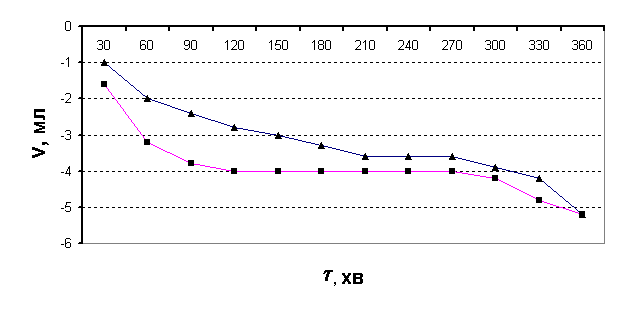 Рис.3.
Виділення СО2 з бродильної суміші в часі без ферментації розчину
(■ – після дії холодної плазми на воду; ▲- контрольний розчин)
Рис.3.
Виділення СО2 з бродильної суміші в часі без ферментації розчину
(■ – після дії холодної плазми на воду; ▲- контрольний розчин)
В даному разі об’єм газової суміші починає зменшуватися від самого початку
досліду, що підтверджує попереднє припущення. Для більшої переконливості дослід
повторили, тобто, ферментацію не проводили, однак в обидва розчини (експеримент
і контрольний) додали невелику кількість глюкози. Як видно з рис.4, в обох
випадках спочатку спостерігається виділення СО2 з подальшим
зменшенням об’єму газової суміші.
Є три види бродіння: спиртове, молочнокисле та маслянокисле. При спиртовому
бродінні утворюється спирт та СО2. При маслянокислому бродінні поряд
з масляною кислотою, СО2 та воднем, як побічні продукти утворюються
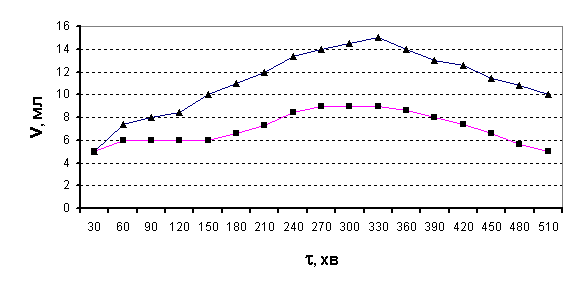 Рис.4.
Виділення СО2 з бродильної суміші з домішкою глюкози в часі (■ – після дії холодної плазми
на воду; ▲- контрольний розчин)
Рис.4.
Виділення СО2 з бродильної суміші з домішкою глюкози в часі (■ – після дії холодної плазми
на воду; ▲- контрольний розчин)
етанол, молочна та
оцтова кислоти. Кінцевим продуктом
молочнокислого бродіння є молочна кислота.
Дріжджі є хемоорганогетеротрофами і використовують органічні
сполуки для отримання енергії і як джерело вуглецю.
Для цього в анаеробних умовах дріжджі
можуть використовувати лише вуглеводи, при чому, в основному гексози та
побудовані з них олігосахарози. Деякі види (Pichia stipitis, Pachysolen tannophilus) засвоюють і пентози, напрклад, ксилозу. Schwanniomyces occidentalis та Saccharomycopsis fibuliger здатні зброджувати крохмаль.
Більшість мікроорганізмів є облігатними аеробами, для росту їм необхідний
кисень [2]. Участь кисню в метаболізмі аеробних мікроорганізмів йде в трьох
напрямках: споживання кисню для нарощування біомаси, використання кисню для на
синтез продуктів метаболізму та витрата кисню на підтримку наявної біомаси. Для
нормального росту мікроорганізмів необхідна вища концентрація кисню в
середовищі, ніж для забезпечення дихання. Так, для нормального росту дріжджів Saccharomyces cereviciae була
встановлена оптимальна концентрація кисню 3,7 мг/мл. Оскільки
в наших дослідах використовували сухі дріжджі, то частина кисню з газової
суміші над розчином поглиналася для нарощування та підтримку наявної біомаси,
що проявлялося у зменшенні загального об’єму газу. Окрім того, при гідролізі
крохмалю під дією α–амілази крім глюкози утворюється суміш декстринів
внаслідок невпорядкованої атаки ланцюгів [3]. Можна допустити, що в наших
дослідах бродіння проходить зразу двома
шляхами: глюкоза перетворюється в етанол з виділенням СО2, а бродіння декстринів
проходить за молочнокислим механізмом, при якому виділення СО2
відсутнє. Певним доказом цього є результати вимірювання рН розчинів. Так, у
вихідному розчині крохмалю (разом з амілазою та дріжджами) рН = 7,0. Після 5-и
годинного бродіння водневий показник як експериментального, так і контрольного
розчинів становив 5,6. Окрім того, згідно даних роботи [1] виділення
СО2 з розчину, попередньо обробленого коронним розрядом, різко
зростає – в 3,2 рази протягом перших чотирьох годин. Якщо ж таким чином обробляти
розчин сахарози разом з дріжджовими клітинами, то виділення СО2 різко знижується і лише через 3 години перевищує виділення з контрольного розчину. А це вже
може свідчити про те, що електричне поле негативно впливає на дріжджові клітини
і призводить до зменшення їх активності.
Спиртове бродіння – це строго регламентований ланцюг хімічних реакцій,
кінцевим результатом якого є розпад глюкози з утворенням етанолу та оксиду
вуглецю (IV):
С6Н12О6
→ 2С2Н5ОН + 2СО2
При гомоферментативному молочнокислому бродінні утворюється лише молочна
кислота (вона становить не менше 90% всіх продуктів бродіння). Молочнокисле
бродіння на прикладі глюкози можна описати рівнянням:
С6Н12О6
→ 2СН3СНОНСООН + 21,8∙104 дж
Сухі пекарські дріжджі до певної міри можна назвати “багатопрофільними”, в
тому розумінні, що вони можуть спричинювати бродіння за різними механізмами, в
тім числі і за молочнокислим. Для перевірки активності пекарських дріжджів в
молочнокислому бродінні нами було використане пастеризоване молоко. Для цього
150 мл молока опромінювали холодною плазмою протягом 1 години, після чого
додавали 1 г сухих дріжджів. Контроль за процесом бродіння здійснювали методом
вимірювання електропровідності – внаслідок утворення молочної кислоти
електропровідність повинна зростати. Досліди показали, що сухі дріжджі в
значній мірі прискорюють скисання молока – за час експерименту, коли вже
візуально було видно саме скисання, саме молоко без додавання дріжджів та його
електропровідність практично залишалися без змін. В той же час швидкість
скисання молока після опромінення високочастотним електричним полем збільшилася
в 1,7 рази, порівняно з контрольним розчином.
Дослідження кінетики реакції
окиснення тіоктової кислоти йодом показало, що співвідношення ефективної
константи швидкості такої реакції в опроміненій воді k' до аналогічної константи в
контрольному розчині k збільшується. Після обробки дистильованої води електричним полем протягом
1 години співвідношення k'/k = 2,3, а після 2-х годинної
обробки k'/k = 2,6. Значення рН при цьому зросло від 6,75 до 6,90, а електропровідність
води зменшилася на 53,0%. Такі зміни фізико-хімічних властивостей води
означають підвищення її структурної температури внаслідок послаблення водневих
зв’язків між молекулами води. Цим можна пояснити зміну кінетики біохімічних
реакцій у воді після дії високочастотного
електричного поля. Однак, як показали результати
дослідів, якщо для одержання етанолу вихідною сировиною є крохмаль (наприклад,
картопля), то його потрібно попередньо повністю ферментувати. Дослідження
кінетики гідролізу крохмалю показали,
що після обробки його розчину
високочастотним електричним полем протягом
60 хв k'/k = 1,21, а після 2-х годинної
обробки k'/k = 1,39. На думку багатьох дослідників первинною мішенню дії електричного чи
магнітного полів є клітинна мембрана. В будь-якій живій клітині одночасно
проходять складні біохімічні реакції, які пов’язані позитивними та негативними
зворотніми зв’язками. Під впливом магнітного чи електромагнітного поля відбувається зміна магнітоелектричних
властивостей як внутрішньо- і зовнішньоклітинної води, так і молекул води, що
входять до складу клітинних мембран. Мембрани клітин можуть змінювати свої
бар’єрні властивості при дії випромінювання
і виявляти регуляторну дію на весь організм взагалі та на окремі ланки. Процеси, які відбуваються в клітині, залежать не лише від
хімічних перетворень, але і від конфігурації ланцюгів зв’язків всередині цих
структур, котрі є слабкими і легко можуть руйнуватися зовнішніми діями, зокрема
холодної плазми. Вказані ефекти можуть бути пов’язані не лише з безпосередньою дією
магнітних полів на білки, але можуть бути зумовлені змінами властивостей
розчинника – води, слабких розчинів солей та їх кластерів.
Таким чином, як магнітне, так і електричне поле впливають на активність
мікроорганізмів. В залежності від умов та режиму обробки ця дія може
активізувати життєдіяльність мікроорганізмів, або пригнічувати її. Завдяки
цьому з допомогою електричного поля можна корегувати процес бродіння.
Використання холодної плазми може прискорити процес ферментації. Так само
попередня обробка високочастотним електричним полем продуктів повної
ферментації крохмалю значно прискорює процес бродіння, як це було показано в
роботі [1].
Література
1. Баран Б.А.,Бубенщикова
Г.Т., Рокіцька
В.Й., Хрящевський
В.М. Дія магнітного та електричного полів на процес бродіння //Вісник
Хмельницького національного університету. Технічні науки. - 2009. - №1. – С.151
– 154.
2. Глик Б., Пастернак Дж.
Молекулярная биотехнология. — 2-е издание. — М.: Мир, 2002. — 327 c.
3. Диксон М., Уэбб Э.
Ферменты.- Т.1. – М.: Мир, 1982. – С.368.
Пепсин — это 1-компонентный протеолитический фермент
желудочного сока. Пепсин является альбумином, имеет глобулярные молекулы,
хорошо растворим в воде, его особенностью является тот факт, что он разрушается
(свертывается) при нагревании, осаждается спиртом, солями тяжелых металлов,
дубильными веществами. Концентрированные кислоты и щелочи мгновенно разрушают
пепсин. Свет инактивирует фермент. Свою активность пепсин проявляет только в
слабокислой среде, особенно в соляно-кислой среде. Поэтому приготавливать
растворы пепсина необходимо с учетом всех этих особенностей. Протеолитическое
действие пепсина активируется хлористо-водородной кислотой в концентрации от
0,1 до 0,5 %.
При растворении пепсина в хлористо-водородной кислоте с концентрацией хлористого водорода более 0,5 % фермент подвергается гидролизу с образованием продуктов, не оказывающих ферментативного действия. В медицинской практике применяются 2— 4%-ные растворы пепсина в сочетании с соляной кислотой.
Заметим, что свет, отраженный от поверхности металлов (в том числе от зеркал – ведь каждое зеркало покрыто тонким слоем металла), не поляризован. Это связано с высокой проводимостью металлов, с тем, что в них очень много свободных электронов. Отражение электромагнитных волн от таких поверхностей происходит иначе, чем от поверхностей диэлектрических, непроводящих.