Строительство и архитектура / 4. Современные строительные материалы
К.х.н. Бегалиева Д.У., к.т.н. Ни В.В.
КАЗАХСКИЙ АВТОМОБИЛЬНО-ДОРОЖНЫЙ
ИНСТИТУТ
ИМ. Л.Б. ГОНЧАРОВА
Исследование
кинетики взаимодействия фосфорного шлака с жидким стеклом при укреплении
грунтов в дорожном
строительстве
Проведение исследования показывают, что при
действии воды на фосфорный шлак и фосфорсодержащие стекла происходит постоянная
и гидратация. Увеличение времени взаимодействия фосфорного шлака и фосфорсодержащих стекол с дистиллированной водой приводит к
повышению в жидкой фазе концентрации CaO.
Однако максимальное содержание извести в жидкой фазе не превышает 112 мг/л в
кремнезема 90 мг/л (взаимодействие
фосфорсодержащего стекла № 1 и водой в течение трёх часов), в то время
как при трёхчасовой
гидратации основного клинкерного
минерала трёхкальциевого силиката в растворе извести обнаружено около 1500 мг/л, или в 13,4 раза больше.
Слабая гидратация фосфорного шлака и
фосфорсодержащих стекол указывает на
низкую гидравлическую активность соединений с добавкой пятиоксида фосфора. Увеличение
в стеклах содержания пятиоксида фосфора снижает их гидратацию. Наименьшая
гидратация наблюдается у молотого гранулированного фосфорного шлака.
При
взаимодействии жидкого стекла и фосфорного шлака переход в жидкую фазу резко снижается. Это
объясняется тем, что в щелочной среде
растворимость Са(ОН)2 очень незначительно. Например растворимость Са(ОН)2
в чистой воде при температуре 20 ºС составляет 1,19-1,21 СаО
г/л (растворимость её зависит
от размеров кристаллов), в щелочной среде при
концентрации NаОН ,
равной 6,141 г/л она уже
отвечает 0,196 СаО
г/л. При концентрации щелочи более 20 г/л содержащие СаО в растворе
очень мало («следы»).
Растворимость Са (ОН)2 в
дистиллированной воде и
щелочах при различных
температурах приведена в
таблицах 1 и 2.
Таблица 1 - Растворимость Са(ОН)2 в дистиллированной воде при различных температурах
|
№ опыта |
Темпера тура, 0С |
Концентрация СаО, г/л |
№ опыта |
Темпера Тура, 0С |
Концентрация СаО, г/л |
№ опыта |
Темпера тура град. |
Концентрация СаО, г/л |
|
1 2 3 4 |
0 15 25 40 |
1,30 1,22 1,13 1,00 |
5 6 7 8 |
50 60,8 81,7 90 |
0,917 0,818 0,657 0,591 |
9 10 11 12 |
99 120 125 150 |
0,523 0,400 0,380 0,247 |
Таблица 2 - Растворимость Са(ОН)2 в растворах NаОН при
различных температурах
|
№ опыта |
Температура, 0С |
Концентрация |
№ опыта |
Температура, 0С |
Концентрация |
||
|
NаОН, г/л |
СаО, г/л |
NаОН, г/л |
СаО, г/л |
||||
|
1 2 3 4 5 6 7 |
20 20 20 20 20 40 70 |
1,008 2,100 4,140 6,141 8,361 0,400 1,600 |
0,779 0,516 0,281 0,169 0,146 0,530 0,250 |
8 9 10 11 12 13 14 |
70 70 70 100 100 100 100 |
5,00 8,00 20,00 0,40 1,60 5,00 8,00 |
0,040 0,010 следы 0,350 0,140 0,010 следы |
В жидкой
фазе суспензий фосфорного шлака
и стекол с
добавкой P2O5, содержащих жидкое
стекло плотности 1,26 г/см3, известь
обнаруживается в виде
«следов».
Из графиков (рисунки 1 и 2) видно, что
скорость перехода СаО в раствор не равномерная: в первые
часы она наибольшая,
а в дальнейшем она
лишь медленно увеличивается. Тормозящее действие на скорость гидратации, очевидно, оказывает нерастворимая в среде жидкого
стекла или воды пленка,
образующейся на поверхности
частиц шлака (или фосфорсодержащих стекол)
вследствие взаимодействия исходного
продукта и реагента.
По мере продолжительности процесса
эта пленка увеличивается в размерах и
уплотняется, в результате
чего препятствует проникновению воды или жидкого
стекла в глубь частички
шлака или фосфорсодержащего стекла. Наличие
такой плёнки на частичках доменного шлака глиноземсодержащих стекол
при взаимодействии с жидким
стеклом было установлено
ранее [1]. Для таких
самотормозящих процессов
скорость перехода СаО в
жидкую фазу является
функцией концентрации
жидкого стекла, времени
взаимодействия и температуры.
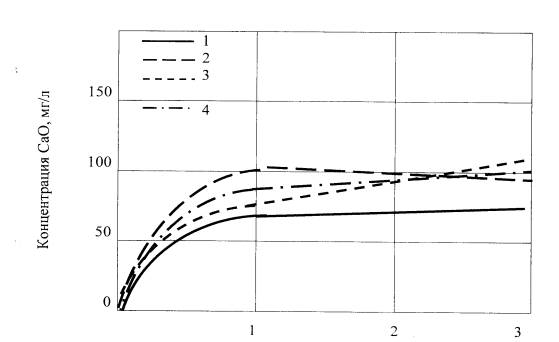
Время, ч
I – фосфорный шлак; 2 – фосфорсодержащее стекло с 3% Р2О5;
3 – фосфорсодержащее стекло с 3% Р2О5;
4 – фосфорсодержащее стекло с 1% Р2О5;
Рисунок 1 - Изменение
концентрация СаО в жидкой фазе
при гидратации
фосфорного шлака в фосфорсодержащих
стекол (под действием
воды)
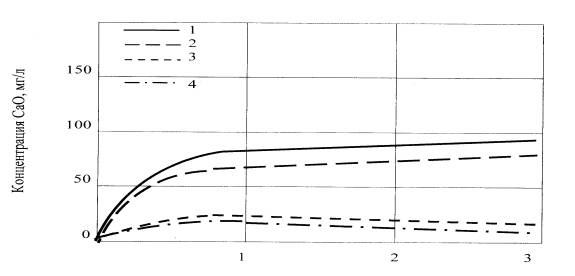
Время, ч
I –
фосфорный шлак и жидкое стекло плотностью 1,036; 2 – фосфорсодержащее стекло и
жидкое стекло плотностью 1,036; 3 – фосфорный шлак и жидкое стекло плотностью
1,16; 4 – фосфорсодержащее стекло и жидкое стекло плотностью 1,16
Рисунок 2 - Изменение
концентрации СаО в жидкой фазе при взаимодействии
фосфорного шлака и
стекла № 3 (с добавкой 3 % Р2О5)
с жидкими стеклами
Наиболее приемлемым,
охватывающим все указанные факторы
следует считать уравнение, предложенное Б.В.Ротинян и Б.Г. Дроздовым для самотормозящих реакции [2] V=![]() lg
lg ![]()
где: а - начальная
концентрация вещества; х - концентрация веществ, прореагировавшие
времени t от начало опыта; ß- коэффициент торможения реакции; V- суммарная скорость реакции.
Применимость этого
уравнения к самотормозящим реакциям, наблюдаемым при
взаимодействии фосфорного шлака и
фосфорсодержащих стекол
с жидким стеклом низкой
плотности (1,036 г/см3) подтверждается прямолинейной зависимостью, рассчитанной по экспериментальным данным и представленной на рисунке 3 в
координатах: 1/t ig a/a-x ; x/t.
Взаимодействие фосфорного шлака и фосфорсодержащего стекла (рисунок 3) с жидким стеклом
плотности 1,16 г/см3 имеет
свои особенности. В начале процесс протекает в той же
последовательности, что и для самотормозящих реакций: быстрый переход
в жидкую фазу,
а затем снижение содержания
этого оксида в растворе. В
этом случае за
растворением исходного
продукта следует медленные
химические реакции между
известью и кремнеземам
с образованием нерастворимых в щелочной среде
новообразований. Это явление
подтверждается том, что
при длительном стоянии фильтра,
полученного после отфильтровывания через три часа
взаимодействия в суспензии фосфорного шлака
(или фосфорсодержащего стекла)
с жидким стеклом, на стенах колб наблюдается выпадение
осадка очень тонкодисперсного белого порошка.
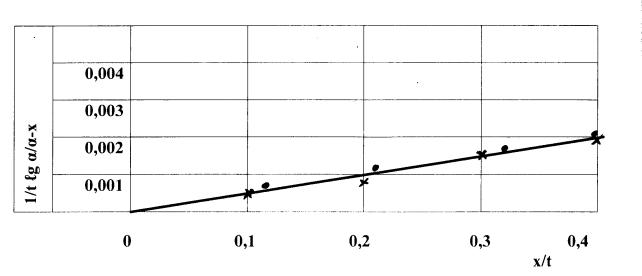
х -
фосфорный шлак и жидкое стекло плотностью 1,036; • - фосфорсодержащее стекло (с
3% Р2О5) и жидкое стекло плотностью 1,036
Рисунок 3 -
Применимость уравнения Б.Г. Ротиняна и
А.Л. Дроздова к
взаимодействию исследуемых продуктов
Образование вторичных продуктов в
жидкой фазе идет вследствие взаимодействия
кремнекислородных, алюмокислородных и
подобных инанионов с
коллоидными частицами гидроокиси
кальция и магния.
Эти анионы,
образуя на поверхности частиц шлаке (или фосфорсодержащих стекол) ионогенные центры,
имеющие отрицательный заряд,
способны адсорбировать кальциевые и
магниевые ионные гидрооксиды
кальция и магния, гидроксильные ионы которых образуют
второй диффузный слой.
Поглощение извести и
оксида магния приводит к химическим процессам. В результате
этого образуются вторичные
продукты- гидросиликаты и гидроалюминосиликаты кальция или
магния.
С другой стороны, в
жидкой фазе, несомненно,
идет непосредственное взаимодействие ионов кальция с
кремнекислородными аннонами, несмотря
на кажущуюся невозможность протекания
такой реакции вследствие
незначительной
растворимости оксида кальция
в щелочной среде. Катионы кальция, обладающие большой
ионной силой,
присоединяются полимерным кремнекислородным аниона, что подтверждается изменением показателя
светопреломления стекла до
1,58. Кроме того,
наблюдается появление геля,
который покрывает частицы стекла
и реже встречается межзерновом
пространства, являясь основной
цементирующей связкой, гель представляет собой полупрозрачную массу с
показателем светопреломления 1,530.
Местами обнаружены криссталики
в межзерновом пространстве, являясь основной
цементирующей связкой псевдоволластонита (до 3-5) края которых
довольно сильно корродировены. Микроскопические
исследования подтверждаются рентгенографическим анализом образцов и шлакосиликатного вяжущего.
На
рентгенограммах образцов (рисунок 4)
наблюдаются линии, отвечающие межплоскостным расстояния: 2,81; 2,85+2,87;
2,94; 3,02; 3,4 Ǻ, характерные для
исходного продукта Чимкентского шлака (рис.4) Кроме линии фосфорного шлака,
на рентгенограмме (рис.4)
обнаружены линии, соответствующие межплоскостным расстояниям: 2,12; 2,57; 2,72; 3,26; Ǻ. Эти линии
отвечают натриево-кальциевому
гидросиликату, они хорошо
совпадают с описанными в
литературе [3].
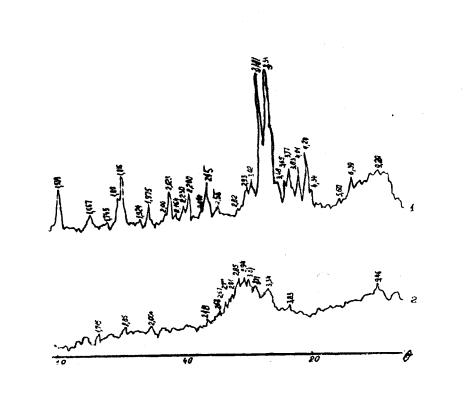
Рисунок 4 - Рентгенограмма
барханного песка (I) и фосфорного
шлака Шымкентского завода
фосфорных солей (2)
Калоусек Дж. [5]
установил наличие четырёх индивидуальных фаз
данного гидросиликата C4S5.aq, CS.aq, C5S4.aq, C4S3.aq. Рентгенографические эти
фазы не отличимые.
Основное отличие проявляется на
кривых дифференциального термического анализа (ДТА). C4S3.aq дает
экзотермический эффект при 900ºС, C5S4 .aq при
860ºС , CS .aq и C4S5 .aq при 830ºС,
но эффект CS .aq в 2 раза
сильнее эффекта C4S5 .aq.
В нашем
случае на кривых
ДТА экзотермический эффект
обнаруживается при температурах менее 810 ºС.
Данный экзотермический эффект
указывает на присутствие
в новообразованиях тоберморита состава C S .aq, так как
величина эффекта намного
выше экзотермического пика,
характерного для C4S5.aq. Некоторое
снижение температуры волластонитового превращения обусловливается
присутствуем образцах щелочного
компонента, который при
нагревании действует как
плавень.
Большой
эндотермический эффект при
130-170ºС указывает на
удаление адсорбционной воды из аморфного кремнезема, а экзотермический эффект при 340-380ºС - на кристаллизацию геля.
Два
эндотермических эффекта в
интервале температур 400-540ºС и 680-700ºС соответствует натриево-кальциевому гидросиликату.
Следует отметить,
что эндотермические эффекты,
характерные для данного
гидросиликата,
перекрываются эндотермическими эффектами
при 580ºС и
720ºС, отвечающими исходному
сырьевому компоненту вяжущего- фосфорному шлаку.
Тот факт,
что при микроскопических исследованиях семисуточных образцов
шлакосиликатного вяжущего не
были обнаружены натриево-кальциевой гидросиликат, тоберморит и C-S-H(I),
указывает на незначительное количество
этих соединении в
новообразованиях.
Увеличение времени
твердения образцов до
14 суток способствует более глубокой гидратации
шлака. В четырнадцатисуточных образцах
частицы шлака окружены
плотной гелевидной плёнкой,
играющей роль цементирующей
массы. Количество геля увеличилось
по сравнению с
предыдущей пробой. Размер
частиц шлака заметно
уменьшился (до 0,008мм). Цементирующая
масса представлена, в основном, прозрачным изотропным
гелем с показателем светопреломления 1,53. В геле
встречаются слабо анизотропные тоберморитовые
пластинки с показателем
светопреломления 1,570+/-0,05 и
кристаллики псевдоволластонита. На
рентгенограммах образцов (рисунок 4)
появились дополнительные дифракционные максимумы, что свидетельствует о более полной кристаллизации новообразований.
Эти дополнительные дифракционные максимумы (1,510; 2,23; 2,63; 2,91; 3,10; 6,90 Å)
относящиеся к натриево-кальциевому
гидросиликату и
(1,60; 2,018; 2,27А)- тобермориту.
На присутствие
натриево-кальциевого гидросиликата указывают
два эндотермических эффекта
при температурах 570ºС и 690ºС, а на тоберморит - эндотермической эффект
при 130ºС и
экзотермической при 800º.
Последний эффект также свидетельствует о наличии в новообразованиях C-S-H(I) линии
межплоскостных расстоянии которого (1,827; 2,78; 3,04 Ǻ) четко видны
на рентгенограмме (рисунок 4).
В образцах, твердевших 2
суток в нормальных условиях,
основная масса представлена агрегатными
скоплениями мельчайших частиц
шлака, связанных между собой
гелем с показателем
светопреломления 1,52-1,53. Характерным
для данной пробы, в отличие от
предыдущих, является то, что агрегатные скопления направлении к периферии
переходят в сплошную тоберморитовую кайму
с показателем
светопреломления 1,570±0,005, включающую
изотропные точечные включения
шлакового стекла и анизотропные зерна
псевдоволластанита
размерами до 1
микрона.
Рентгенограммы и
термограммы свидетельствует о
наличии в новообразованиях тех же гидросиликатов, что были обнаружены
в первых пробах.
Только в этом случае
дифракционная картина проявляется
более четко. Появляются
дополнительные
дифракционные максимумы: 1,804; 1,98 Ǻ. (натриево-кальциевый гидросиликат) и 1,917; 2,46; 2,70;
2,96; Ǻ (тоберморит).
Анализ
рентгенограмм и термограмм образцов,
приготовленных на основе фосфорсодержащего стекла и
жидкого стекла, показал,
что в новообразованиях
имеется тоберморит. Об этом свидетельствует наличие
на рентгенограмме (рисунок 4)
линий, отвечающих межплоскостных расстояниям: 1,535;
1,615; 1,665; 1,705; 1,825; 1,917;
1,993; 2,11; 2,215; 2,46;
2,81; 2,99; 5,63 Ǻ, а на
термограмме –
эндотермический эффект при
150ºС. Последний эффект
указывает также на
присутствии в новообразовании гидросиликата
кальция C-S-H(I).
Таким
образом, полученные результаты позволяют сделать следующие выводы:
1. Основную массу в образцах, твердевших
7 суток, представляют измененные частицы бесцветного шлакового стекла с
показателем светопреломления 1,600±0,005; размерами от 0,01 до 0,02 мм.
Изменение частиц стекла происходит с периферии. Об этом наглядно
свидетельствует изменение показателя светопреломления стекла (до 1,8).
Кроме
того, наблюдается появление гелевидного вещества, которое покрывает частицы
стекла, реже встречается в межзерновом пространстве. Это вещества является
основой цементирующей связки. Гель представляет собой полупрозрачную массу с
показателем светопреломления 1,530. Местами обнаружены кристаллики
псевдоволластонита (до 3-5%), края которых довольно сильно корродированны
(изъедены).
2. Основными новообразованиями,
возникающими при взаимодействии фосфорного шлака и
фосфорсодержащих стекол с
жидким стеклом, являются
натриево-кальциевый
гидросиликат, тоберморит состава
CS·aq и плохо закристаллизованный тоберморит- C-S-H(I).
Литература:
1 Глуховский
В.Д., Пахомов В.А. Шлакощелочные цементы и бетоны. – Киев: Будивельник, 1978. – 280 с.
2 Щелочные и щелочноземельные гидравлические вяжущие и бетоны / Под
ред. В.Д. Глуховского.- Киев, 1979.- 232 с.
3 Гейлер
Х.Ф. Гидросиликаты кальция // В кн. Химия цемента.- М.: Стройиздат, 1969. – 267
с.
4 Пужанов
Г.Т., Ни В.В. Исследование физико-химических процессов твердения
шлакосиликатного вяжущего // Химия и химическая технология : сб. МВ и ССО
КазССР, 1971.-Вып. 10. – С. 25-29.
5 Калоусек
Дж. Гидротермальная обработка бетона при высоком давлении // Пятый
международный конгресс по химии цемента.- Москва, 1973.- С. 175-181.