Харапонова Е.Б.
НИИ
Медико-биологических проблем ГУ «Днепропетровская медицинская академия МЗ
Украины» ул. Дзержинского, 9, г.
Днепропетровск, 49044, Украина
Митохондриальный аппарат предсердий крыс при
моделировании психотического эквивалента.
Активное участие митохондриального
аппарата в патологических процессах позволило выделить так называемые
«митохондриальные болезни». Характерная особенность реакции митохондриального
аппарата на различные патологические состояния заключается в том, что отдельные
митохондрии проявляют неодинаковый комплекс структурно- функциональных
перестроек, вплоть до полной
декомпенсации:
в исследовании Фролова
В.А. [1] отчетливо определены и описаны разные типы деструкции митохондрий в
составе одного сердечного миоцита.
Целью данной работы было изучение состояния митохондриального
аппарата предсердий на 7-е и 14-е сутки
формирования экспериментального психоза у крыс, вызванного подострым введением
сиднокарба.
Данную модель устойчивого патологического состояния мозга
у крыс создавали путем внутрижелудочкового сочетанного введения сиднокарба в дозе 5мг/кг и сульпирида (100мг/кг) на
протяжении 14 суток.
Изучение состояния митохондриального аппарата
предсердий при моделировании психотического состояния выявило многочисленные и
разнообразные патологические изменения на светооптическом и ультраструктурном
уровнях. Обращало на себя внимание то, что данные изменения имели четко
выраженный очаговый характер, который зависел от локализации зон ишемии. В этих
зонах наблюдались характерные патоморфологические реакции кардиомиоцитов с
многочисленными явлениями апоптотической гибели групп сократительных клеток.
Расположенные в участках ишемии кардиомиоциты, которые еще сохраняли общую
клеточную структуру, при ультраструктурном исследовании выявляли выраженные
изменения митохондриального аппарата. В частности, митохондрии всех трех типов
имели признаки вакуолизации матрикса, фрагментации митохондриальных мембран,
значительного кристолизиса (рис. 1), [2].
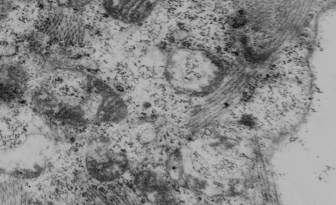
Рис.1. Признаки вакуолизации матрикса, фрагментации
митохондриальных мембран, значительного
кристолизиса митохондрий кардиомиоцита левого
предсердия
крысы на 7-е сутки формирования экспериментального психоза.
Ув.: ×22000.
Типичным было образование массивных скоплений
органелл, состоящих из опустошенных гигантских митохондрий (рис. 2). Данные
изменения, на наш взгляд, свидетельствовали о вступлении клетки в
апоптотический процесс за счет инициации апоптоза по митохондриальному механизму
[3,4].
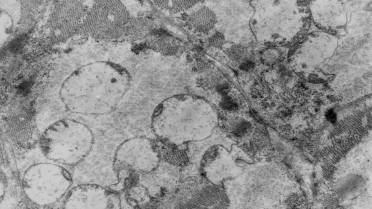
Рис. 2. Группы гигантских опустошенных митохондрий в
саркоплазме соседних кардиомиоцитов правого предсердия крысы на 14-е сутки формирования
экспериментального психоза. Ув.: ×14000.
За счет существенной деструкции утрачивалась
возможность идентифицировать митохондрии по принадлежности к определенному
типу, но надо отметить, что наибольшему ишемическому повреждению подвергались
межмиофибриллярные митохондрии. Учитывая, что в указанной внутриклеточной
локализации преобладают высокоэнергетические органеллы, можно сделать вывод,
что именно они являются наиболее уязвимыми при моделировании психотического
эквивалента.
Следует
заметить, что в участках предсердий, отдаленных от зон ишемии, на
светооптическом уровне наблюдалась сохранная тканевая структура сократительного
миокарда. Апоптотические явления не были характерны для этих участков, однако,
с помощью электронной микроскопии мы наблюдали ряд ультраструктурных изменений
в составе митохондриального аппарата на 7-е и 14-е сутки подострого действия
сиднокарба (рис. 3,4).
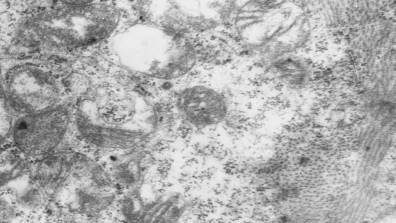
Рис. 3. Характер повреждения
межмиофибриллярных митохондрий в саркоплазме кардиомиоцита межпредсердной
перегородки крысы на 7-е сутки формирования экспериментального психоза. Ув.:
×20000.
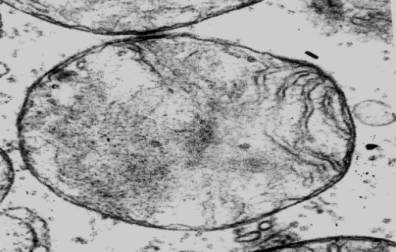
Рис. 4. Кристолизис
в составе межмиофибриллярных митохондрий в
саркоплазме кардиомиоцита левого ушка сердца крысы на
14-е сутки
формирования экспериментального психоза. Ув.:
×25000.
Таким
образом, сочетанное введение сиднокарба (5мг/кг) и сульпирида (100мг/кг) у крыс
приводит к умеренному диффузному повреждению
митохондриального аппарата во
всех участках предсердий за счет
редукции митохондрий 2-го типа и угнетения функциональной активности высокоэнергетических
органелл.
Литература
1. Фролов
В.А.. Морфология митохондрий кардиомиоцитов в норме и
патологии / В.А. Фролов, В.П. Пухлянко – М. : Изд. Универс. Дружбы Народов,
1989. – 142с.
2. Твердохлеб
И.В.. Математические аспекты анализа гетероморфии / И.В.
Твердохлеб // Вестник проблем современной медицины. – 1994. - №5. -
С.37-45.
3. Mitochondrial diseases.
Diagnostic light and electron microscopic changes
in musclebiopsies from patients with mitochondrial myopathy / S. Lindal, I. Lund, O. Bo- rud [et al.] // Tidsskr-Nor-Laegeforen.- 1991.-Vol. 111,
№2.- P.202-206.
4. Mycardiocyte
ultrastructure and morphometrical analysis in hamsters experimentally infected
with Trypanosoma cruzi / F.H. Colmanetti, V. de P. Teixeira, M.L. Rodrigues [et
al.] // Ultrastruct. Pathol.- 2005.- Vol. 29, №2.-
P. 139-147.