*111972*
Чл.-корр. РАМН Воевода М.И.,
д.м.н. Кручинина М.В., д.м.н. Курилович С.А.,
ФГБУ «НИИ терапии» СО РАМН, Новосибирск, Россия
к.х.н. Кручинин В.Н., к.т.н. Рыхлицкий С.В., к.ф.-м.н.
Володин В.А.,
Институт физики полупроводников им. А.В.
Ржанова СО РАН, Новосибирск
к.б.н. Пельтек С.Е., Кобзев В.Ф.,
Институт цитологии и генетики СО РАН,
Новосибирск, Россия
д.ф.-м.н. Князев Б.А., Герасимов В.В.
Институт ядерной физики им. Г. И. Будкера СО РАН,
Новосибирск, Россия
Новосибирский государственный университет,
Новосибирск, Россия
Диффузная патология
печени: что нового в диагностике степени фиброза?
Введение. В проблеме диффузной патологии печени по-прежнему
актуальным остается вопрос диагностики степени фиброза, так как ранние стадии
заболеваний печени обратимы [1]. Наряду
с известными методами определения степени фиброза (биохимический,
макроморфологический, полуколичественные и др.), продолжается поиск новых
способов диагностики, обладающих достаточной чувствительностью и специфичностью
[2]. Известно, что
диффузная патология печени сопровождается изменениями в составе и структуре
компонентов сыворотки крови что, в свою очередь, приводит к изменению ее
оптических характеристик [3]. В последние годы оптические методы занимают особое место в биомедицинских
исследованиях, благодаря высокой чувствительности, неразрушающему и невозмущающему характеру воздействия на
исследуемый объект [4].
Цель. Оценить возможности оптических методов исследования сыворотки крови у
пациентов с диффузной патологией печени с различной степенью фиброза для
использования в ранней диагностике.
Результаты
исследования. Обследованы: 21 мужчина
(35-60 лет) без признаков патологии внутренних органов и фиброза печени –
первая группа (F0); 57 мужчин в возрасте от 38 до 69 лет с диффузной патологией
печени, алкогольного, вирусного и смешанного генезов (37 пациентов с
легким невыраженным фиброзом – вторая
группа (F1-F2), 20 – с
выраженным фиброзом – третья группа (F3-F4)). У большинства больных выявлена умеренная степень
гистологической, биохимической активности хронического гепатита. У обследуемых
методами спектральной и сканирующей эллипсометрии, ИК-Фурье спектроскопии,
спектроскопии комбинационного рассеяния света (Raman) изучены тонкие пленки, полученные из сыворотки крови
центрифугированием.
Результаты
исследования.
Эллипсометрическое
исследование позволило установить факт достоверного увеличения показателя
преломления в сочетании со снижением толщины пленки по мере нарастания фиброза
(p<0,001-0,002) (см. рис.1).
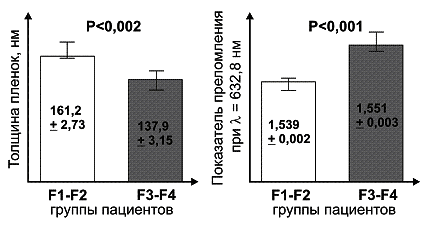
Рисунок 1.
Эллипсометрические показатели у пациентов с различной степенью фиброза
печени.
Подобные изменения толщины могут
быть связаны со снижением синтеза целого ряда соединений в печени, в том числе,
белков сыворотки крови, факторов свертывания, холестерина, триглицеридов
(корреляции соответственно общего белка r=0,57, p<0,02;
общего холестерина r=0,56, p<0,001; триглицеридов r=0,44, p<0,01) при
выраженном фиброзе. Преобладание неравномерных пленок при выраженном фиброзе,
очевидно, связано с выраженностью биохимического дисбаланса в сыворотке крови
при циррозе печени. Показатель преломления определяется в большей степени
компонентами синдромов цитолиза (для АЛТ r=0,46, p<0,03; для
АСТ r=0,41, p<0,05) и
холестаза (для общего билирубина r=0,52, p<0,01; для ГГТП r=0,48, p<0,033),
степень их выраженности усиливается при выраженном фиброзе [2].
Исследование пленок с помощью сканирующего
эллипсометра высокого разрешения «Микроскан»
показало, что пленки больного с фиброзом печени F3-F4 очень
неравномерны по толщине, имеют большие разрывы по сравнению с таковыми у
пациентов с F1-F2 (p<0,05) (рис.
2).
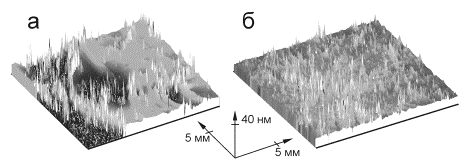
Рисунок
2. Трехмерное распределение толщин пленок по поверхности пластин, у пациентов с
тяжелым F3-F4 (а) и легким F1-F2 (б)
фиброзом печени.
В ИК-спектрах у
пациентов с выраженным фиброзом печени F3-F4 достоверно
выше, чем у пациентов с F1-F2, оказались пики амид III – при 1280 см-1 и пик при 3190 см-1,
отражающий N-H структуры, что
указывает на более высокую концентрацию белковых молекул со вторичной структурой
в виде спирали (a-helix) (р<0,001-0,05) (рис. 3).
Напротив, у пациентов
со степенью фиброза F3-F4 достоверно ниже, чем в группе F1-F2, были пики
при 776, 818, 889 см-1 и 966 см-1, характерные для
валентных колебаний связей С-С, С-О дезоксирибоз и фрагмента PO4- молекул нуклеиновых кислот и протеинов
(р<0,02-0,05). Достоверное снижение при выраженном фиброзе продемонстрировал
также ряд пиков при 1399 см-1, отражающий симметричные валентные
колебания групп CH3 скелетных фрагментов молекул белков; при 1450 см-1,
отражающий деформационные колебания групп CH3 липидов
и белков; при 1570 см-1 (амид II); 1581, 1620 см-1 (карбонильные структуры)
(р<0,01-0,05). Значимое снижение компоненты при 1635 см-1, выявляющейся
при разложении сложных амидных пиков, у пациентов с фиброзом печени F3-F4 связывают со
снижением количества белковых молекул со структурой в виде складчатого листа (b-sheet)
(р<0,05).
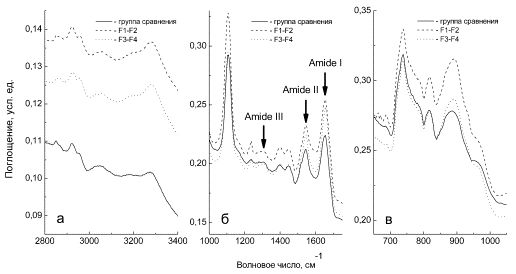
Рисунок
3. ИК-спектры пленок сывороток крови пациентов в обследуемых группах.
В спектрах
комбинационного рассеяния света образцов жидких сывороток крови в области
750-1750 см-1 наблюдаются три характерных пика поглощения: при 1005,
1157 и 1520 см-1, интенсивности которых оказались достоверно ниже
при наличии фиброза F3-F4 по сравнению с F1-F2
(р<0,0058-0,02). Можно предположить, что снижение площадей вышеуказанных
пиков при выраженном фиброзе связано со значительными сдвигами в обмене
каротинов, переходе их в витамин А, что тесно связано с состоянием функции
печени [1, 2].
Интересный экспериментальный факт, наблюдаемый в
данной работе, связан с воздействием на сыворотки крови пациентов с разной
степенью фиброза лазерным пучком при записи спектров Раман. У обследуемых с
легким фиброзом или отсутствием такового поверхность сывороток была
неоднородной, в оптический микроскоп наблюдались отдельные резко очерченные
области размером менее 0,5 мкм.
Под действием лазерного
излучения происходило слияние и укрупнение областей до 10 и более мкм (рис. 4
а, б). В случаях выраженного фиброза наблюдаемые области оставались практически
неизменными (рис. 4 в, г). При локальном нагреве лазерным лучом сыворотки крови
возможны изменения, связанные с конформационными изменениями, при более
выраженных воздействиях - с денатурацией белковых молекул сыворотки крови с
объединением продуктов распада в более крупные области, слияние липопротеидов
под действием температуры в укрупненные кластеры.

Рисунок
4. Оптическая микроскопия поверхности жидких сывороток крови пациентов с легким
фиброзом (F1-F2) (а, б) и тяжелым фиброзом (F3-F4) (в, г) до
(а, в) и после (б, г) воздействия Ar+
лазерного пучка (514,5 нм, 2-3 мВт, 3 мин).
Таким
образом, выявленные новые возможности оптических методов являются весьма
перспективными в скрининговом неинвазивном
определении стадий заболевания при диффузной патологии печени различного
генеза, определении степени фиброза, в том числе, на ранних стадиях развития.
Работа
выполнена при частичной финансовой поддержке Минобрнауки РФ (ГК
№02.740.11.0556), гранта РФФИ 11-02-12171-офи-м при использовании
оборудования ЦКП СЦСТИ в рамках ГК № 16.552.11.7044 и при
использовании оборудования научно-образовательного комплекса НГУ «Наносистемы и
современные материалы».
Литература:
1.
Гастроэнтерология.
Национальное руководство // Под ред. Ивашкина В. Т., Лапиной Т. Л. - М.: изд. группа «ГЭОТАР-Медиа». - 2008. - 700 с.
2.
Подымова С. Д. Болезни
печени. - М.: Медицина. - 1993. - 544 c.
3. Markowitz S.D., Bertagnolli M.M. Molecular origins of cancer: molecular
basis of colorectal cancer // N. Engl.
J. Med. 2009. V.361.
P.2449–60.
4. Arwin H. Ellipsometry on thin organic layers of
biological interest: characterization and applications // Thin Solid Films.
2000. V.377-378. P.48-56.