Лобищева Анна Володимирівна2, Сирчін Сергій
Олександрович1, Омельчук Євген Олександрович2
1Інститут мікробіології і
вірусології ім. Д.К. Заболотного НАН України, м. Київ, Україна
2Національний університет
харчових технологій, м. Київ, Україна
ДОСЛІДЖЕННЯ
СИНТЕЗУ ЦЕЛЮЛАЗ Corynascus
sepedonium 1898 при
твердофазному культивуванні при використанні різних целюлозовмісних середовищ
Було проведено
дослідження здатності термофільного мікроміцета Corynascus sepedonium 1898, що здатен активно продукувати целюлолітичні ферменти, до росту на різних
поживних середовищах при твердофазній ферментації.
Матеріали і методи.
Об'єктом дослідження був термофільний мікроміцет C.sepedonium 1898, здатний до утворення позаклітинних ферментів целюлолітичного комплексу.
Культивування
мікроміцета здійснювали поверхневим способом (твердофазне культивування) на таких
середовищах:
1. Солома пшенична – 6,6 г/л, NaNO3 – 2 г/л, KH2PO4 – 1 г/л, KCl – 0,5 г/л, MgSO4 – 0,5 г/л, FeSO4 – 0,01 г/л.
2. Солома пшенична – 5,3 г/л, листя кукурудзи – 1,3 г/л, NaNO3 – 2 г/л, KH2PO4 – 1 г/л, KCl –
0,5 г/л, MgSO4 – 0,5 г/л, FeSO4 – 0,01 г/л.
3. Солома пшенична – 5,3 г/л, листя
збірне – 1,3 г/л, NaNO3 – 2 г/л, KH2PO4 – 1 г/л, KCl – 0,5 г/л, MgSO4 – 0,5 г/л, FeSO4 – 0,01 г/л.
4. Солома пшенична – 5,3 г/л, листя соняшника – 1,3 г/л, NaNO3 – 2 г/л, KH2PO4 – 1 г/л, KCl –
0,5 г/л, MgSO4 – 0,5 г/л, FeSO4 – 0,01 г/л.
5. Солома пшенична – 5,3 г/л,
буряковий жом – 1,3 г/л, NaNO3 – 2 г/л, KH2PO4 – 1 г/л, KCl –
0,5 г/л, MgSO4 – 0,5 г/л, FeSO4 – 0,01 г/л.
6. Солома пшенична – 5,3 г/л, початки
кукурудзяні – 1,3 г/л, NaNO3 – 2 г/л, KH2PO4 – 1 г/л, KCl – 0,5 г/л, MgSO4 – 0,5 г/л, FeSO4 – 0,01 г/л.
Культивування
здійснювалося при температурі 42 ˚С протягом 6 діб. Відбір культуральної
рідини проводили на 6-й день культивування.
Ендоглюканазну
активність визначали за методом, що базується на визначенні кількості цукрів
(глюкози) при взаємодії ендоглюканази з натрієвою сіллю карбоксиметилцелюлози (0,5%
розчину Na-КМЦ) при температурі 50 ˚С після 30 хв інкубування з 0,5 мл
культуральної рідини. Активність обчислювали за методом [1;2].
Екзоглюканазну
активність визначали за гідролізом фільтрувального паперу (FPU активність). Кількість редукуючи цукрі, за якими
визначали екзоглюканазну активність, визначали методом з ДНС реактивом після
інкубації 1 мл культуральної рідини і 1 мл 0,05М цитратного буфера (рН 4,5) з
фільтрувальним папером (1х6 см) при температурі 50 ˚С протягом 1 год. [1;3].
Вміст білка в
культуральній рідині визначали за методом Бредфорда.
Результати та обговорення. Було
досліджено здатність штаму C.sepedonium 1898 до росту на поживних середовищах, що містять окрім пшеничної соломи інші
джерела вуглецю, в умовах твердофазного культивування.
Найвищий рівень
ендоглюканазної активності ми бачимо при рості мікроміцета на середовищі,що
містить буряковий жом в якості додаткового джерела вуглецю (Рис.1).
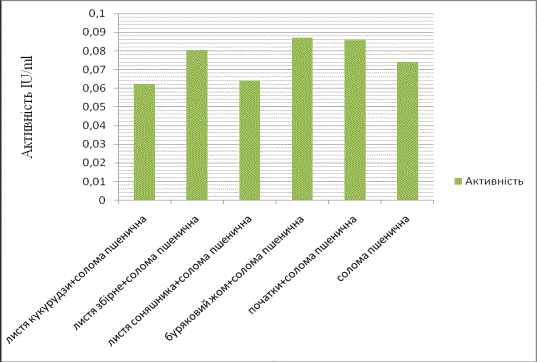
Рис.1. Зміна
ендоглюконазної активності при рості C.sepedonium 1898 на поживних середовищах з різним джерелом вуглецю.
Найвищий рівень екоглюканазної
активності ми бачимо також при рості мікроміцета на середовищі,що містить
буряковий жом в якості додаткового джерела вуглецю (Рис.2)
Слід звернути увагу
на те, що за даними проведеного дослідження при додаванні певних додаткових
джерел вуглецю активність целюлолітичних ферментів нижча, ніж без даних
речовин.
Було встановлено, що
листя соняшника містять речовини, що є інгібіторами утворення ендоглюканаз, кукурудзяні початки містять
речовини, що є інгібіторами утворення
ендоглюканаз. Також встановлено, що
листя кукурудзи містить речовини, що призводять до інгібування синтезу целюлоз,
а саме ендо- та екзоглюканаз.
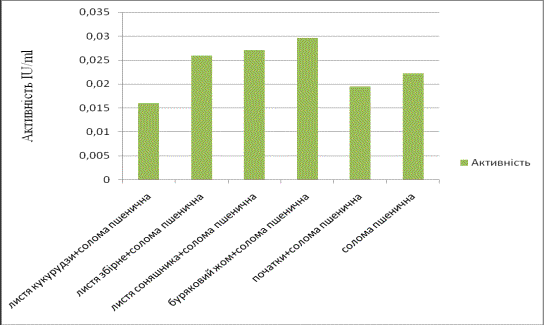
Рис.2. Зміна
екоглюконазної активності при рості C.sepedonium 1898 на поживних середовищах з різним джерелом вуглецю.
Список використаної літератури
1. Ghose T.K. Measurement of Cellulase Activities // Pure & Appl. Chem. – 1987. –
59, N 2. – P. 257 - 268.
2. Zhang Y.H.P., et al. Cellulase Assays // in: Mielenz (ed.), Biofuels: Methods and
Protocols, Methods in Molecular Biology, 2009. – V. 581. – Р. 213–231.
3. Mehdi Dashtban, Miranda
Maki. Cellulase activities in
biomass conversion: measurement methods and comparison// Critical Reviews in Biotechnology –
2010. – N 8. –P. 3-10.