Лобищева Анна Володимирівна2, Сирчін Сергій
Олександрович1, Омельчук Євген Олександрович2
1Інститут мікробіології і
вірусології ім. Д.К. Заболотного НАН України, м. Київ, Україна
2Національний університет
харчових технологій, м. Київ, Україна
ДОСЛІДЖЕННЯ
СИНТЕЗУ ЦЕЛЮЛАЗ МІКРОМІЦЕТОМ Corynascus sepedonium 1898
Було проведено
дослідження мікроскопічних грибів виду Corynascus sepedonium, що здатні активно продукувати
целюлолітичні ферменти при високих температурах, що після відповідної очистки
можуть використовуватися в якості кормових добавок для тварин. У результаті
проведення дослідів було відібрано ряд активних штамів. Для проведення
подальших досліджень було відібрано найбільш активний термофільний штам Corynascus sepedonium 1898.
Матеріали і методи.
Об'єктом дослідження був термофільний мікроміцет C.sepedonium 1898, здатний до утворення позаклітинних ферментів целюлолітичного комплексу.
Культивування
мікроміцета здійснювали поверхневим способом (твердофазне культивування) на
середовищі, що містить пшеничну солому в якості єдиного джерела вуглецю в
кількості 6,6 г/л, а також модифіковане середовище Чапека–Підоплічко (г/л): NaNO3 – 2, KH2PO4 – 1, KCl –
0,5, MgSO4 – 0,5, FeSO4 – 0,01; при температурі 42 ˚С протягом 8 діб. Відбір культуральної
рідини проводили щодня.
Ендоглюканазну
активність визначали за методом, що базується на визначенні кількості цукрів
(глюкози) при взаємодії ендоглюканази з натрієвою сіллю карбоксиметилцелюлози
(0,5% розчину Na-КМЦ) при температурі 50 ˚С після 30 хв інкубування з 0,5
мл культуральної рідини. Активність обчислювали за методом [1;2].
Екзоглюканазну
активність визначали за гідролізом фільтрувального паперу (FPU активність). Кількість редукуючи цукрі, за якими
визначали екзоглюканазну активність, визначали методом з ДНС реактивом після
інкубації 1 мл культуральної рідини і 1 мл 0,05М цитратного буфера (рН 4,5) з
фільтрувальним папером (1х6 см) при температурі 50 ˚С протягом 1 год.
[1;3].
Вміст білка в
культуральній рідині визначали за методом Бредфорда .
Результати та обговорення. Було
досліджено здатність штаму C.sepedonium 1898 до росту на поживному середовищі, що містить пшеничну солому в якості
єдиного джерела вуглецевого живлення і продукуванню на ньому ферментів
целюлазного комплексу, а саме ендо- та екзоглюканаз, в умовах твердофазного
культивування. При цьому спостерігалася тривала фаза адаптації, що становила
близько 2-х діб, та характеризувалася низькою швидкістю росту та целюлолітичною
активністю. Після фази адаптації спостерігається індукція синтезу позаклітинних
целюлаз. Процес культивування завершувався на 7 добу культивування, так як при
наступних пробах целюлолітична активність почала падати. При цьому
спостерігалась динаміка росту культури, ступінь деструкції целюлозовмісної
речовини під дією ферменту, збільшення екзо- та ендоглюканазної активності та
накопичення білка в середовищі.
Як видно з графіку
(Рис.1) екзоглюканазна активність мала
виражений характер на 6-ту добу культивування.
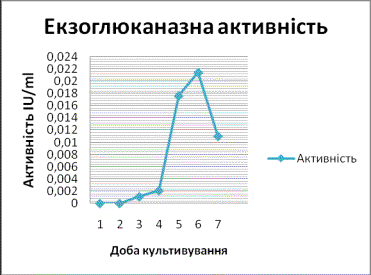
Рис.1. Динаміка екзоглюконазної
активності при рості C.sepedonium 1898 на поживному
середовищі з пшеничною соломою.
Ендоглюканазна активність також мала
яскраво виражену активність на 6 добу
культивування гриба (Рис.
2).
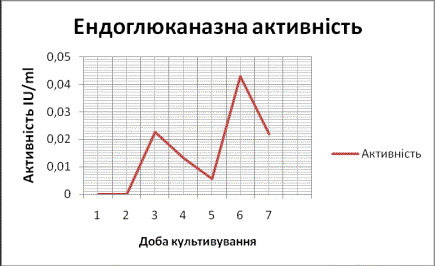
Рис.2. Зміна
ендоглюканазної активності при культивуванні C.sepedonium 1898 на поживному середовищі з пшеничною соломою.
Таким чином, було
встановлено, що індукція синтезу компонентів целюлазного комплексу штамом C.sepedonium 1898 при рості на поживному середовищі з пшеничною соломою при твердо фазному
культивуванні найкраще проходить на шостий день культивування, так як в цьому
випадку отримується найбільша кількість ферменту з високою активністю. Також
визначено, що індукція синтезу C.sepedonium 1898 целюлолітичних ферментів при поверхневому культивуванні на пшеничній соломі
дає приблизно однакову динаміку росту активності з максимумом на 6-ту добу.
Список використаної
літератури
1. Ghose T.K. Measurement of Cellulase Activities // Pure & Appl. Chem. – 1987. –
59, N 2. – P. 257 - 268.
2. Zhang Y.H.P., et al. Cellulase Assays // in: Mielenz (ed.), Biofuels: Methods and
Protocols, Methods in Molecular Biology, 2009. – V. 581. – Р. 213–231.
3. Mehdi Dashtban, Miranda
Maki. Cellulase activities in
biomass conversion: measurement methods and comparison// Critical Reviews in Biotechnology –
2010. – N 8. –P. 3-10.