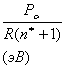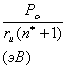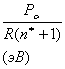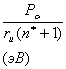УДК 536.7-631.152
Г.А.
Кораблев*, Р.Г. Кораблев*, В.И. Кодолов**, Н.Г. Петрова***, Г.Е. Заиков****,
А.К.
Осипов*
* Ижевская Государственная
Сельскохозяйственная Академия.
** Ижевский Государственный
Технический Университет.
*** Министерство Информатизации и
связи УР.
**** Институт биохимической физики
РАН.
энтропийная НОМОГРАММА
Аналогично представлениям термодинамики о статистической энтропии
использовано понятие энтропии пространственно-энергетических взаимодействий.
Получена номограмма для оценки энтропии различных процессов.
Обсуждается
многоплановость проявлений энтропии, в том числе – в биохимических процессах и
в экономике.
Ключевые слова: энтропия,
номограмма, пространственно-энергетический параметр, карбонизация, диффузия,
бизнес.
1.
Введение
Понятие энтропии возникло на основе второго закона термодинамики и
представлений о приведенном количестве теплоты.
В статистической термодинамике энтропия изолированной и находящейся в
равновесии системы равна логарифму вероятности нахождения ее в определенном
макросостоянии:
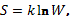 (1)
(1)
где W – число доступных состояний
системы или степень вырождения микросостояний; k – постоянная Больцмана.
Или:
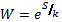 (2)
(2)
Эти соотношения являются общими утверждениями, имеющими макроскопический
характер, не содержат никаких ссылок на элементы структур рассматриваемых
систем и полностью не зависят от микроскопических моделей [1].
Поэтому применение и рассмотрение этих законов может иметь большое число
следствий, которые наиболее плодотворно используются статистической
термодинамикой.
Смысл второго закона термодинамики сводится к следующему:
Природа стремится от состояний менее вероятных к состояниям более
вероятным. Так наиболее вероятным является равномерное распределение молекул по
всему объему. С макрофизической точки зрения эти процессы заключаются в
выравнивании плотности, температуры, давления и химических потенциалов, а
основной характеристикой процесса является термодинамическая вероятность – W.
В реальных процессах в изолированной системе рост энтропии неизбежен – в
системе нарастает беспорядок, хаос, идет понижение качества внутренней энергии.
Термодинамическая вероятность равна числу микросостояний, отвечающих
данному макросостоянию.
Поскольку степень вырождения системы никак не связана с физическими
особенностями систем, статистическое понятие энтропии может иметь и другие применения и проявления (кроме
статистической термодинамики).
«Ясно, что из двух совершенно разных по своему физическому содержанию
систем энтропия может быть одинаковой, если у них число возможных
микросостояний, отвечающих одному макропараметру (неважно, какой это параметр)
совпадают. Именно поэтому понятие энтропии можно использовать в самых
разнообразных областях. Возрастающая самоорганизация человеческого общества …
приводит к возрастанию энтропии и беспорядка в окружающей среде, что выражается
в частности к появлению громадного числа рассеянных по Земле свалок» [2].
В данном исследовании делается попытка применения понятия энтропии к
оценке степени пространственно-энергетических взаимодействий с использованием их
графической зависимости и в других областях.
2.
Энтропийная
номограмма степени пространственно-энергетических взаимодействий
На основе модифицированного уравнения Лагранжа для относительного
движения двух взаимодействующих материальных точек было введено представление о
пространственно энергетическом параметре (Р-параметре), который является
комплексной характеристикой важнейших атомных величин, ответственной за
межатомные взаимодействия и имеющий прямую связь с электронной плотностью в
атоме [3].
В качестве основной количественной характеристики структурных
взаимодействий в конденсированных средах использовалась величина относительной
разности Р–параметров взаимодействующих атомов-компонентов – коэффициент α
структурного взаимодействия:
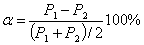 (3)
(3)
Рис. 1
Номограмма
зависимости степени структурных взаимодействий (ρ) от коэффициента
α
|
|
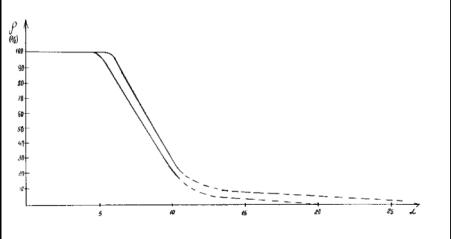 Применяя
надёжные экспериментальные данные, была получена номограмма зависимости степени
структурных взаимодействий (
Применяя
надёжные экспериментальные данные, была получена номограмма зависимости степени
структурных взаимодействий ( ) от коэффициента α,
единая для широкого класса структур. Данный подход дал возможность оценить
степень и направление структурных взаимодействий процессов фазообразования,
изоморфизма и растворимости в многочисленных системах, в том числе в
молекулярных.
) от коэффициента α,
единая для широкого класса структур. Данный подход дал возможность оценить
степень и направление структурных взаимодействий процессов фазообразования,
изоморфизма и растворимости в многочисленных системах, в том числе в
молекулярных.
Такая номограмма может быть представлена [3] и в виде логарифмической
зависимости:
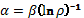 , (4)
, (4)
где коэффициент
β – постоянная величина для данного класса структур. От среднего значения
величина β структурно может изменяться в основном только в пределах ± 5%.
Таким образом, величина α обратно пропорциональна логарифму степени
структурных взаимодействий и поэтому может характеризоваться как энтропия
пространственно-энергетических взаимодействий атомно-молекулярных структур.
Действительно, чем больше ρ, тем более вероятно образование
стабильных упорядоченных структур (например, образование твердых растворов), то
есть тем меньше энтропия процесса. Но тем меньше и коэффициент α.
Уравнение (4) не имеет полной аналогии с уравнением (1) Больцмана, так
как в данном случае сравниваются не абсолютные, а только относительные значения
соответствующих характеристик взаимодействующих структур, которые могут
выражаться в процентах. И это касается не только коэффициента α, но и
сравнительной оценки степени структурных взаимодействий (ρ), например –
процент содержания атомов данного элемента в твердом растворе относительно общего
числа атомов.
Поэтому в уравнении (4) коэффициент k = 1.
Вывод: относительная разность пространственно-энергетических параметров
взаимодействующих структур может быть количественной характеристикой энтропии
взаимодействия: 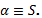
3.
Энтропийная
номограмма поверхностно-диффузионных процессов
В качестве примера, рассмотрим
процесс карбонизации и формирования наноструктур при взаимодействиях в гелях
поливинилового спирта и металлической фазы в виде оксидов или хлоридов меди. На первом этапе образуются малые кластеры неорганической фазы,
окруженные углеродосодержащей фазой. В этот период основной характер
атомно-молекулярных взаимодействий должен оцениваться через относительную
разность P-параметров, рассчитанных через радиусы ионов меди и
ковалентные радиусы атомов углерода, приведенные в таблице 1.
Из таблицы 1 видно, что в этом
случае коэффициент α = 3,50 что соответствует полному структурному
взаимодействию: 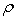 = 100%. При этом процесс происходит только в объеме геля, а
не на поверхности несформировавшейся пока пленки.
= 100%. При этом процесс происходит только в объеме геля, а
не на поверхности несформировавшейся пока пленки.
В следующем основном периоде
карбонизации идет образование металлической фазы непосредственно на поверхности
образующихся полимерных структур по реакции:
2CuCl + [-СH=CH-]n → 2Cu + 2HCl + [С 2]n
С этого времени начинается
процесс формирования бинарной матрицы наносистемы С→Сu. Рассмотрим ход
нарастания пленочной матрицы углеродов в меди в модели поверхностной диффузии.
В этот период образования металлической фазы валентно активными являются P-параметры, рассчитанные через радиусы атомов.
В жидкости радиус сферы молекулярного
взаимодействия R≈3r,
где r – радиус молекулы. Жидкости образуются главным образом
элементами первого и второго периодов системы. Для второго периода можно
записать: R≈3r=(n+1)r, где n
– главное квантовое число. Для обоих периодов (первого и второго) получаем R=(<n>+1)r≈2,5r.
Предположим, что этот принцип с определенным
приближением можно распространить на различные элементы всех остальных
периодов, но с учетом экранирующих эффектов, вводя вместо n величину эффективного главного квантового числа (n*). Эти значения n* и n*+1 взятые по
Слэтеру [4], представлены в таблице 2.
Итак, предполагаем, что радиус сферы
атомно-молекулярного взаимодействия при диффузии частиц определяется так:
R = (n*+1)r, (5)
где r – размерная характеристика атомной
структуры. Общее изменение R составляет от 3r до 5,2r (со второго по
шестой периоды).
Усредненное значение структурного Рс-параметра,
приходящегося на единицу радиуса атомно-молекулярного взаимодействия,
определяется по уравнению:
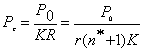 (6)
(6)
где K
- коэффициент, учитывающий относительное число взаимодействующих частиц и
равный (как показали расчеты):
K = 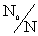 (7)
(7)
Здесь N0 – число частиц в объеме сферы радиуса R,
N – число частиц или реализованных взаимодействий в
зависимости от вида процесса (внутренней или поверхностной диффузии).
Внутри
жидкости, ниже верхнего слоя толщиной 2R
равнодействующая сил молекулярного взаимодействия равна нулю (рис. 2).
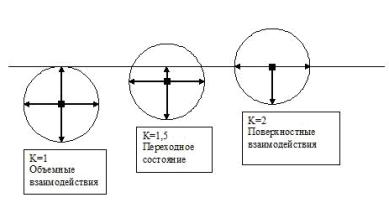
Рис. 2
Относительное число взаимодействующих частиц
Применяя исходную аналогию к внутренней
диффузии можно считать, что такое равновесное состояние соответствует равенству
N0=N и тогда K=1.
На верхней части поверхностного слоя жидкости
объем сферы атомно-молекулярного взаимодействия и число частиц в ней
практически в 2 раза меньше по сравнению с внутренними слоями ниже 2R, то есть 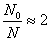 и K=2 – для поверхностной диффузии (рис. 2).
и K=2 – для поверхностной диффузии (рис. 2).
Практически поверхностная диффузия идет при
изменении коэффициента «K» в пределах от 1,5 до 2,0, что учтено
в расчетах. На основе таких исходных положений был проведен расчет величины
Р-параметра и коэффициента 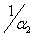 по
уравнениям (3,6,7) для атома углерода и меди (табл.1).
по
уравнениям (3,6,7) для атома углерода и меди (табл.1).
Таблица 2
Эффективное
главное квантовое число
|
n
|
1
|
2
|
3
|
4
|
5
|
6
|
|
n*
|
1
|
2
|
3
|
3,7
|
4
|
4,2
|
|
n*+1
|
2
|
3
|
4
|
4,7
|
5
|
5,2
|
Были вычислены значения степени структурных взаимодействий
от коэффициента 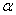 ,
то есть
,
то есть 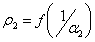 - кривая 2,
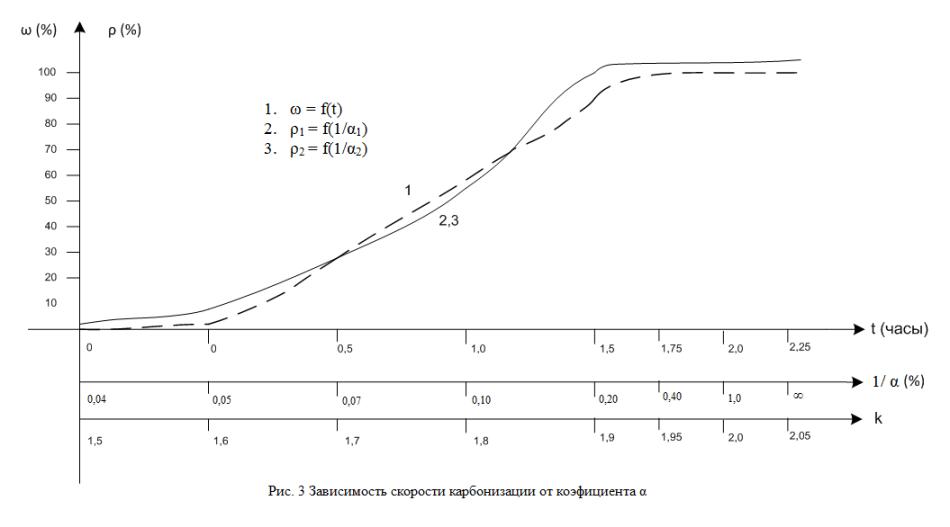
представленная на рис. 3. Здесь приведена так же графическая зависимость
степени образования нанопленок (ω) от времени процесса по данным [5] –
кривая №1 и ранее полученная номограмма энтропии в виде ρ1 = f(
- кривая 2,
представленная на рис. 3. Здесь приведена так же графическая зависимость
степени образования нанопленок (ω) от времени процесса по данным [5] –
кривая №1 и ранее полученная номограмма энтропии в виде ρ1 = f(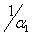 ) - кривая 3.
) - кривая 3.
Анализ всех полученных графических зависимостей
показывает почти полное графическое совпадение всех трех графиков: ω = f(t), ρ1 = f(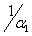 ), ρ2 = f(
), ρ2 = f(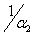 ) c небольшими отклонениями в начале и в
конце процесса. Таким образом, скорость карбонизации, как и функции многих
других физико-химических структурных взаимодействий, могут непосредственно
оцениваться через значения рассчитанных величин коэффициента α и
энтропийную номограмму.
) c небольшими отклонениями в начале и в
конце процесса. Таким образом, скорость карбонизации, как и функции многих
других физико-химических структурных взаимодействий, могут непосредственно
оцениваться через значения рассчитанных величин коэффициента α и
энтропийную номограмму.
4. Номограммы
биофизических процессов
1) О кинетике
ферментативных процессов
«Необходимым этапом ферментативного катализа является образование
фермент-субстратного комплекса … При этом, к молекуле фермента может
присоединиться n молекул
субстрата» [6, стр. 58].
Для ферментов со стехиометрическим коэффициентом n, отличным от единицы вид графической
зависимости скорости наработки продукта реакции (μ) в зависимости от
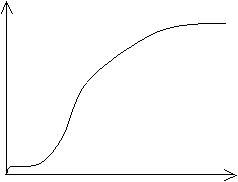
концентрации субстрата (с) имеет [6] сигмоидный характер с характерной точкой
перегиба (рис. 4)
 0μ
0μ
с
Рис. 4 –
Зависимость скорости ферментативной реакции (μ) от концентрации субстрата
(с)
Из рисунка 4 видно, что эта кривая повторяет в целом характер
энтропийной номограммы на рис. 3.
Аналогичный вид имеет график зависимости скорости электронного
транспорта в биоструктурах от времени диффузии ионов [6, стр. 278].
И в методике оценки ферментативных взаимодействий (аналогично
ранее использованной в 3 параграфе методике для поверхностно-диффузионных
процессов) применяется эффективное число взаимодействующих молекул, которое
больше 1.
В методологии Р-параметра фермент имеет ограниченное изоморфное
сходство с молекулами субстрата и не образуют с ним стабильного соединения, но
при этом возможна такая ограниченная перестройка химических связей, которая
будет «настроена» на получение конечного продукта.
2) Зависимость
биофизических критериев от их частотных характеристик
а)
Прохождение переменного тока через живые ткани характеризуется дисперсионной
кривой электропроводности – это графическая зависимость полного сопротивления
ткани (z-импеданс) от логарифма частоты
переменного тока (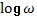 ). В норме такая кривая, на
которой по оси ординат откладывается импеданс, а по оси абсцисс -
). В норме такая кривая, на
которой по оси ординат откладывается импеданс, а по оси абсцисс - 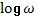 , формально полностью
соответствует энтропийной номограмме (рис. 1).
, формально полностью
соответствует энтропийной номограмме (рис. 1).
б)
Флуктуации проводимости биомембран (обусловленные случайными процессами) «имеют
вид кривой Лоренца» [7, стр. 99]. В этом графике спектральная плотность
флуктуаций (ρ) откладывается на оси ординат, а функция логарифма частоты (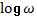 ) – на оси абсцисс.
) – на оси абсцисс.
Вид
такой кривой так же соответствует энтропийной номограмме на рисунке 1.
5. Кривая Лоренца пространственно-временной зависимости
Интервалы между событиями в различных системах координат
определяются лоренцовой геометрией пространства времени. В этой геометрии
скорость (β) сама по себе не аддитивна, поэтому вводится понятие параметра
скорости (θ). Связь между скоростью β и параметром скорости простая: 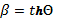 , где величина
, где величина 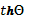 означает «тангенс гиперболический» и закон сложения двух скоростей
имеет вид:
означает «тангенс гиперболический» и закон сложения двух скоростей
имеет вид:
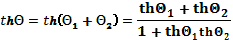
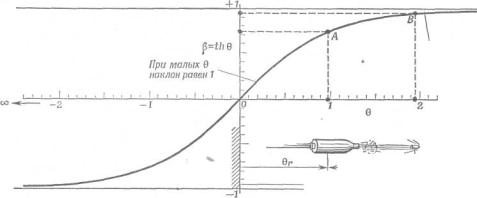
Зависимость между параметром скорости и самой скоростью
отображается [8] кривой Лоренца на рис. 5. Обе величины используются в
относительных единицах по отношению к скорости света. Вид кривой формально
полностью соответствует энтропийной номограмме на рис. 3.
Пример: «Пусть пуля выпускается со скоростью β' = 0,75 из
ракеты, движущейся со скоростью 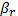 = 0,75. Требуется найти скорость пули β относительно
лабораторной системы. Мы знаем, что аддитивны не скорости, а параметры
скорости. По графику для точки А находим θ' =
= 0,75. Требуется найти скорость пули β относительно
лабораторной системы. Мы знаем, что аддитивны не скорости, а параметры
скорости. По графику для точки А находим θ' = 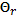 = 0,973. Сложение дает θ = θ' + θr = 1,946. Для
этого значения параметра скорости находим по графику точку В и величину
скорости β = 0,96» [8].
= 0,973. Сложение дает θ = θ' + θr = 1,946. Для
этого значения параметра скорости находим по графику точку В и величину
скорости β = 0,96» [8].
Рис. 5 –
Связь между параметром скорости θ и самой скоростью 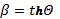 , получаемая непосредственно из закона сложения
, получаемая непосредственно из закона сложения
6.
Энтропийные критерии в бизнесе и в природе
Основные свойства системы свободного рынка, обеспечивающие ее
экономические преимущества это: 1) эффективная конкуренция и 2) максимальная
личная заинтересованность каждого сотрудника.
Но на различных уровнях концентрации экономики эти первопричинные
особенности функционируют и проявляют себя по-разному. Наибольшая их
эффективность соответствует малому бизнесу, когда число членов организации
минимально, более четкая личная заинтересованность и активная конкурентная
борьба за выживание. По мере укрупнения предприятий и производств, с
увеличением численности персонала роль каждого из них постепенно снижается,
уменьшается конкурентная борьба, так как появляются новые возможности для
согласованных действий разных бизнес-структур. Идет снижение качества
экономических отношений в бизнесе, т.е. возрастание энтропии. Более всего такой
процесс характерен в моноструктурах на крупнейших предприятиях большого бизнеса
(синдикаты и картели).
Понятие термодинамической вероятности как числа микросостояний,
отвечающих данному макросостоянию можно модифицировать применительно к
процессам экономических взаимоотношений, которые напрямую зависят от параметров
бизнес-структур.
За макросостояние системы можно принять данную отдельную
бизнес-структуру, а за число микросостояний – число ее сотрудников (N), которое
есть число доступных наиболее вероятных состояний данной бизнес-структуры.
Таким образом, предполагается, что такое число сотрудников бизнес-структуры
является аналогом термодинамической вероятности применительно к процессам
экономических взаимоотношений в бизнесе.
Поэтому можно принять, что общая энтропия качества бизнеса состоит из
двух энтропий, характеризующих: 1) уменьшение эффективности конкуренции (S1)
и
2) уменьшение
личной заинтересованности каждого сотрудника (S2), то есть: 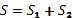 . Величина S1
пропорциональна числу работников предприятия:
. Величина S1
пропорциональна числу работников предприятия: 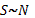 , а величина S2 имеет сложную зависимость
не только от числа работников предприятия, но и от эффективности самого
управления им. Она обратно пропорциональна персональной заинтересованности
каждого сотрудника. Поэтому можно принять, что
, а величина S2 имеет сложную зависимость
не только от числа работников предприятия, но и от эффективности самого
управления им. Она обратно пропорциональна персональной заинтересованности
каждого сотрудника. Поэтому можно принять, что 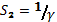 , где
, где 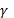 – коэффициент личной заинтересованности каждого сотрудника.
– коэффициент личной заинтересованности каждого сотрудника.
По аналогии с уравнением Больцмана (1) получаем:
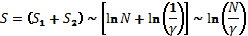
или 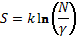 ,
,
где k – коэффициент пропорциональности;
Здесь N
показывает во сколько раз данная бизнес-структура больше эталонной структуры
малого бизнеса, при которой N
= 1, то есть эта величина не имеет наименования.
Для нетермодинамических систем принимаем k = 1. Поэтому:
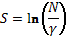 (8)
(8)
В табл. 3 приведены примерные расчеты бизнес-энтропии по уравнению (8)
для трех основных уровней бизнеса: малого, среднего и крупного. При этом
предполагалось, что число N соответствует некоторому среднему значению из
наиболее вероятных величин.
При расчете коэффициента личной заинтересованности 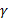 учитывалось, что он может меняться от 1 (один сотрудник работает
только сам на себя) до ноля (0), если такой работник как бесправный раб, и для
наиболее крупных предприятий принималось
учитывалось, что он может меняться от 1 (один сотрудник работает
только сам на себя) до ноля (0), если такой работник как бесправный раб, и для
наиболее крупных предприятий принималось 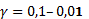 .
.
Несмотря на вполне приближенную точность таких усредненных расчетов,
можно сделать достаточно достоверный вывод о том, что энтропия бизнеса с
укрупнением его структур резко возрастает при переходе именно от среднего к
крупному бизнесу, так как снижается качество бизнес-процессов.
Таблица 3
Рост энтропии по мере укрупнения бизнеса
|
Параметры структур
|
Бизнес
|
|
Малый
|
Средний
|
Крупный
|
|
N1 – N2
|
10 – 50
|
100 – 1000
|
10000 – 100000
|
|
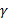
|
0,9 – 0,8
|
0,6 – 0,4
|
0,1 – 0,01
|
|
S
|
2,408 – 4,135
|
5,116 – 7,824
|
11,513 – 16,118
|
|
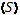
|
3,271
|
6,470
|
13,816
|
В живых системах нарастание энтропии компенсируется через отрицательную
энтропию (негоэнтропию), которая формируется через взаимодействие с внешней
средой. То есть живая система – это открытая система. И бизнес не может
длительное время быть изолированной системой, без процесса обмена и
взаимоотношений с внешней средой. Роль внешней системы, уменьшающей возрастание
бизнес-энтропии должны выполнять, например, соответствующие государственные и
общественные структуры, функционально отделенные от бизнеса. Возможно,
неизбежным процессом в этом направлении может стать демонополизация крупнейших
экономических структур, проводимая «сверху» эволюционным путем.
В термодинамике считается, что неконтролируемый рост энтропии ведет к
прекращению всяких макроизменений в системах, то есть к их гибели. Поэтому
актуальной является задача поисков методов снижения неконтролируемого роста
энтропии в крупном бизнесе. При этом такие критические цифры энтропии относятся
в основном именно к крупному бизнесу. Простое сокращение численности его
сотрудников не может дать реального результата уменьшения энтропии. Так
сокращение числа работников на 10% дает уменьшение у них энтропии только на
0,6% и это при общих негативных явлениях безработицы, которая неизбежно
сопровождает такой процесс.
Поэтому для таких сверхмоноструктур, не контролируемых ни государством,
ни обществом для уменьшения энтропии бизнеса более реален путь демонополизации
без оптимизации (то есть без сокращения общего числа сотрудников).
Сравнение номограммы (рис. 1) с данными таблицы 3 показывает аддитивность
численных величин энтропии бизнеса (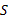 ) со значениями коэффициента
пространственно-энергетических взаимодействий (), то есть
) со значениями коэффициента
пространственно-энергетических взаимодействий (), то есть 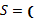 .
.
Поэтому применительно к бизнес-процессам понятие качества бизнеса
аналогично понятию степени структурного взаимодействия (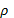 ).
).
Все это позволяет приближенно определить критические значения этих
величин. Так при 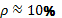 величина
величина 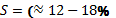 , что соответствует
численности бизнес-структур в пределах от 10000 до 100000 сотрудников (в
среднем около 55000).
, что соответствует
численности бизнес-структур в пределах от 10000 до 100000 сотрудников (в
среднем около 55000).
Оптимальные критерии более качественного бизнеса определяются
максимальным значением их энтропии: 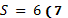 (в относительных единицах).
(в относительных единицах).
Эти же значения ранее получены и для более полной степени структурных
взаимодействий, так как непрерывные твердые растворы соответствуют значению .
Известно так же, что максимально приемлемое для стабильной системы число
атомов в полимерной цепи составляет около 100 единиц, что в кубическом объеме
дает 106. И тогда снова получаем 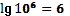 .
.
Сейчас
научный мир озадачен интенсификацией технологических процессов на основе
энергосберегающих электротехнологий, например [9, 10]. Данная методика P-параметра
так же может быть использована и в этом перспективном направлении.
Литература
1. Ф. Рейф.
Статистическая физика. М.: Наука, 1972, 352 с.
2.
Л.А. Грибов, Н.И. Прокофьева. Основы физики. М.: Высшая школа, 1992, 430 с.
3. Korablev G.A.
Spatial-Energy Principles of Complex Structures Formation//Brill Academic
Publishers and VSP, Netherlands, 2005, 426pр. (Monograph).
4. Бацанов
С.С. Звягина Р.А.. Интегралы перекрывания и проблема эффективных зарядов. Изд.
“Наука”, Сибирское отд. Новосибирск, 1966, 386 с.
5. Кодолов
В.И., Хохряков Н.В., Тринеева В.В., Благодатских И.И. Активность наноструктур и
проявление ее в нанореакторах полимерных матриц и в активных средах//Химическая
физика и мезоскопия, 2008. Т. 10. №4. с. 448-460.
6. Рубин
А.Б. Биофизика. Кн.1. Теоретическая биофизика. М.:В.ш., 1987, 319 с.
7. Рубин
А.Б. Биофизика. Кн.2. Биофизика клеточных процессов. М.:В.ш., 1987, 303 с.
8. Э. Тейлор,
Дж. Уилер. Физика пространства-времени. Изд. Мир. М. 1971, 320 с.
9. Смирнова
А.А., Алексеева Н.А., Поспелова И.Г., Возмищев И.В. Новый подход в управлении
утилизацией вторсырья в АПК // Всероссийская научно-практическая конференция
«Инновации в науке, технике и технологиях» 28-30 апреля 2014 г. Ижевск. Изд.
«Удмуртский университет», с. 249-250.
10.
Поспелова И.Г. Сублимационная сушка с комбинированным энергоподводом /
Поспелова И.Г., Захарова Я.Н., Габасова Ф.В.//Механизация и электрификация
сельского хозяйства. – 2009. – №6. – с. 30-32.
СВЕДЕНИЯ ОБ АВТОРАХ
1. Кораблев Григорий
Андреевич – профессор, доктор химических наук, заведующий кафедрой физики
Ижевской Государственной Сельскохозяйственной Академии.
E-mail:
korablevga@mail.ru
2. Кораблев Роман
Григорьевич – аспирант Ижевской государственной сельскохозяйственной академии.
3. Кодолов Владимир
Иванович, доктор химических наук, профессор, заведующий кафедрой химии и
химической технологии Ижевского Государственного Технического Университета.
426000, г.Ижевск, ул. Студенческая 7, т. (3412) 582438, e-mail:
kodol@istu.ru
4. Петрова Наталья
Григорьевна – специалист-эксперт отдела информационной безопасности и связи
Министерства информатизации и связи УР. E-mail:
biakaa@mail.ru
5. Заиков
Геннадий Ефремович, доктор химических наук, профессор института Биохимической
физики им. Н.М. Эмануэля РАН, e-mail: chembio@sky.chph.ras.ru
6. Осипов Анатолий
Константинович – профессор, доктор экономических наук, заведующий кафедрой
менеджмента и права ИжГСХА.
![]() (1)
(1)![]() (2)
(2)![]() (3)
(3) Применяя
надёжные экспериментальные данные, была получена номограмма зависимости степени
структурных взаимодействий (
Применяя
надёжные экспериментальные данные, была получена номограмма зависимости степени
структурных взаимодействий (![]() ) от коэффициента α,
единая для широкого класса структур. Данный подход дал возможность оценить
степень и направление структурных взаимодействий процессов фазообразования,
изоморфизма и растворимости в многочисленных системах, в том числе в
молекулярных.
) от коэффициента α,
единая для широкого класса структур. Данный подход дал возможность оценить
степень и направление структурных взаимодействий процессов фазообразования,
изоморфизма и растворимости в многочисленных системах, в том числе в
молекулярных.![]() , (4)
, (4)![]()
![]() = 100%. При этом процесс происходит только в объеме геля, а
не на поверхности несформировавшейся пока пленки.
= 100%. При этом процесс происходит только в объеме геля, а
не на поверхности несформировавшейся пока пленки. 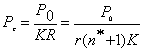 (6)
(6)![]() (7)
(7)
![]() и K=2 – для поверхностной диффузии (рис. 2).
и K=2 – для поверхностной диффузии (рис. 2).![]() по
уравнениям (3,6,7) для атома углерода и меди (табл.1).
по
уравнениям (3,6,7) для атома углерода и меди (табл.1). ![]() ,
то есть
,
то есть ![]() - кривая 2,
представленная на рис. 3. Здесь приведена так же графическая зависимость
степени образования нанопленок (ω) от времени процесса по данным [5] –
кривая №1 и ранее полученная номограмма энтропии в виде ρ1 = f(
- кривая 2,
представленная на рис. 3. Здесь приведена так же графическая зависимость
степени образования нанопленок (ω) от времени процесса по данным [5] –
кривая №1 и ранее полученная номограмма энтропии в виде ρ1 = f(![]() ) - кривая 3.
) - кривая 3.