![]() УДК 547.133;547.518
УДК 547.133;547.518
Индуцированное окисление
тетрагидроиндена и 5-винилнорборнена
кисло-родом воздуха в присутствии металлсодержащих углеродных
материалов.
Алимарданов Х.М., Садыгов
О.А., Гарибов Н.И., Агабейли Г.Б, Дадашева Н.Р, Алмарданова М.Б.
Институт Нефтехимических
Процессов имени Ю.Г. Мамедалиева НАН Азербайджана, AZ. 1025. Баку. пр. Ходжалы, 30. email: omar.sadiqov@gmail.com
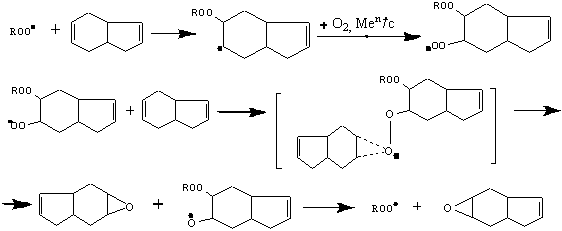
Исследована реакция каталитического окисления тетрагидроиндена и 5-винил-норборнена кислородом воздуха. В качестве катализатора использованы соединения металлов VI-VIIIб группы ,нанесенные на микроструктурированные углеродные мате-риалы. Установлено, что процесс протекает с образованием соответствующих гидропер-оксидов в качестве первичных продуктов окисления. Превращение гидропероксида ниже 600С происходит с большим индукционным периодом, что способствует его накоплению в оксидате. При повышенной температуре (60-90)0С преврашение гидропероксида протее-кает неизбирательно, наряду с эпоксидом, непредельными спиртами и кетонами накап-ливается определенное количество кислородсодержащих олигомерных соединений.
Одним из основных методов введения
кислородсодержащих функцио-нальных групп в состав предельных и непредельных
углеводородов является их газо- или
жидкофазное окисление с участием кислорода воздуха или пероксида водорода[1-5].
С целью повышения селективности этих реакций по таким ценным продуктам как
эпоксиды, непредельные спирты и кетоны
с сохранением исходных углеводородов, при их окислении часто в качестве
со- восстановителя применяются более легко окисляющиеся по сравнению с
субстратом соединения (альдегиды, С1-С2 карбоновые
кислоты или их ангидриды). Образующиеся пероксидные интермедиаты в дальнейшем
участвуют либо в индуцировании с последующим
разложением активного трехкомпонентного комплекса, либо в сопряженном
окислении самого суб-страта по схеме:
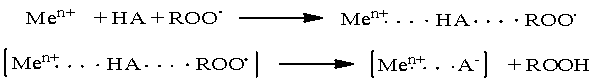
В обоих случаях молекулярный кислород в
окислении углеводородов участвует через
стадии образования промежуточного интермедиата, за счет которого достигается
высокая селективность по целевым продуктам. В настоящее время наибольшее
внимание уделяется процессам, осуществля-емым с участием гетерогенизированных
каталитических систем, в частности, мезопористых и неупорядоченных силикалитов
или углеродных материалов, содержащих катионы поливалентных металлов
[6-12]. Такие катализаторы достаточно
широко используются при эпоксидировании моно- и бицикличес-ких непредельных
углеводородов органическими гидропероксидами и/или пероксидом водорода [3-5].
Однако, сведения об автоокислении этих угле-водородов с участием молекулярного
кислорода весьма ограничены.
Более ранние работы по окислению
бициклических мостиковых угле-водородов показали, что такие соединения как
борнилен, камфен и d-фенхен в присутствии стеаратов кобальта (II) и марганца (II) в режиме
автоокисления практически не взаимодействуют с молекулярным кислородом [13,14].
В отличие от них жидкофазное окисление a-пинена с участием кислорода при температуре 70-90о
С протекает даже в отсутствии катализатора [15]. При использовании платинонанесенного углеродного материала
(сибунита) селективность реакции по продуктам автоокисления- вербенену и
вербенолу достигает 50% при конверсии a-пинена 20-30% [16].
Цель настоящей работы – исследование
реакции жидкофазного окисле-ния 5-винилбицикло[2.2.1]гепт-2-ена
(5-винилнорборнена, ВНБ) и бицикло-[4.3.0]нона-3.7-диена (тетрагидроиндена, ТГИ) с участием кислорода
возду-ха и пероксида водорода в присутствии
модифицированного оксобромида-ми молибдена (V), вольфрама (VI) а также бромидом кобальта (II) микро-структурированного углеродного материала
(МУМ).
Экспериментальная часть
Исходные ВНБ [Ткип. 64.5-65.5 (
4.5 мм.рт.ст, d420=1.0224, nd20=1.4875).]
и ТГИ [Ткип 1480С, d420=0.8344, nd20=1.4658]
получали реакцией конденсации циклопентадиена с бутадиеном-1.3 [17]. Опыты по
окислению циклооле-финов кислородом
воздуха проводили в отсутствии растворителя на лабо-раторной установке со стеклянным реактором
барботажного типа снабжен-ного фильтром Шотта , термопарой, системой холодильников
и ловушек. Скорость подачи очищенного воздуха 30 литров в час на 100 грамм
сырья. Количество образующегося
гидропероксида определяли йодометрическим титрованием [18].
Окисление субстратов с участием пероксида
водорода осуществляли при 60-900С
в стеклянном термостатированном
реакторе стационарного ти-па, снабженном
механической мешалкой, термометром и обратным холо-дильником.
Катализаторы готовили термической
обработкой индивидуальных или бинарных
смесей металлических порошков молибдена
и вольфрама моле-кулярным бромом, растворением полученных оксогалогенидов MoOnBrm или WOnBrm, (где n=1,2 ; m=2-4) в обсалютном этиловом спирте, с последующей пропиткой этими растворами , а затем раствором бромида кобальта(II) мик-роструктурированного углеродного материала,
полученного взаимодейст-вием металлического алюминия и CCl4 (и CHBr3) по методу [12,19] с после-дующей сушкой в течение 4
часов при 120-1400С , обработкой 85%-ным H3PO4 и 30%-ным водным раствором H2O2. В качестве подложки исполь-зовали также высокодиспергированный
уголь марки АГ-2 и АГ-3. Концен-трация металлов в приготовленных системах
составляет (0,5-3,0)·10-3 г-ат/л.
Состав оксидата (полученного окислением
кислородом воздуха) после восстановления водным раствором NaOH, анализировали
на хроматографе «Цвет-500» с
пламенно-ионизационным детектором, колонка
2000х2 мм, фаза полиэтиленгликольсукцинат (ПЭГС) на хромосорбе (5 масс.
%), газ-носитель гелий, Тк-1600С, Тисп-2800С.
Для анализа продуктов реакции окисления
пероксидом водорода (после предварительной обработки пробы 20%-ным раствором NaOH для вос-становления невошедшего в реакцию пероксида
водорода) использовали хроматограф ЛХМ-8 МД
с детектором по теплопроводности с колонкой 2000 х 3 мм, заполненной
насадкой (5 мас % ) силикона ХЕ-60 на хроматоне N-AW DMCS, Ткол-1300С, скорость
газа-носителя (гелий) 40 см3/мин.
Структура выделенных из катализатов соединений подтверждена ИК,
ЭПР-, УФ-методами. Фурье-ИК-спектры поглощения образцов регистрирова-ли в
области 450-4400 си-1 на спектрометре, FT-IR, Spectrum BX (Perkin-Elmer) в
таблетке KBr. Спектры ЭПР снимали при 77 и
300 K на радиоспек-трометре YES-PE3x фирмы JEOL с
рабочей частотой 9300мГц. В качестве эталона при измерении значений g-фактора использовали дифенилпикрил-гидразин (ДФПГ g=2.0036).Электронные спектры поглощения измерены на
приборе UV/VIS Specord /M40 ( Германия).
Результаты и обсуждение
Окисление некоторых
углеводородов-производных бицикло[2.2.1]гепт-2-ена молекулярным кислородом ранее была описано в работах [13,14]. Показано, что в исследованных
углеводородах α-Стрет-Н-связь
у основания мостика расположена в перпендикулярном положении относительно осей
“π электронных” облаков, двойной связи. Это приводит к включению третичной
α-Стрет-Н-связи в σ, π-сопряжению и к уменьшению ее
химической актив-ности.
Однако, наличие в положении 5 в молекуле 5-винил-бицикло-[2.2.1]
гепт-2-ена электронодонорной винильной группы
увеличивает вероятность активизации
атомов водорода в положениях 5, 6 и 7 цикла, при окислении их кислородом
воздуха по многоцентрному механизму до соответствующих гидропероксидов по схеме:
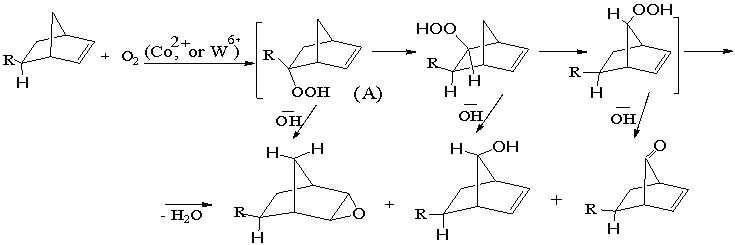
где: R= -CH=CH2
В отличие от
5-винилбицикло[2.2.1]гепт-2-ена, в молекуле бицикло- [4.3.0]нона-3.7-диена один
из атомов водорода вторичной Свтор-Н
связи a-углередного атома, как в
шести-, так и в пятичленном фрагменте
молекулы расположен аксиально к
плоскости двойной связи, что способствует мягко-му окислению данного углеводорода
кислородом воздуха. Кроме того, конфигурация бицикло[4.3.0]нона-3.7-диена менее
жесткая, чем конфигура-ция
5-винилбицикло[2.2.1]гепт-2-ена. Отсутствие структурной жесткости у
молекулы бицикло[4.3.0]нона-3.7-диена, возможно, способствует образова-нию их
благоприятных конформационных расположений
в переходном состоянии при
окислении кислородом воздуха. Выход и селективность пер-вичных продуктов
окисления циклоолефинов кислородом воздуха –гидро-пероксидов и направления замещения
водородных атомов, очевидно, зависит от перераспределения электронной плотности
переходного комплекса :
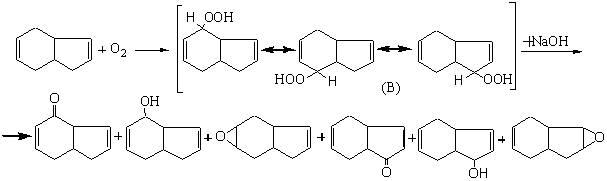
По видимому, эта реакция с участием сопряженных цикленов, во мно-гих
случаях в отличие от α-олефиновых углеводородов, протекает не через стадии отрыва атома водорода из a- положения к кратной связи, а за счет других
водородных атомов с образованием соответствующих гидропер-оксидов (А) и (В), в
качестве первичных продуктов окисления.
Щелочное
восстановление катализатов
приводит к образованию смеси различных эпоксидов, непредельных спиртов и
кетонов.
Направление и выход продуктов реакции
окисления циклоолефинов кислородом
воздуха зависят от природы применяемых катализаторов (табл.1 и 2) и температуры (табл.3). Сопоставление результатов окисления
5-винилбицикло[2.2.1]гепт-2-ена (табл.1)
и бицикло[4.3.0]нона-3.7-диена (табл.2) в глубоких стадиях превращения
углеводородов с участием ряда гомогенных и гетерогенных катализаторов,
показывает, что состав продуктов в присутствии большинства катализаторов
одинаков, основными продуктами являются соответствующие гидропероксиды и
продукты их разложения- эпоксиды, непредельные кетоны и спирты . Однако
катализаторы I, III и V в этих условиях обеспечивают относительно высокую
селективность по гидропероксиду (52%), что свидетельствует о возможности регулирования селективности
процесса путем изменения природы
лигандного окружения и размера частиц носителей.
Изменение каталитических свойств в зависимости от дисперсности носителя было прослежено на примере двух
образцов (V и VI) катализатора. В присутствии образца IV и V (табл. 1 и 2) носитель углерод находился в более
дисперсном состоянии по сравнению с другими образцами и выход гидропероксида
высокий. Дисперсность образцов катализаторов на основе углеродных
материалов АГ-2 и АГ-3 сравнительно
невысокий и выходы гидропероксидов низкие. Аналогичный, необычный эффект
дисперсности наблюдался и прежде для некоторых жидкофазных систем [19-23],
что связано с особенностями пористой
структуры углеродного носителя. Это свидетельствует о неполном участии в
катализе катионов кобальта и
воль-фрама, находящихся на поверхности носителя.
Структура вольфрам-кобальт содержащего
углеродного материала была исследована методом ИК-спектроскопии в таблетке KBr. В ИК-спектре образца, не обработанного раствором Н2О2
, имеются интенсивные полосы в области 910, 940, 990 си-1,
характерные для WO+3 и WO+4
фрагментов. Ва-лентные колебания группы PO43- характеризуются полосами при 1090 и 1025 си-1,
Полосы поглощения в области 580 и 705-720си-1 относятся к продуктам гидролиза и окисления CоBr2 в Co(OH)2+.
ИК-спектр катализатора, образовавшегося
после прибавления к образ-цу Н2О2, содержит интенсивные
полосы при 920 и 955си-1, соответствующие фрагменту WO+4, при
этом интенсивность полосы в области 990си-1 сильно уменьшается.
Появляются менее интенсивные полосы при
890, 680, 592, 562, 531 и 515 си-1, характеризующие валентные
колебания пероксидной связи, симметричные и асимметричные колебания
фрагмента ![]() [23]. Предпо-лагается, что как и в случае
гетерополикислоты (ГПК) состава H3PW12O40 [24], при
взаимодействии нанесенного на
углеродный материал WOBr4·2-HBr с H3PO4 и
избытком H2O2 образуются мало активный аквакомлекс и активный пероксокомплекс вольфрамила , который
и участвует в переносе активированного
соединением кобальта кислорода из состава образующегося гидропероксида
5-винилбицикло[2.2.1]гепт-2-ена и бицикло[4.3.0]нона-3.7-диена (или
бициклогептенилпероксо радикала) к двойной связи субстрата.
[23]. Предпо-лагается, что как и в случае
гетерополикислоты (ГПК) состава H3PW12O40 [24], при
взаимодействии нанесенного на
углеродный материал WOBr4·2-HBr с H3PO4 и
избытком H2O2 образуются мало активный аквакомлекс и активный пероксокомплекс вольфрамила , который
и участвует в переносе активированного
соединением кобальта кислорода из состава образующегося гидропероксида
5-винилбицикло[2.2.1]гепт-2-ена и бицикло[4.3.0]нона-3.7-диена (или
бициклогептенилпероксо радикала) к двойной связи субстрата.
Ионы переходных металлов переменной
валентности катализируют разложение промежуточного гидропероксида, тем самым
ускоряют процесс окисления 5-винилбицикло[2.2.1]гепт-2-ена и
бицикло[4.3.0]нона-3.7-диена. Влияние таких ионов на количество и состав
продуктов зависит так от природы металла, так и от условий проведения реакции:
температуры, продолжительности реакции [22].
Так, при окислении
5-винилбицикло[2.2.1]гепт-2-ена в присутствии об-разцов катализатора (V) и (VI) соотношении
эпоксида-(6-винил-эндо-3-окса-трицикло[3.2.1.02.4]октана)
и непредельного спирта-(5-винил-эндо-би-цикло-[2.2.1]гептен-2-ола-7)
примерно равно. В случае же окисления бицикло-[4.3.0]нона-3.7-диена наблюдается
в основном, образование смеси эпоксидов и непредельных спиртов с преобладанием
первых.
Превращение гидропероксида в температурном
интервале 50-600С про-исходит с большим индукционным периодом, что
способствует накоплению его в оксидате.
При повышении температуры от 600С до 900С скорость
рас-хода (разложения) гидропероксида увеличивается и это способствует сниже-нию
продолжительности опыта (до 4 часа). Превращение гидропероксида в данном случае
протекает неизбирательно, наряду с эпоксидами, непредель-ными спиртами и
кетонами накапливается также значительное количество неидентифицированные
кислородсодержащих олигомерных соединении (табл.3).
Весьма интересными оказались данные по
окислению 5-винилбицик-ло[2.2.1]гепт-2-ена и бицикло[4.3.0]ноне-3.7-диена
кислородом воздуха с участием каталитической системы и присутствия
азоизобутиронитрила (АИ-БН) или пероксида бензола. Основными продуктами реакции
являются соот-ветствующие эпоксиды.
Согласно данным [24], возможность
образования эпоксида из 5-винил-бицикло[2.2.1]гепт-2-ена описывается следующей
схемой:
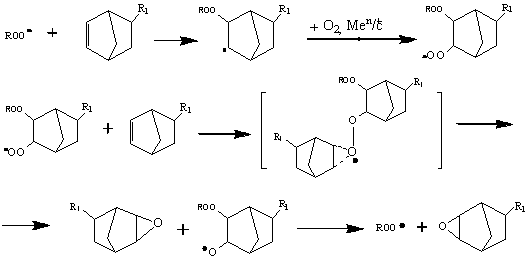
В молекуле 5-винилнорборнена напряжение,
обусловленные за счет деформации валентных [23] углов, обеспечивает большую
реакционную спо-собность двойной связи бицикло[2.2.1]гепт-2-енового фрагмента,
в результа-те чего реакции присоединения по двойной связи протекают значительно
легче, чем по винильной группе. Однако
скорости эпоксидирования как 5-винилбицик-ло[2.2.1]-гепт-2-ена, так и
бицикло[2.2.1]гепт-2-ена близки [22].
Это свидетельствует о том, что из обоих
углеводородов образуются только моноэпоксиды.
В случае ВНБ эпоксидированию подвергается толь-ко двойная связь в цикле, которая в виду жесткости углеродного скелета, напряжена.
По аналогичному механизму протекает
реакция эпоксидирования бицик-ло[4.3.0]нона-3,7-диена:
В заключение следует отметить, что
используя другие окислительные системы и катализаторы, можно, довести до
минимума нокопления раз-личных димерных
и олигомерных продуктов, образующихся при реком-бинации свободных
радикалов, чем и можно обеспечить высокую
селектив-ность окисления по эпоксидом,
непредельным спиртам и кетонам.
Таблица 1.
|
Исходные соединение, нанесенные на МУМ |
Конверсия ВНБ, % |
Состав катализатора, % мас |
|||||
|
Гидро- пероксиды |
Эпок-сиды |
Непре-дельные спирты |
Непре-дельные кетоны |
Возврат ВНБ |
Не идентифиц. соединение |
||
|
Носитель-углерод марки АГ-3 |
|||||||
|
(СН3СОО)2Со |
25 |
6,6 |
9,6 |
11,0 |
10,5 |
55,4 |
1,2 |
|
(СН3СОО)2Mn |
27 |
7,8 |
10,3 |
12,0 |
14,0 |
48,5 |
2,3 |
|
СоСl2 |
32 |
13,5 |
5,2 |
13,5 |
16,4 |
43,4 |
2,0 |
|
CoBr2(kat. I) |
45 |
41,2 |
3,0 |
2,8 |
4,5 |
44,6 |
3,0 |
|
Co(NO3)2 |
48 |
15,6 |
8,6 |
16,4 |
21,4 |
38,5 |
3,3 |
|
WOBr4 |
25 |
5,6 |
10,4 |
12,5 |
5,3 |
69,5 |
2,2 |
|
(NH4)2WO4 |
10,5 |
2,3 |
4,5 |
4,8 |
2,6 |
86,5 |
- |
|
Na2WO4 |
10,2 |
3,4 |
5,3 |
7,8 |
2,6 |
89,6 |
- |
|
CoBr2+WOBr4 (Kat. II) |
49,5 |
6,3 |
16,5 |
19,1 |
13,6 |
42,6 |
4,8 |
|
Носитель-углерод марки АГ-2 |
|||||||
|
CoBr2(каt.III) |
48,6 |
43,5 |
4,5 |
6,0 |
3,2 |
38,6 |
2,0 |
|
CoBr2+WOBr4 ( Kat. – IV) |
45,4 |
6,8 |
18,6 |
20,5 |
8,5 |
46,5 |
2,8 |
|
Носитель-высокодиспергированный углерод* |
|||||||
|
CoBr2 –(kаt. V) |
51,5 |
45,7 |
4,2 |
6,4 |
3,4 |
36,5 |
2,2 |
|
CoBr2+WOBr4 (Kat. – VI) |
54,6 |
7,6 |
17,5 |
21,1 |
13,6 |
38,6 |
4,3 |
Жидкофазное окисление 5-винилнорборнен (ВНБ) в присутствии микроструктуриванного углеродного материала (ВМУМ) модифицированного соединениями Co (II), W (VI), H3PO4 и H2O2 (Men+: H3PO4: H2O2= 4:1:4, T=600C, τ=6 час. uвоздух-20л/час)
*Катализатор приготовленный по способу [19]
Таблица 2.
Жидкофазное окисление тетрагидроиндена (ТГИ) в присутствии микроструктуриванного углеродного материала (ВМУМ), модифицированного
соединениями Co (II), W (VI), H3PO4 и H2O2 (Men+: H3PO4: H2O2= 4:1:4, T=600C, τ=6 час.
uвоздух-20м/час).
|
Исходные соединение, нанесенные на ВМУМ |
Конверсия ТГИ, % |
Состав катализатора, % мас |
||||||
|
Гидро- пероксиды |
Эпок-сиды |
Непре-дельные спирты |
Непре-дельные кетоны |
Возврат ТГИ |
Не идентифиц. соединение |
|||
|
Носитель-углерод марки АГ-3 |
||||||||
|
(СН3СОО)2Со |
27 |
7,8 |
8,4 |
12,0 |
9,6 |
58,0 |
1,1 |
|
|
(СН3СОО)2Mn |
29 |
8,5 |
9,3 |
13,5 |
12,6 |
56,0 |
2,5 |
|
|
СоСl2 |
35 |
14,6 |
11,6 |
14,8 |
13,6 |
46,0 |
2,3 |
|
|
CoBr2(kat. I) |
47 |
43,8 |
4,5 |
3,8 |
6,8 |
48,0 |
2,5 |
|
|
Co(NO3)2 |
49 |
17,6 |
12,4 |
18,5 |
22,6 |
42,0 |
3,7 |
|
|
WOBr4 |
26 |
7,9 |
11,5 |
13,4 |
5,8 |
66,7 |
2,4 |
|
|
(NH4)2WO4 |
12,5 |
4,5 |
6,3 |
6,8 |
4,6 |
85,6 |
- |
|
|
Na2WO4 |
12,2 |
3,4 |
5,3 |
4,6 |
3,4 |
88,7 |
- |
|
|
CoBr2+WOBr4 (Kat. II) |
52,5 |
8,6 |
17,8 |
19,3 |
14,5 |
45,8 |
4,2 |
|
|
Носитель-углерод марки АГ-2 |
||||||||
|
CoBr2(каt.III) |
53,6 |
52,5 |
6,8 |
8,6 |
5,8 |
42,6 |
2,1 |
|
|
CoBr2+WOBr4 ( Kat. – IV) |
51,4 |
9,5 |
20,6 |
22,5 |
8,3 |
46,7 |
2,6 |
|
|
Носитель-высокодиспергированный углерод* |
||||||||
|
CoBr2 –(kаt. V) |
52,5 |
50,8 |
6,2 |
8,4 |
4,6 |
37,6 |
2,4 |
|
|
CoBr2+WOBr4 (Kat. – VI) |
56,4 |
9,6 |
19,8 |
22,5 |
14,8 |
39,8 |
4,5 |
|
Таблица 3
Результаты окисления тетрагидроиндена (ТГИ) кислородом воздуха в присуствии модифицированных образцов ВМУМ ( uвоздух-20м/час).
|
Ул.Пров. опыта |
Конвер- сия ТГИ, % |
Состав жидкого катализата, % мас |
Селектив-ность % |
||||||||||
|
Т,0С |
Продолж. Час. |
ГП |
Эпок-сиды (Э) |
Непред. спирты |
Непред. кетоны |
Возв-ратн. ТГИ |
Не идент.соед. |
По ГП |
По ЭП+ Спирты |
||||
|
Катализатор V |
|||||||||||||
|
60 |
6 |
44,5 |
38,5 |
5,9 |
3,1 |
2,6 |
47,5 |
0,6 |
77,0 |
18,0 |
|||
|
70 |
6 |
48,6 |
35,2 |
12,6 |
9,3 |
7,5 |
40,6 |
1,6 |
54,5 |
33,9 |
|||
|
80 |
6 |
55,8 |
27,5 |
14,6 |
9,1 |
11,6 |
37,4 |
3,0 |
43,7 |
37,7 |
|||
|
90 |
6 |
60,5 |
22,6 |
17,5 |
11,6 |
13,4 |
32,5 |
3,4 |
34,7 |
44,7 |
|||
|
60 |
4 |
35,0 |
31,6 |
5,8 |
2,4 |
1,5 |
63,4 |
- |
77,7 |
20,0 |
|||
|
60 |
8 |
56,0 |
37,8 |
12,6 |
7,8 |
0,9 |
41,8 |
1,8 |
64,0 |
34,0 |
|||
|
60 |
10 |
58,5 |
32,6 |
15,4 |
10,6 |
3,8 |
35,7 |
3,5 |
52,0 |
41,0 |
|||
|
Катализатор IV |
|||||||||||||
|
60 |
6 |
46,5 |
4,6 |
21,5 |
16,4 |
5,8 |
50,0 |
5,2 |
9,5 |
78,4 |
|||
|
70 |
6 |
50,6 |
4,1 |
23,6 |
17,5 |
5,4 |
43,6 |
6,4 |
8,1 |
81,2 |
|||
|
80 |
6 |
54,5 |
4,8 |
25,3 |
17,8 |
5,1 |
42,5 |
7,8 |
9,0 |
81,3 |
|||
|
Катализатор VI |
|||||||||||||
|
60 |
6 |
49,6 |
3,2 |
25,3 |
19,6 |
3,2 |
42,8 |
6,8 |
6,2 |
87,5 |
|||
|
70 |
6 |
56,4 |
3,7 |
27,6 |
20,3 |
3,8 |
40,6 |
6,2 |
4,6 |
93,8 |
|||
|
80 |
6 |
59,5 |
2,6 |
28,5 |
23,5 |
5,3 |
34,8 |
7,5 |
4,3 |
86,8 |
|||
Cписок литературы:
1.Encyclopedia of Catalysis vol.6. (Ed.1.T. Horvath).
Wiby-İnterscience, New York, 2003. 451 p.
2. Sheldon R.A., Dakka J // Topics Curr.
Chem.1993.V.164.N.12.p.21-43
3. Clark S.H., Rhades. Clen Synteses Using Porous
Inorganic Solid Catalysis and Supported Reagents.// Royal Society/ Cambridg
2000. 210p
4.Crigoropoulu G., Clark J.H., Elingusing S.A. //Green.Chem.2003,No.
5. p.1-7
5. Noyori R.,Aoki M., Sato K. // Chem
Commun., 2003, p. 1977-1982; Chem.Eng. 2006.V.113.No.12.p.19-25
6. Nakagova Y., Kamata K., Katani M., Yamaguchi K., Mizuno N.//
Angen.Chem.INt.Ed.2005.V.44.No.32.p.5136-5141
7. Maiti Swarup K., Dinda
Subhajit, Gharah Narottam, Bhattacharyya Ramgopal.
// Now
J.Chem.2006.V30.No.3.p.479-489
8. Samaniego N.M., Crivello M.E., Ghione G.E., Herrero E.R., Marchetti
S.G. //Appl. Catal.A. 2005. V.287.N2.p.227-235
9. Халдеева О.А., Трухан Н.Н // Успехи химии.2006.Т.75. № 5.с.460-482
10. Rafelt Y.S., Clark Y.H. // Catal Today, 2000.V.57. p33-45
11. Алимарданов
Х.М.,Садыгов О.А.,Сулейманова Э.Г. и др //ЖПХ.2009.Т.82.вып.7.с.1159-1166
12. Алимарданов Х.М.,
Садыгов О.А., Гарибов Н.И. и др.
// ЖПХ.2011.Т.84.вып.2.с.240-246
13. Несмеянов А.Н.,
Печерская К.А., Ахрамович А.Н., Минакова Л.М.// ДАН СССР.1974.Т.215.с.101
14. Вороненков
В.В.,Шапиро Ю.Е., Сухов В.Д., Лазурин Е.А.//ДАН СССР.1994.Т.215.с.101
15. Патласов В.П.,
Савиных В.И., Кушнир С.Р., Лукоянов В.П. //Изв. Вузов
Леси.журн.1999, № 5, с. 74
16. Кузнецова Л.И.,
Кузнецова Н.И., Лис А.С., Бекк И.Э., Лихолобов В.А, Ансель Ж.Э. // Кинетика и
катализ.2007.Т.48.№1.с.44-50
17. Платэ А.Ф., Беликова
Н.А.//ЖОХ.1960.Т.30.вып.12.с.3945-3953
18. Бабко А.К.,
Пятницкий И.В. Количественный анализ. М.:Мир, Выст. шк., 1962.508 с
19. Пат.i. 0180, 2009
Азербайджан
20. Catalytic oxidations with hydrogen peroxide as oxidant
(Ed.G.Strukul), Kluwer Akademic “Dordercht”, Boston, 1992
21. Okhlopkova L.B., Lisitsyn A.S., Likholobov V.A., Gurrat
M., Boehm
H.P.// Appl. Catal.A: General.2000.v.204.N.2.p.229
22. Кузнецова Л.И.,
Кузнецова Н.И., Лисыцин А.С., Кириллова
И.В., Дегушева.Л.Г., Лихолобов В.А, Храмов М.И., Ансель Ж.Э. // Кинетика и катализ.2005.Т.46. №2.с.219-232
23. Тимофеева М.Н.,
Пай З.П., Толстиков А.Г. и др. //Изв. РАН Сер.хим.2003.№2.с.458-463
24. Зефиров Н.С., Соколов В.И. // Успехи Химии.
1969.Т.36.с.243