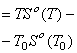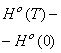Физика/1.
Теоретическая физика
К.х.н. С.В. Федоров.
Санкт-Петербургский государственный
политехнический университет.
Россия
КВАНТОВАЯ ПРИРОДА
ФУНКЦИЙ ОБРАЗОВАНИЯ
ТЕРМОДИНАМИЧЕСКИХ
СВОЙСТВ ВЕЩЕСТВ И НОВЫЕ
ПРИНЦИПЫ ИХ РАСЧЕТА.
В основе расчета термодинамических, индивидуальных свойств веществ
лежат термодинамические функции энтропии ![]() , приведенной энергии Гиббса
, приведенной энергии Гиббса ![]() , энтальпии
, энтальпии ![]() , теплоемкости
, теплоемкости ![]() , энергии Гиббса
, энергии Гиббса ![]() , которые могут быть вычислены через статистические суммы по
состояниям молекул (атомов) составляющих
изучаемую термодинамическую систему.
, которые могут быть вычислены через статистические суммы по
состояниям молекул (атомов) составляющих
изучаемую термодинамическую систему.
Согласно статистике Бозе-Эйнштейна [1] энтропия веществ не зависимо от агрегатного
состояния, связана с суммой по
состояниям формулой
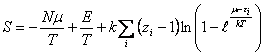 ,
(1)
где
,
(1)
где
![]() постоянное число частиц системы;
постоянное число частиц системы; ![]() постоянная энергия системы;
постоянная энергия системы;
![]() числа заполнения
соответствующих энергетических уровней;
числа заполнения
соответствующих энергетических уровней;
![]() энергия i – ой частицы;
энергия i – ой частицы; ![]() химический потенциал;
химический потенциал;
k –
постоянная Больцмана; 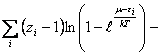 сумма по состояниям.
сумма по состояниям.
Из статистики Ферми – Дирака [1]
вытекает функция энтропии вида
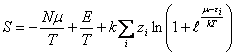 (2)
К сожалению, использовать
уравнения (1), (2) для расчета энтропии конденсированных фаз практически
невозможно, так как невозможно оценить их суммы по состояниям в полном объеме.
Однако основным источником информации термодинамических свойств газообразных
фаз в их стандартном состоянии как раз являются суммы по состояниям и их
производные, так как выше указанные функции
(2)
К сожалению, использовать
уравнения (1), (2) для расчета энтропии конденсированных фаз практически
невозможно, так как невозможно оценить их суммы по состояниям в полном объеме.
Однако основным источником информации термодинамических свойств газообразных
фаз в их стандартном состоянии как раз являются суммы по состояниям и их
производные, так как выше указанные функции
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() связаны с ними
зависимостями [2]
связаны с ними
зависимостями [2]
![]() (3)
(3)
![]() (4)
(4)
![]() (5)
(5)
![]() ,
(6) где
,
(6) где ![]() - сумма по
состояниям
(7)
- сумма по
состояниям
(7)
![]() энергия i -го состояния молекулы,
энергия i -го состояния молекулы,![]() энергия её нижнего (основного) состояния, Pi – статистический вес i -го состояния, k – постоянная Больцмана;
энергия её нижнего (основного) состояния, Pi – статистический вес i -го состояния, k – постоянная Больцмана;
Экспериментальное
определение термодинамических функций газов при температурах выше 1000К –
задача практически невыполнимая в настоящее время [2] , поэтому вся информация
о термодинамических функциях газов в стандартном состоянии основывается на
теоретических расчетах.
Вследствие
независимости поступательного движения молекулы (атома) и внутримолекулярного
движения частиц молекулы или атома статистическую сумму по состояниям молекулы
(атома) можно представить в виде произведения суммы по состояниям поступательного
движения и суммы по внутренним состояниям [2]
![]() ,
(8)
,
(8)
Следовательно, согласно (3) - (7
), имеем
![]() (9)
(9)
![]() (10)
(10)
![]() (11)
(11)
![]() (12)
(12)
Не смотря на то, что с
развитием вычислительной техники были сняты ограничения обусловленные
трудностью расчетов статистических сумм и её производных, возникли другие
проблемы, ограничивающие точность вычисления термодинамических функций газов,
особенно при высоких температурах. Термодинамические свойства многих веществ
изучены недостаточно полно особенно при высоких температурах. Для ряда веществ имеющиеся данные либо не
надежные, либо совсем неизвестны. Однако различные приближенные методы, в
основе которых лежат эмпирические или полуэмпирические закономерности, позволяют
во многих случаях с достаточной точностью оценивать неизвестные
термодинамические величины.
Уравнениями (1), (2), вытекающими из статистической
термодинамики, не ограничивается
возможность расчета энтропии веществ. В работах [3,4] предложена функция для расчета
энтропии
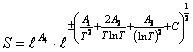 ,
(13) где, как правило,
,
(13) где, как правило, ![]() .
.
В общем случае «С» является для
простых термодинамических систем (нет ни химических, ни фазовых превращений и
т.д.) функцией температуры и объема, т.е.
C = C (T, V)
(14)
Если объем системы V
выступает как функция состояния, то для простой термодинамической
системы
V = V (T, P),
(15)
и, следовательно,
C = C (T, P)
(16)
Термодинамические свойства веществ обычно изучают при
постоянном давлении (P = const), тогда
«С» есть функция только
температуры, т.е.
С = С (Т)
(17) В тех случаях, когда зависимостью
функции С(Т) от температуры Т можно
пренебречь, тогда принимаем С = const.
Уравнение (13)
по расчету энтропии веществ, связывали с
интервалом температур, на котором значение
«С» рассматривалась как
постоянная величина. В этом случае упрощается поиск уравнения изобарной
теплоемкости веществ, которое находится простым дифференцированием функции (13)
по температуре Т. В этом случае функция изобарной теплоемкости имеет наипростейший
вид
 (18) где
(18) где ![]()
Надежность
уравнений (13) и (18) представлена согласием большого числа расчетных значений
энтропии и изобарной теплоемкости веществ, приведенных в таблицах 1 – 5 с
данными литературных источников [2,5].
Уравнения (1),
(2), вытекающие из статистики Бозе - Эйнштейна
и Ферми-Дирака, должны согласоваться с уравнением (13), если оно
носит фундаментальный характер. С этой
целью функцию (13) разложим в ряд по формуле
![]() , (19) где
, (19) где 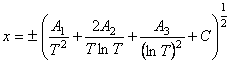 ; С = С(Т)
(20) Следовательно,
; С = С(Т)
(20) Следовательно,
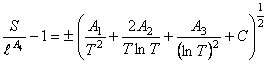 (21) Из последовательных преобразований функции (1) вытекает
(21) Из последовательных преобразований функции (1) вытекает

 (22)
Сопоставляя, левые и правые части
уравнений (21) и (22), находим
(22)
Сопоставляя, левые и правые части
уравнений (21) и (22), находим 
 .
(23)
.
(23)
Учитывая, что произведения левых частей равенств (23) ![]() величины постоянные
правые части их должны быть также постоянными. Это значит, что энергия Е системы растет с температурой и должна
быть представлена функцией
величины постоянные
правые части их должны быть также постоянными. Это значит, что энергия Е системы растет с температурой и должна
быть представлена функцией
![]() ,
(24) где
,
(24) где ![]() постоянная энергия
замкнутой системы с постоянным числом частиц N. Подставляя (24) в первое равенство
из (23) имеем
постоянная энергия
замкнутой системы с постоянным числом частиц N. Подставляя (24) в первое равенство
из (23) имеем
![]() ;
(25) Из последнего равенства
вытекает соотношение
;
(25) Из последнего равенства
вытекает соотношение
![]() (26) Для
второго равенства из (23) вытекает, что второй сомножитель, характеризующий сумму по состояниям должен
меняться с повышением температуры обратно пропорционально
(26) Для
второго равенства из (23) вытекает, что второй сомножитель, характеризующий сумму по состояниям должен
меняться с повышением температуры обратно пропорционально ![]() , т.е.
, т.е.
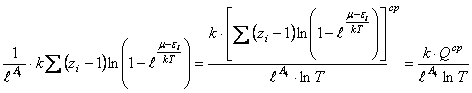 , (27)
, (27)
где 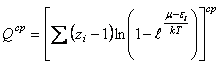 - средне статистическая сумма по состоянию всех видов
движения в системе.
- средне статистическая сумма по состоянию всех видов
движения в системе.
Следовательно,
согласно второго равенства из
(23) и равенства (27) вытекает зависимость
![]() (28)
(28)
Решая совместно (26) и (28), имеем
 (29)
Для третьего равенства из
(23) справедливо соотношение
(29)
Для третьего равенства из
(23) справедливо соотношение
![]() (30)
(30)
Решая совместно (29) и (30), находим
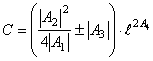 (31)
(31)
В том случае, если С есть функция температуры, т.е. С = С
(Т), то энтропию и изобарную теплоемкость
веществ можно представить функциями
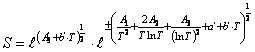 , (32)
где
, (32)
где ![]() ;
; ![]()
 (33) где
(33) где 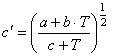 . Решая совместно (25),
(28), (30) и (31), получим
. Решая совместно (25),
(28), (30) и (31), получим ![]() (34)
(34)
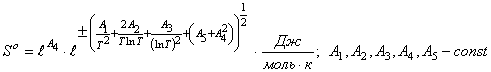
Таблица 1
Таблица
значений коэффициентов выше приведенной функции
энтропии
оксидных соединений.
.
|
№ |
Веще-ство |
|
|
|
|
|
|
= c |
|
|
1 |
BeOkp |
5,0405·10-6 |
- 971090 |
2·161,3678 |
- 3929,41 |
- 12,198 |
200,78 |
349,571 |
300 – 2300 |
|
2 |
ZnOkp |
78,658 |
141434,65 |
2·28,651 |
- 94,0635 |
4,3651 |
- 17,1619 |
1,89224 |
600 – 1600 |
|
3 |
MgOkp |
32463,866 |
93596,79 |
2·7,1 |
1088,759 |
10,3879 |
- 95,381 |
12,5272 |
200 – 3000 |
|
4 |
SiO2,kp |
91,6158 |
- 32227,3 |
2·3374,261 |
- 208,27 |
4,517604 |
- 16,9775 |
3,434133 |
100 – 500 |
|
5 |
SiO2,kp |
150,885 |
- 195077 |
2·5128,52 |
-168,2076 |
5,0165 |
- 22,868 |
2,2974 |
900 – 2000 |
|
6 |
SiO2,kp |
22355,529 |
- 1328372 |
2·30456,04 |
- 238,646 |
10,01483 |
- 74,9066 |
25,39 |
400 – 1000 |
|
7 |
GeO2,kp |
235,7457 |
89786,413 |
2·2161,377 |
- 7,6161 |
5,462754 |
- 29,9389 |
-0,09727 |
300 – 1300 |
|
8 |
TiO2,kp |
1,6240·1030 |
-145999,6 |
-2·604,0672 |
12247,971 |
69,563 |
- 910,044 |
3928,9652 |
400 – 1400 |
|
9 |
Zn2TiO4 |
2,3909 |
225794,35 |
2· 16,97 |
- 985 |
0,87166 |
44,33476 |
45,09454 |
400 – 2000 |
|
10 |
Be2SiO4 |
4,0139·10-8 |
-345046,2 |
-2· 1216,82 |
-5243,522 |
-17,0309 |
326,07248 |
616,0934 |
300 – 1800 |
|
11 |
Mg2SiO4 |
2456,5473 |
241583,99 |
2·
11,2188 |
372,2531 |
7,80651 |
- 64,2255 |
-3,28394 |
400 – 2000 |
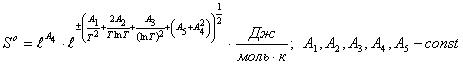
Таблица 2
Таблица расчетных значений энтропии оксидных соединений по выше приведенному уравнению в сопоставлении с данными литературных источников.
|
TK |
SiO2,kp (6) |
GeO2,kp (7) |
TiO2,kp (8) |
Zn2TiO4,kp (9) |
Be2SiO4,kp (10) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Дж/моль К |
||||||||||
|
200 |
|
|
20,54 |
22,502 |
|
|
|
|
|
|
|
300 |
43,748 |
41,746 |
39,488 |
39,71 |
|
|
|
|
64,37 |
64,22 |
|
400 |
56,084 |
55,743 |
56,209 |
56,243 |
|
|
188,635 |
185,9 |
97,11 |
96,052 |
|
500 |
68,504 |
68,5 |
70,539 |
70,519 |
|
|
221,337 |
218,467 |
125,965 |
123,487 |
|
600 |
79,93 |
79,929 |
82,9 |
82,872 |
94,004 |
94,00 |
251,05 |
251,034 |
151,821 |
150,922 |
|
700 |
90,116 |
90,118 |
93,707 |
93,671 |
104,507 |
104,543 |
277,77 |
276,464 |
175,118 |
173,665 |
|
800 |
99,084 |
99,662 ф.п. |
103,293 |
103,247 |
113,912 |
113,916 |
301,886 |
301,894 |
196,261 |
196,407 |
|
900 |
106,95 |
108,832 |
111,913 |
111,857 |
122,42 |
122,371 |
323,764 |
322,761 |
215,586 |
215,422 |
|
1000 |
|
|
119,76 |
119,696 |
130,18 |
130,09 |
343,722 |
343,628 |
233,362 |
234,437 |
|
1100 |
|
|
126,983 |
126,91 |
137,309 |
137,206 |
362,0311 |
361,23 |
249,808 |
250,507 |
|
1200 |
|
|
133,702 |
133,616 |
143,899 |
143,818 |
378,916 |
378,833 |
265,106 |
266,577 |
|
1300 |
|
|
140,011 |
139,903 ф.п. |
150,022 |
150,006 |
394,558 |
393,944 |
279,387 |
279,939 |
|
1400 |
|
|
|
|
155,739 |
155,829 |
409,116 |
409,056 |
292,785 |
294,272 |
|
1500 |
|
|
|
|
161,983 |
161,137 |
422,713 |
422,22 |
305,396 |
306,466 |
|
1600 |
|
|
|
|
166,14 |
166,57 |
435,464 |
435,388 |
317,303 |
318,572 |
![]() - данные литературных
источников [2,5]
- данные литературных
источников [2,5]
![]() - расчетные значения.
- расчетные значения.
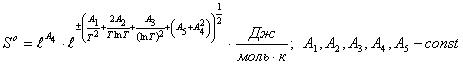 ;
; 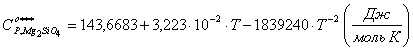
 ;
;
A1,
A2, A3, A4 ,A5 – const ; ![]() ,
, ![]() - по данным [2,5]
- по данным [2,5]
Таблица 3
Расчетные значения энтропии и изобарной теплоемкости оксидных
веществ
в сопоставлении с данными литературных источников [2-5]
|
ТК |
(11) |
(11) |
(1) |
(3) |
(4) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Дж/моль К |
||||||||||
|
100 |
|
|
|
|
|
|
|
|
15,377 |
15,69 |
|
200 |
|
|
|
|
|
|
|
|
32,8 |
32,64 |
|
300 |
|
|
|
|
|
|
|
|
44,443 |
44,719 |
|
400 |
130,72 |
132,46 |
144,41 |
145,047 |
|
|
43,253 |
42,769 |
53,09 |
53,422 |
|
500 |
163,933 |
162,37 |
152,69 |
152,43 |
|
|
45,713 |
45,56 |
62,247 |
60,585 |
|
600 |
192,28 |
192,28 |
157,9 |
157,9 |
42,61 |
42,609 |
47,319 |
47,301 |
|
|
|
700 |
217,027 |
215,658 |
162,772 |
162,478 |
44,734 |
44,801 |
48,5 |
48,517 |
|
|
|
800 |
239,03 |
239,04 |
166,58 |
166,58 |
46,346 |
46,557 |
49,433 |
49,464 |
|
|
|
900 |
258,902 |
258,105 |
170,64 |
170,406 |
47,613 |
47,806 |
50,207 |
50,224 |
|
|
|
1000 |
277,07 |
277,17 |
174,06 |
174,06 |
48,635 |
48,724 |
50,867 |
50,869 |
|
|
|
1100 |
293,85 |
293,37 |
177,85 |
177,602 |
49,476 |
49,453 |
51,443 |
51,436 |
|
|
|
1200 |
309,476 |
309,572 |
181,09 |
181,07 |
50,178 |
50,103 |
51,952 |
51,95 |
|
|
|
1300 |
324,12 |
323,804 |
184,7 |
184,48 |
50,771 |
50,759 |
52,4073 |
52,43 |
|
|
|
1400 |
337,933 |
338,037 |
187,81 |
187,85 |
51,278 |
51,48 |
52,817 |
52,89 |
|
|
|
1500 |
356,016 |
356,636 |
191,28 |
191,351 |
51,713 |
52,302 |
53,188 |
53,341 |
|
|
|
1600 |
363,464 |
363,236 |
194,27 |
194,518 |
52,09 |
53,239 |
53,526 |
53,793 |
|
|

A1, A2,
A3, A4 , A5
– const;
![]() ;
;
![]()
Таблица 4
Расчет значений изобарной теплоемкости веществ в
сопоставлении с данными
Литературных источников [2-5].
|
TK |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дж/моль К |
||||||||||||
|
200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
300 |
|
|
|
|
53,95 |
50,475 |
|
|
100,444 |
|
|
|
|
400 |
|
|
|
|
61,872 |
61,281 |
|
|
121,928 |
|
|
|
|
500 |
60,016 |
60,585 |
|
|
66,35 |
66,273 |
|
|
136,417 |
134,96 |
|
|
|
600 |
64,894 |
64,522 |
|
|
69,126 |
69,089 |
66,798 |
67,414 |
147,02 |
147,02 |
168,87 |
168,87 |
|
700 |
66,936 |
68,063 |
|
|
71,04 |
70,974 |
69,41 |
69,358 |
155,109 |
155,261 |
177,488 |
177,626 |
|
800 |
67,154 |
76,391 ф.п |
|
|
72,53 |
72,449 |
71,423 |
71,035 |
161,47 |
161,47 |
183,516 |
183,516 |
|
900 |
66,219 |
67,953 ф.п |
|
|
73,844 |
73,764 |
73,01 |
72,557 |
166,59 |
166,495 |
187,83 |
187,74 |
|
1000 |
|
|
68,216 |
68,941 |
75,129 |
75,049 |
74,276 |
73,981 |
170,786 |
170,785 |
190,931 |
190,931 |
|
1100 |
|
|
70,096 |
69,94 |
76,487 |
76,378 |
75,305 |
75,343 |
174,275 |
174,597 |
193,19 |
193,445 |
|
1200 |
|
|
71,71 |
71,119 |
77,997 |
77,796 |
76,149 |
76,661 |
177,212 |
178,081 |
194,826 |
195,5 |
|
1300 |
|
|
73,24 |
71,743 |
79,425 |
79,332 |
76,848 |
77,95 |
179,708 |
181,335 |
195,998 |
197,23 |
|
1400 |
|
|
75,256 |
72,249 |
|
Ф.п. |
77,429 |
79,217 |
181,846 |
184,422 |
196,817 |
198,725 |
|
1500 |
|
|
|
|
|
|
77,916 |
80,466 |
183,692 |
187,385 |
197,365 |
200,045 |
|
1600 |
|
|
|
|
|
|
78,324 |
81,704 |
185,846 |
190,255 |
197,703 |
201,233 |
![]() - расчет по приведенным выше уравнениям настоящей работы.
- расчет по приведенным выше уравнениям настоящей работы.
![]() - данные авторов [2,5],
- данные авторов [2,5],
![]() - расчетные значения по
выше приведенным уравнениям.
- расчетные значения по
выше приведенным уравнениям.
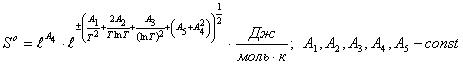
Таблица 5
Таблица расчетных значений энтропии оксидных соединений по выше
приведенному уравнению в
сопоставлении с данными литературных источников
[2-5].
|
ТК |
BeOkp (1) |
MgOkp (3) |
ZnOkp (2) |
SiO2,kp (4) |
SiO2,kp (5) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Дж/моль К |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
1 |
2 |
3 |
4 |
5 |
|
100 |
|
|
|
|
|
|
9,694 |
9,694 |
|
|
|
200 |
|
|
13,028 |
14,1 |
|
|
26,087 |
26,09 |
|
|
|
300 |
|
|
26,852 |
27,181 |
36,115 |
43,66 |
41,737 |
41,736 |
|
|
|
400 |
22,109 |
22,506 |
38,69 |
38,772 |
51,475 |
47,846 |
55,745 |
55,743 |
|
|
Продолжение таблицы 5
|
ТК |
BeOkp (1) |
MgOkp (3) |
ZnOkp (2) |
SiO2,kp (4) |
SiO2,kp (5) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
500 |
30,491 |
30,597 |
48,632 |
48,644 |
64,257 |
66,202 ф.п. |
68,513 |
68,5 |
|
|
|
600 |
37,9995 |
37,907 |
57,117 |
57,115 |
75,804 |
75,85 |
81,642 |
79,929 |
|
|
|
700 |
44,7356 |
44,717 |
64,504 |
64,503 |
81,873 |
83,05 ф.п. |
|
90,118 |
|
|
|
800 |
50,817 |
50,821 |
71,0437 |
71,046 |
90,24 |
90,25 |
|
|
148,55 |
148,55 |
|
900 |
56,354 |
56,381 |
76,912 |
76,918 |
96,875 |
96,027 |
|
|
108,828 |
108,832 |
|
1000 |
61,423 |
61,428 |
82,237 |
82,243 |
102,615 |
101,804 |
|
|
115,79 |
116,042 |
|
1100 |
66,102 |
66,147 |
87,113 |
87,119 |
107,672 |
106,722 |
|
|
122,28 |
122,66 |
|
1200 |
70,435 |
70,478 |
91,611 |
91,617 |
112,176 |
111,64 |
|
|
128,353 |
128,789 |
|
1300 |
74,478 |
74,514 |
95,788 |
95,794 |
116,224 |
115,91 |
|
|
136,17 |
136,393 |
|
1400 |
78,257 |
78,301 |
99,687 |
99,696 |
119,891 |
120,18 |
|
|
141,665 |
141,728 |
|
1500 |
81,813 |
81,88 |
103,34 |
103,361 |
123,233 |
123,968 |
|
|
147,38 |
146,73 |
|
1600 |
85,16 |
85,285 |
106,787 |
106,818 |
126,297 |
127,757 |
|
|
150,88 |
151,44 |
|
1700 |
88,331 |
88,544 |
110,042 |
110,093 |
129,12 |
|
|
|
155,564 |
155,895 |
** - c учетом
средних значений высокотемпературных составляющих по данным
[5]
* - по данным [2 ]
Выбирая в последнем равенстве, знак
минус получим тождество ![]() . При выборе в (34) знака плюс имеем
. При выборе в (34) знака плюс имеем
![]() (35)
(35)
Не нарушая общности рассуждений, введем в рассмотрение функцию
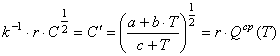 ,
(36) где r – коэффициент пропорциональности.
,
(36) где r – коэффициент пропорциональности.
Согласно работе [4 ]
равенство (36) можно привести к виду
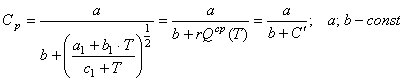 , (37) где
, (37) где ![]() - изобарная теплоемкость.
- изобарная теплоемкость.
Разделив числитель и знаменатель последнего равенства на b и, воспользовавшись приближенным
равенством (19), имеем
![]() , где
, где 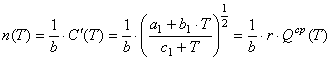 (38)
(38)
В основе определения
неизвестных постоянных коэффициентов ![]() лежит уравнение вида
лежит уравнение вида
![]() ,
(39) где
,
(39) где 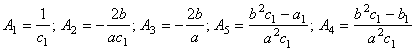 (40) При решении системы уравнений (39) необходимо
выбирать такие интервалы температур, на которых все расчетные значения
постоянных и их отношения согласовались бы между собой. Используя равенства
(40) совместно с дополнительным условием,
вытекающем из (38)
(40) При решении системы уравнений (39) необходимо
выбирать такие интервалы температур, на которых все расчетные значения
постоянных и их отношения согласовались бы между собой. Используя равенства
(40) совместно с дополнительным условием,
вытекающем из (38)
![]() , где
, где ![]() ,
(41) находим уравнение теплоемкости исследуемого вещества.
,
(41) находим уравнение теплоемкости исследуемого вещества.
На базе уравнений (38) – (41) для кристаллического алюминия в
интервале температур ![]() нашли зависимость изобарной
теплоемкости от n (T) [6].
нашли зависимость изобарной
теплоемкости от n (T) [6].
![]() , где
, где ![]() (42) В таблице 6 сопоставлены
расчетные значения по уравнению (42) с данными литературных источников [2,5],
которые находятся в хорошем согласии.
(42) В таблице 6 сопоставлены
расчетные значения по уравнению (42) с данными литературных источников [2,5],
которые находятся в хорошем согласии.
Таблица
6.
Расчетные
значения кристаллического алюминия ![]() по уравнению (42) в
сопоставлении с данными литературных источников [2,5]
по уравнению (42) в
сопоставлении с данными литературных источников [2,5]
|
ТК |
n (расчет) |
(расчет) |
[ 2,5 ] |
Относительная ошибка в % |
|
|
||||
|
100 |
33,174 |
13,05 |
13,05 |
0 |
|
200 |
42,785 |
21,5 |
21,59 |
0,4 |
|
298 |
44,45 |
24,353 |
24,384 |
0,13 |
|
400 |
45,171 |
25,725 |
25,667 |
0,23 |
|
500 |
45,56 |
26,62 |
26,759 |
0,5 |
|
600 |
46,107 |
27,905 |
27,973 |
0,24 |
В интервале температур ![]() теплоемкость твердого
алюминия хорошо описываются уравнениями
теплоемкость твердого
алюминия хорошо описываются уравнениями
![]() (43) Результаты расчета по
уравнениям (43) приведены в таблице 7
(43) Результаты расчета по
уравнениям (43) приведены в таблице 7
Таблица 7.
Расчетные значения
кристаллического алюминия ![]() по уравнению (43) в
сопоставлении с данными литературных источников [2,5]
по уравнению (43) в
сопоставлении с данными литературных источников [2,5]
|
ТК |
n
(расчет) |
(расчет) |
[2,5] |
Относительная ошибка в % |
|
|
||||
|
298 |
44,448 |
24,619 |
24,354 |
1,0 |
|
400 |
44,8 |
25,667 |
25,667 |
0 |
|
500 |
45,152 |
26,811 |
26,759 |
0,2 |
|
600 |
44,51 |
28,085 |
27,973 |
0,4 |
|
700 |
45,87 |
29,424 |
29,415 |
0,03 |
|
800 |
46,247 |
31,13 |
31,13 |
0 |
|
900 |
46,756 |
33,649 |
33,881 |
0,7 |
Термодинамические свойства многих
веществ изучены недостаточно полно особенно при высоких температурах. Для ряда веществ имеющиеся данные либо не
надежные, либо совсем неизвестны. Однако различные приближенные методы, в
основе которых лежат эмпирические или полуэмпирические закономерности,
позволяют во многих случаях с достаточной точностью оценивать неизвестные
термодинамические величины.
Термодинамические функции веществ в
конденсированном состоянии, в отличии от газов, не могут быть вычислены
теоретически с достаточной точностью. Поэтому расчеты термодинамических функций
веществ, в твердом и жидком состоянии проводятся на основании Ш закона
термодинамики и результатов экспериментальных измерений теплоемкостей этих
веществ, изменений их энтальпии при изменении температуры, а также при фазовых
и полиморфных превращениях.
В общем случае теплоемкость чистого
кристаллического вещества при постоянном давлении можно представить в виде
суммы ряда составляющих
![]() , (44)
где
, (44)
где
![]() решеточная
составляющая теплоемкости;
решеточная
составляющая теплоемкости; ![]() составляющая
теплоемкости, обусловленная термическим расширением;
составляющая
теплоемкости, обусловленная термическим расширением;
![]() электронная
составляющая;
электронная
составляющая;
![]() магнитная (магнонная)
составляющая;
магнитная (магнонная)
составляющая;
![]() составляющая,
связанная с переходами на более высокие энергетические уровни (эффект Шоттки);
составляющая,
связанная с переходами на более высокие энергетические уровни (эффект Шоттки);
![]() составляющая, связанная с процессами упорядочения
(структурное, магнитное, электрическое упорядочение);
составляющая, связанная с процессами упорядочения
(структурное, магнитное, электрическое упорядочение);
![]() составляющая,
обусловленная образованием равновесных вакансий в решетке;
составляющая,
обусловленная образованием равновесных вакансий в решетке; ![]() ядерная составляющая,
связанная со сверхтонким расщеплением, обусловленным спинами ядер.
ядерная составляющая,
связанная со сверхтонким расщеплением, обусловленным спинами ядер.
Из равенств (27) и (36) вытекает
соотношение
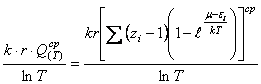 (45) Представим равенство (45) в
развернутом виде
(45) Представим равенство (45) в
развернутом виде
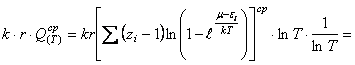
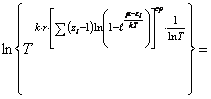

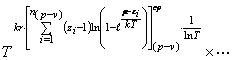

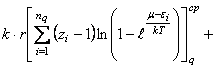
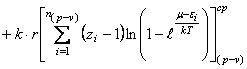
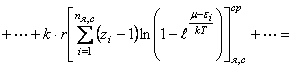
![]() ,
(46) где
,
(46) где ![]() среднестатистические суммы по состояниям, связанные с различными
видами энергий, указанных в (44).
среднестатистические суммы по состояниям, связанные с различными
видами энергий, указанных в (44).
Рассматривая сомножители под знаком логарифма в уравнении
(46), как термодинамические вероятности подсистем материальных точек (атомов
молекул), относящихся к той или иной сумме по состоянию приходим к выводу, что
слагаемые правой части равенства (46) ![]() можно рассматривать
как составляющие энтропии всей системы материальных точек, которые можно
представить равенством
можно рассматривать
как составляющие энтропии всей системы материальных точек, которые можно
представить равенством
![]() (47)
Используя функцию связи изобарной теплоемкости
(47)
Используя функцию связи изобарной теплоемкости ![]() и энтропии
и энтропии ![]()
![]() ,
(48) находим
,
(48) находим
![]()
![]() (49) Из выше изложенного
вытекает, что расчетные уравнения составляющих теплоемкости должны быть по
форме однотипны между собой, т.е.
(49) Из выше изложенного
вытекает, что расчетные уравнения составляющих теплоемкости должны быть по
форме однотипны между собой, т.е.
![]()
![]()
![]() (50)
(50)
![]() , где
, где 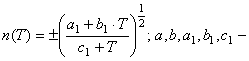 постоянные величины для соответствующих
составляющих теплоемкостей.
постоянные величины для соответствующих
составляющих теплоемкостей.
В частности для кристаллического магния с использованием системы уравнений
(39), (40) нашли функцию для расчета
изобарной теплоемкости в
интервале температур ![]()
![]() ,
(51) где
,
(51) где 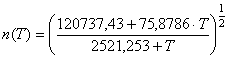 (52)
(52)
Результаты расчета по уравнению (51)
приведены в таблице 8 в сопоставлении с литературными источниками [2] и находятся в удовлетворительном
согласии.
Таблица 8.
Результаты расчета по
уравнению (51) в сопоставлении с литературными источниками [2]
|
ТК |
n |
(расчет) |
[2 ] |
Относит. ошибка в % |
(расчет) |
[ 2 ] |
Относит. ошибка в % |
|
Дж/моль К |
Дж/моль |
||||||
|
200 |
7,0672 |
22,72 |
22,72 |
0 |
|
2650 |
|
|
300 |
7,1308 |
24,21 |
24,9 |
2,771 |
5039,4 |
5046 |
0,13 |
|
400 |
7,1917 |
25,733 |
26,081 |
1,33 |
7597 |
7597 |
0 |
|
500 |
7,24708 |
27,198 |
27,198 |
0 |
10283 |
10261 |
0,2 |
|
600 |
7,29853 |
28,634 |
28,305 |
1,149 |
13035,6 |
13036 |
0 |
|
700 |
7,34646 |
30,04 |
29,414 |
2,084 |
15979,16 |
15922 |
0,37 |
|
800 |
7,391216 |
31,415 |
30,527 |
2,82 |
18995,9 |
18919 |
0,4 |
|
900 |
7,433112 |
32,759 |
31,649 |
3,39 |
22024,75 |
22028 |
0 |
|
923 |
7,4424 |
33,064 |
34,3 |
3,6 |
22756,98 |
22759 |
|
Преобразуем функцию (52), представив её в общем виде
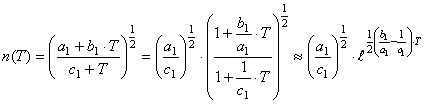 (53)
(53)
Подставляя (53) в любую из формул (50), получим соотношение
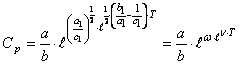 (54) где
(54) где 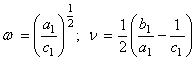 (55)
(55)
В (54) введем
замену ![]() , откуда
, откуда ![]()
![]()
Воспользуемся уравнением (54) для нахождения функции
энтальпии образования кристаллической фазы вещества (в частности
кристаллического магния)
![]()
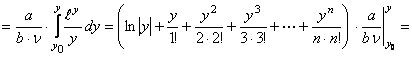
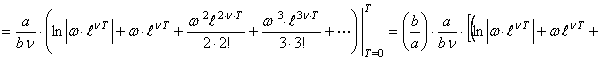
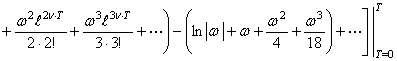 ,
(56) где
,
(56) где 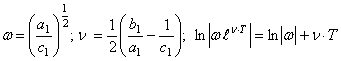 (57) Для кристаллического
магния нашли значения постоянных величин
(57) Для кристаллического
магния нашли значения постоянных величин
![]() , на базе
которых вытекает
, на базе
которых вытекает
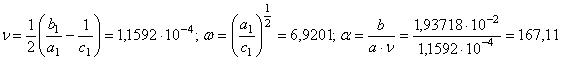 (58)
(58)
Используя уравнение (56), ограничивая которое тремя членами разложения и
подставляя значения ![]() и
и ![]() из (58), нашли
конкретный вид уравнения для расчета энтальпии образования кристаллического
магния
из (58), нашли
конкретный вид уравнения для расчета энтальпии образования кристаллического
магния
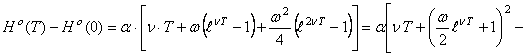
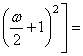
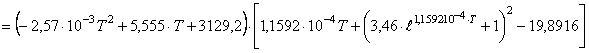 (59)
(59)
Результаты расчета по уравнению (59) приведены в таблице 8.
Общее уравнение энтальпии образования веществ имеет вид 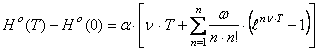 ,
(60) где
,
(60) где ![]() , причем
величины b и
a
связаны с уравнением (54). Для кристаллического магния
, причем
величины b и
a
связаны с уравнением (54). Для кристаллического магния ![]() (см. (58)).
Подсчитаем число сумм с учетом их значений для соответствующих температур в
уравнении (60) при
(см. (58)).
Подсчитаем число сумм с учетом их значений для соответствующих температур в
уравнении (60) при ![]() , с этой целью составили таблицы 9, 10 значений выше указанных сумм, входящих в
уравнение (60).
, с этой целью составили таблицы 9, 10 значений выше указанных сумм, входящих в
уравнение (60).
Таблица 9
Число
значений сумм, входящих в уравнение (60), отвечающих приближенному значению
теоретически обоснованному коэффициенту ![]()
|
№ |
Функции |
ТК |
||||
|
100 |
300 |
500 |
700 |
900 |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
1 |
|
|
|
|
|
0,10431 |
|
2 |
|
0,3614 |
1,107 |
1,884 |
2,6938 |
3,53795 |
|
3 |
|
0,6514 |
2,024 |
3,4956 |
5,073 |
6,764 |
|
4 |
|
1,1334 |
3,5642 |
6,2312 |
9,1573 |
12,367 |
|
5 |
|
1,5779 |
5,0217 |
8,889 |
13,231 |
18,1067 |
|
6 |
|
1,8305 |
5,8965 |
10,5693 |
15,9392 |
22,1105 |
|
7 |
|
1,8202 |
5,9352 |
10,775 |
16,4677 |
23,163 |
|
8 |
|
1,5838 |
5,228 |
9,6146 |
14,895 |
21,251 |
|
9 |
|
1,225 |
4,0937 |
7,628 |
11,582 |
17,3446 |
|
10 |
|
0,8529 |
2,8859 |
5,449 |
8,681 |
12,757 |
|
11 |
|
10,2 |
32,904 |
59,116 |
89,52 |
124,744 |
|
12 |
|
11,048 |
35,75 |
64,565 |
98,2 |
137,5 |
|
13 |
Среднее арифметическое значения сумм |
10,624 |
34,347 |
62,84 |
93,86 |
131,122 |
|
14 |
|
63 |
153,51 |
173,7 |
178,8 |
176,79 |
Продолжение таблицы 9
|
№ |
Функции |
ТК |
||||
|
100 |
300 |
500 |
700 |
900 |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
15 |
|
58,2 |
141,12 |
159,1 |
162,27 |
160,22 |
|
16 |
|
60,6 |
147,3 |
166,4 |
170,54 |
168,5 |
|
17 |
(см. табл. 8) |
|
5039,4 |
10283 |
15979,16 |
22024,75 |
|
18 |
|
643 |
5046 |
10261 |
15922 |
22028 |
|
19 |
|
643 |
5059 |
10456,6 |
16007 |
22094 |
Таблица 10 Число значений сумм, входящих в уравнение (60),
отвечающих приближенному значению теоретически обоснованному коэффициенту ![]()
|
№ |
Функции |
ТК |
|||
|
200 |
400 |
600 |
800 |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
1 |
|
|
|
|
|
|
2 |
|
0,7303 |
1,4915 |
2,285 |
3,111 |
|
3 |
|
1,3258 |
2,747 |
4,271 |
5,904 |
|
4 |
|
2,3207 |
4,867 |
7,66 |
10,725 |
|
5 |
|
3,25 |
6,899 |
10,997 |
15,598 |
|
6 |
|
3,7929 |
8,152 |
13,161 |
18,918 |
|
7 |
|
3,7943 |
8,257 |
13,506 |
19,68 |
|
8 |
|
3,3215 |
7,32 |
12,132 |
17,926 |
|
9 |
|
2,5846 |
5,77 |
9,692 |
14,525 |
|
10 |
|
1,8106 |
4,1 |
6,972 |
10,6 |
|
11 |
|
21,147 |
45,546 |
73,011 |
104,48 |
Продолжение таблицы 10.
|
№ |
Функции |
ТК |
|||
|
200 |
400 |
600 |
800 |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
12 |
|
21,147 |
45,546 |
73,011 |
104,48 |
|
13 |
Среднее арифметическое значения сумм |
22,055 |
47,5925 |
76,596 |
109,78 |
|
14 |
|
125,45 |
166,96 |
176,87 |
178,8 |
|
15 |
|
115,55 |
153,18 |
161,59 |
162,27 |
|
16 |
|
120,5 |
160,1 |
169,7 |
170,54 |
|
17 |
(см.табл.8) |
|
7597 |
13035,6 |
18995,9 |
|
18 |
|
2650 |
7597 |
13036 |
18919 |
|
19 |
|
2657 |
7710,58 |
12963,3 |
18694,71 |
Энтальпии образования
кристаллического магния с учетом средних значений коэффициента
![]() принимает вид
принимает вид ![]()
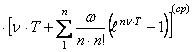 ;
; ![]()
![]() (61)
(61)
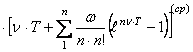
![]()
где n =
1, 2, …..,9; . ![]() .
.
Подставляя среднеарифметические значения сумм из таблицы
9 в уравнение 61, получаем несколько
завышающие средние значения функции образования энтальпии веществ. Для более
точных расчетов на базе суммы девяти слагаемых
(см. табл. 9), можно воспользоваться функциями в интервале температур ![]() и в интервале температур
и в интервале температур ![]() ,
соответственно
,
соответственно
![]()
![]() (61)`
(61)`
![]()
![]() (61)``
(61)``
Из выше
изложенного вытекает, что основным источником
надежной информации о термодинамических функциях веществ в конденсированном состоянии является
эксперимент по изучению теплоемкости ![]() и энтальпии
и энтальпии ![]() , а также температур и энтальпий фазовых переходов. Однако
существует альтернативный метод получения надежной информации, используя уравнение связи изобарной теплоемкости Cp и энтропии S (Т), т.е.
, а также температур и энтальпий фазовых переходов. Однако
существует альтернативный метод получения надежной информации, используя уравнение связи изобарной теплоемкости Cp и энтропии S (Т), т.е.
![]() (62)
(62)
В этом случае уравнение энтальпии образования вещества
вытекает из последовательных преобразований равенства (62), с использованием функции (13)
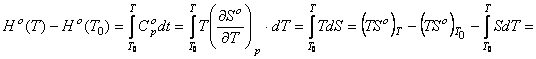
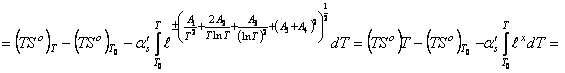
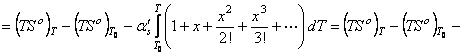
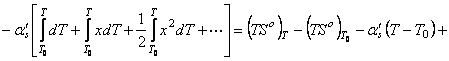
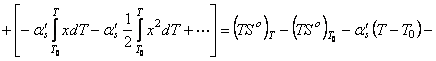


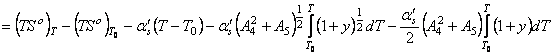 , (63) где приняли
, (63) где приняли
![]()
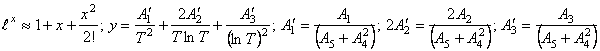
Разложим функцию ![]() в ряд:
в ряд:
![]() (64) Подставляя (64) в (63), и, ограничиваясь в
(64) двумя членами разложения, получим
(64) Подставляя (64) в (63), и, ограничиваясь в
(64) двумя членами разложения, получим
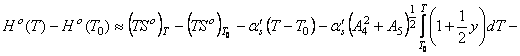
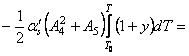
![]()
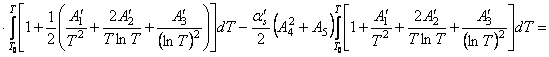
![]()
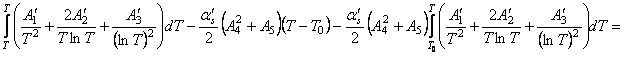
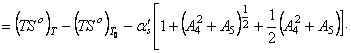
 ·
·
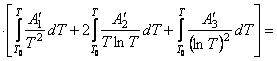
![]()
![]()
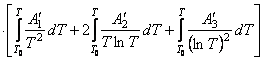 ,
,
где 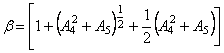 ;
; 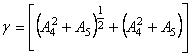
Найдем интегралы
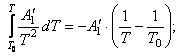
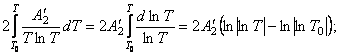
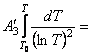
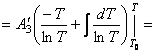
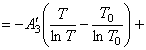
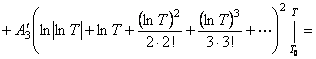
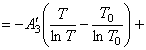
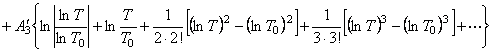
Подставим найденные интегралы в исходное уравнение и,
сгруппировав в третьем интеграле слагаемые в удобную для расчета форму,
имеем
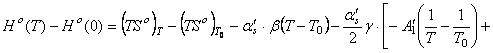
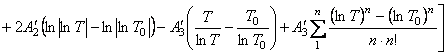 (65)
(65)
Выше рассмотренное интегрирование
предполагает, что коэффициенты ![]() , а также
, а также ![]() на всем исследуемом
интервале температур остаются неизменными. В то же время начальная температура
на всем исследуемом
интервале температур остаются неизменными. В то же время начальная температура ![]() , как показывают расчеты, связана с текущей температурой Т линейной зависимостью.
, как показывают расчеты, связана с текущей температурой Т линейной зависимостью.
![]() (66) В этом случае для многих
соединений основной вклад в функцию их энтальпии образования
(66) В этом случае для многих
соединений основной вклад в функцию их энтальпии образования ![]() вносят первые два
слагаемых в равенстве (65), остальные слагаемые дают суммарный вклад
приблизительно равный нулю. В уравнении
(65) сумма слагаемых
вносят первые два
слагаемых в равенстве (65), остальные слагаемые дают суммарный вклад
приблизительно равный нулю. В уравнении
(65) сумма слагаемых
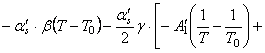
![]()
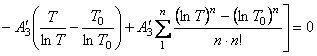 (66)` Уравнение (66)` определяет
функциональную связь между текущей температурой Т и температурой Т0.
Эту связь можно приближенно свести к
линейной зависимости (66). Для
убедительности выше сказанного рассмотрим расчеты термодинамических
функций
(66)` Уравнение (66)` определяет
функциональную связь между текущей температурой Т и температурой Т0.
Эту связь можно приближенно свести к
линейной зависимости (66). Для
убедительности выше сказанного рассмотрим расчеты термодинамических
функций ![]() ,
, ![]() образования
монооксидов бериллия
образования
монооксидов бериллия ![]() и магния
и магния ![]() с использованием
уравнения (13) для энтропии
с использованием
уравнения (13) для энтропии ![]() этих соединений. В
основе расчета вышеуказанных термодинамических функций лежат уравнения:
этих соединений. В
основе расчета вышеуказанных термодинамических функций лежат уравнения:
- для кристаллического монооксида бериллия
![]()

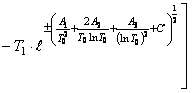 (67)
(67)
где ![]() ;
; ![]()
![]() ; (68)
; (68)
![]() ;
; ![]()
В тех случаях, когда в уравнении (67) величина
![]() связана функцией
связана функцией
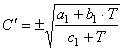 (69)
(69)
энтальпия образования
соединения ![]() на исследуемом интервале
температур описывается функцией
на исследуемом интервале
температур описывается функцией
![]()
 (70)
(70)
Для монооксида бериллия
(![]() ) функция энтальпии
образования
) функция энтальпии
образования ![]() согласно значений
постоянных в (68) имеет вид
согласно значений
постоянных в (68) имеет вид
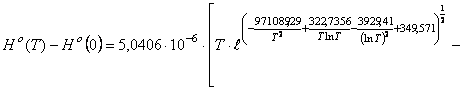
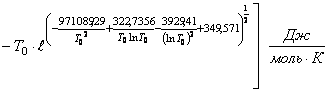 (71)
(71)
где ![]()
![]() ; для интервала температур
; для интервала температур ![]()
Результаты расчета по уравнению (71) приведены в
сопоставлении с литературными источниками
[2,5] таблице 11.
На основании функций (69) и (70) для кристаллического
монооксида бериллия в интервале температур ![]() справедлива функция
вида
справедлива функция
вида
Таблица
11
Результаты
расчета энтальпии образования ![]() и приведенной энергии Гиббса
и приведенной энергии Гиббса ![]() монооксида бериллия
монооксида бериллия ![]() по уравнениям (71) и
(74).
по уравнениям (71) и
(74).
|
TK |
(расчет) |
(расчет) |
(расчет) |
(расчет) |
[2] |
(расчет) |
[2] |
(расчет) |
(расчет) |
[2] |
|
Дж/моль |
Дж/моль |
Дж/моль К |
||||||||
|
400 |
8921,8 |
276,75 |
3022,18 |
5899,6 |
5886 |
22,304 |
22,109 |
14,7375 |
7,566 |
7,735 |
|
500 |
15347,09 |
342,0 |
5828,58 |
9518,5 |
9520 |
30,694 |
30,491 |
19,04 |
11,654 |
11,557 |
|
600 |
22920,81 |
407,2 |
9340,67 |
13580 |
13585 |
38,201 |
38,0 |
22,6417 |
15,56 |
15,356 |
|
700 |
31452,6 |
473,3 |
13509,5 |
17943 |
17947 |
44,932 |
44,736 |
25,6328 |
19,3 |
19,073 |
|
800 |
40807,1 |
540,5 |
18288,4 |
22518,7 |
22520 |
51,009 |
50,817 |
28,148 |
22,863 |
22,67 |
|
900 |
50883,0 |
609,0 |
23651,8 |
27231,2 |
27242 |
56,537 |
56,354 |
30,257 |
26,28 |
26,112 |
|
1000 |
61600,9 |
678,3 |
29527,31 |
32073,6 |
32070 |
61,601 |
61,423 |
32,074 |
29,527 |
29,397 |
|
1100 |
72897,1 |
748,8 |
35921,8 |
36975,3 |
36980 |
66,27 |
66,147 |
33,614 |
32,656 |
32,528 |
|
1200 |
84719,6 |
820 |
42767,4 |
41952 |
41958 |
70,6 |
70,478 |
34,96 |
35,64 |
35,512 |
|
1300 |
97024,2 |
892 |
50052,3 |
46971,8 |
47001 |
74,634 |
74,514 |
36,132 |
38,502 |
38,359 |
|
1400 |
109773,7 |
964 |
57672,8 |
52101 |
52112 |
78,41 |
78,301 |
37,215 |
41,195 |
41,078 |
|
1500 |
122936,1 |
1036 |
65603,8 |
57332,3 |
57301 |
81,957 |
81,88 |
38,221 |
43,736 |
43,68 |
|
1600 |
136483,6 |
1108,8 |
73917,2 |
62566,5 |
62577 |
85,302 |
85,286 |
39,104 |
46,198 |
46,175 |
|
1700 |
150389,92 |
1179,994 |
82313,6 |
68076,3 |
67952 |
88,465 |
88,544 |
40,045 |
48,42 |
48,572 |
|
1800 |
164636,3 |
1251,827 |
91038,0 |
73598,3 |
73435 |
91,4646 |
91,677 |
40,888 |
50,577 |
50,88 |
|
1900 |
179202,07 |
1323,66 |
100000,75 |
79201,3 |
79031 |
94,317 |
94,703 |
41,685 |
52,632 |
53,107 |
|
2000 |
194070,0 |
1395,493 |
109188,84 |
84881,2 |
84737 |
97,035 |
97,629 |
42,44 |
54,59 |
55,261 |
|
2100 |
209224,4 |
1467,326 |
118590,54 |
90633,86 |
90543 |
99,631 |
100,462 |
43,159 |
56,47 |
57,346 |
|
2200 |
224651,06 |
1539,159 |
128195,48 |
96455,58 |
96427 |
102,114 |
103,199 |
43,83 |
58,283 |
59,369 |
|
2300 |
240337,3 |
1611 |
137996,3 |
102343 |
102353 |
104,5 |
105,833 |
44,797 |
61,335 |
61,332 |
 , (72) где
, (72) где 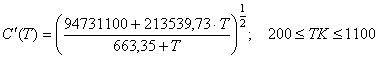 (73)
(73)
На базе уравнений (72) и (73)
произведены расчеты энтальпии образования ![]() кристаллического
монооксида бериллия
кристаллического
монооксида бериллия ![]() и функции приведенной
энергии Гиббса
и функции приведенной
энергии Гиббса
![]() (74) сопоставленных с
данными литературных источников [2], (см. табл. 12).
(74) сопоставленных с
данными литературных источников [2], (см. табл. 12).
Таблица
12
Результаты расчета энтальпии
образования ![]() и приведенной энергии
Гиббса
и приведенной энергии
Гиббса ![]() монооксида бериллия
монооксида бериллия ![]() по уравнениям (72) и
(73).
по уравнениям (72) и
(73).
|
ТК |
(расчет) |
(расчет) |
(расчет) |
(расчет) |
(расчет) |
[2 ] |
|
Дж/моль |
Дж/моль К |
|||||
|
100 |
389,9656 |
5,193 |
0,05 |
|
|
|
|
200 |
398,99 |
699,7279 |
4,164 |
3,499 |
0,665 |
1,59 |
|
300 |
405,9978 |
2835,185 |
13,108 |
9,4506 |
3,658 |
4,314 |
|
400 |
411,6 |
5898,164 |
22,304 |
14,745 |
7,559 |
7,704 |
|
500 |
416,182 |
9543,03 |
30,694 |
19,086 |
11,608 |
11,557 |
|
600 |
420,0 |
13594,394 |
38,201 |
22,657 |
15,544 |
15,356 |
|
700 |
423,23 |
17954,56 |
44,932 |
25,65 |
19,282 |
19,079 |
|
800 |
426,0 |
22563,479 |
51,0 |
28,204 |
22,796 |
22,671 |
|
900 |
428,4 |
27381,173 |
56,537 |
30,423 |
26,114 |
26,112 |
|
1000 |
430,5012 |
32379,29 |
61,6 |
32,38 |
29,22 |
29,397 |
|
1100 |
432,355 |
37536,745 |
66,27 |
34,124 |
32,146 |
32,528 |
На базе данных таблицы 1 и общего уравнения (70) нашли конкретное уравнение по расчету
энтальпии образования монооксида магния ![]()
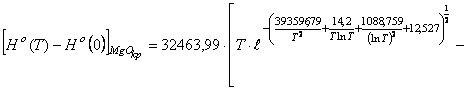
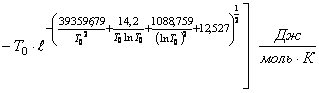 (75) где
(75) где ![]()
![]() (76)
(76)
![]() ;
; ![]()
На базе уравнений (75) и (76) произведены расчеты энтальпии
образования ![]() монооксида магния
и функции приведенной энергии Гиббса
монооксида магния
и функции приведенной энергии Гиббса ![]() в сопоставлении с
литературными источниками [2], приведены в таблице 13. В интервале
температур
в сопоставлении с
литературными источниками [2], приведены в таблице 13. В интервале
температур ![]() справедливы
функции
справедливы
функции
 (77)
(77)
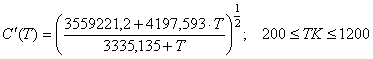 (78)
(78)
Таблица 13
Результаты расчета энтальпии
образования ![]() и приведенной энергии Гиббса
и приведенной энергии Гиббса ![]() монооксида магния
монооксида магния ![]() по уравнениям (71) и (74)
по уравнениям (71) и (74)
|
ТК |
(расчет) |
(расчет) |
(расчет) |
(расчет) |
[2] |
(расчет) |
[2] |
(расчет) |
[2] |
|
Дж/моль
|
Дж/моль
К |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
400 |
15447,496 |
270,5 |
6207,247 |
9270,25 |
9271,0 |
38,619 |
38,772 |
15,443 |
15,594 |
|
500 |
24316,24 |
337 |
10609,585 |
13706,655 |
13700,0 |
48632 |
48,644 |
21,219 |
21,243 |
|
600 |
34270,595 |
405,5 |
15930,311 |
18340,28 |
18349,0 |
57,118 |
57,115 |
26,551 |
26,533 |
|
700 |
45153,251 |
475,3 |
22020,24 |
23133,0 |
23143,0 |
64,505 |
64,503 |
31,458 |
31,441 |
|
800 |
56835,171 |
546,0 |
28769,794 |
28065,38 |
28045 |
71,044 |
71,046 |
35,962 |
35,99 |
|
900 |
69221,12 |
618 |
36165,293 |
33055,83 |
33030 |
76,912 |
76,918 |
40,183 |
40,217 |
|
1000 |
82237,239 |
691 |
44139,45 |
38097,79 |
38086 |
82,237 |
82,243 |
44,139 |
44,158 |
|
1100 |
95824,374 |
764,5 |
52603,117 |
43221,26 |
43201 |
87,113 |
87,119 |
47,82 |
47,845 |
|
1200 |
109933,84 |
838,8 |
61561,776 |
48372,05 |
48371 |
91.653 |
91,617 |
51,343 |
51,307 |
|
1300 |
124524,72 |
917,74 |
71486,05 |
53038,7 |
53590 |
95,788 |
95,794 |
54,989 |
54,571 |
|
1400 |
139562,22 |
993,32 |
81349,36 |
58212,86 |
58856 |
99,687 |
99,696 |
58,106 |
57,656 |
|
1500 |
155016,24 |
1068,9 |
91540,715 |
63475,53 |
64168 |
103,344 |
103,361 |
61,027 |
60,582 |
|
2000 |
237713,04 |
1446,8 |
146744,56 |
90968,5 |
91426 |
118,856 |
119,027 |
73,371 |
73,314 |
|
2500 |
327893,17 |
1824,7 |
207770,63 |
120122,54 |
120118 |
131,157 |
131,818 |
83,768 |
83,771 |
|
3000 |
424081,41 |
2201 |
273163,22 |
150918,19 |
150960 |
141,36 |
143,05 |
92,743 |
92,73 |
Расчеты по уравнениям (77),
(78) приведены в таблице 14 в сопоставлении с данными литературных
источников [2].
Таблица 14
Результаты расчета энтальпии
образования ![]() и приведенной энергии
Гиббса
и приведенной энергии
Гиббса ![]() монооксида магния
монооксида магния ![]() по уравнениям (72) и
(73).
по уравнениям (72) и
(73).
|
ТК |
(расчет) |
(расчет) |
(расчет) |
(расчет) |
(расчет) |
[ 2 ] |
|
Дж/моль |
Дж/моль К |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
100 |
34,034 |
123 |
2,59 |
1,2292 |
1,36 |
0,580 |
|
200 |
35,2745 |
1936,09 |
13,028 |
9,68 |
3,348 |
4,230 |
Продолжение таблицы 14
|
ТК |
(расчет) |
(расчет) |
(расчет) |
(расчет) |
(расчет) |
[ 2 ] |
|
Дж/Моль |
Дж/Моль К |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
300 |
36,408 |
5252,947 |
26,852 |
17,51 |
9,342 |
9,751 |
|
400 |
37,449 |
9278,5 |
38,69 |
23,196 |
15,494 |
15,594 |
|
500 |
38,41 |
13688,707 |
48,632 |
27,377 |
21,255 |
21,243 |
|
600 |
39,3 |
18335,1 |
57,117 |
30,559 |
26,558 |
26,533 |
|
700 |
40,128 |
23137,666 |
64,504 |
33,053 |
31,451 |
31,441 |
|
800 |
40,9 |
28048,75 |
71,044 |
35,061 |
35,983 |
35,99 |
|
900 |
41,622 |
33037,354 |
76,912 |
36,708 |
40,204 |
40,217 |
|
1000 |
42,3 |
38082,98 |
82,237 |
38,083 |
44,154 |
44,158 |
|
1100 |
42,937 |
43171,377 |
87,113 |
39,247 |
47,866 |
47,845 |
|
1200 |
43,5373 |
48292,4 |
91,611 |
40,2437 |
51,367 |
51,307 |
Предложенный метод расчета
термодинамических характеристик веществ отличается от общепринятых методов
своей простотой и не нуждается в большинстве случаев в использовании функций
Шомейта [2] для согласования данных по энтальпии и теплоемкости, полученных
по данным эксперимента при высоких и
низких температурах
Предложенный метод расчета
термодинамических характеристик веществ на базе используемых уравнений (13),
(18), (50), (60) отличается от общепринятых методов своей простотой и не
нуждается в большинстве случаев в использовании функций Шомейта
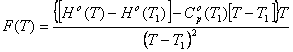 (79) для увязки экспериментальных
данных энтальпии и теплоемкости при высоких и низких температурах и в связи с
этим нет необходимости использовать аппроксимационных уравнений четырех типов
для определения их коэффициентов
(79) для увязки экспериментальных
данных энтальпии и теплоемкости при высоких и низких температурах и в связи с
этим нет необходимости использовать аппроксимационных уравнений четырех типов
для определения их коэффициентов
![]()
![]()
![]()
![]() ,
(80) которые позволяют рассчитать коэффициенты уравнения, предложенного Мейером
и Келли [6] или полиномов вида
,
(80) которые позволяют рассчитать коэффициенты уравнения, предложенного Мейером
и Келли [6] или полиномов вида
![]()
![]()
![]() (81)
(81)
с использованием дополнительных соотношений
![]()
![]()
![]()
![]() (82) Из уравнений (79) – (82) видим, что для согласования экспериментальных
данных вводится большое число расчетных величин, что усложняет обработку
экспериментального материала. В предложенном методе, как правило, используется при обработке экспериментального
материала сравнительно меньшее число постоянных величин.
(82) Из уравнений (79) – (82) видим, что для согласования экспериментальных
данных вводится большое число расчетных величин, что усложняет обработку
экспериментального материала. В предложенном методе, как правило, используется при обработке экспериментального
материала сравнительно меньшее число постоянных величин.
ВЫВОД Ы
1. Рассмотрена возможность внутренней
согласованности уравнения энтропии
Бозе-Эйнштейна (1), и Ферми-Дирака (2), с
предложенным в работе [3],
уравнением энтропии (13), из которой вытекает новая интерпретация
изобарной теплоемкости в форме ![]() , связанной с функцией
, связанной с функцией
![]() предложенной в работе
[4].
предложенной в работе
[4].
2. Фундаментальный характер уравнения
(13) основан не только на результатах расчета молярных энтропий и изобарной
теплоемкости простых и сложных соединений и хорошей сходимостью с данными литературных
источников [2,5], но и на соблюдении основополагающего, фундаментального соотношения ![]() (см. табл.1-5).
(см. табл.1-5).
3.
Найдены уравнения (60), (65)
энтальпии образования веществ ![]() , на базе уравнений (13), (38) дают хорошую сходимость с
данными литературных источников
(см.табл. 11,14) и показывает, что при
, на базе уравнений (13), (38) дают хорошую сходимость с
данными литературных источников
(см.табл. 11,14) и показывает, что при ![]() ;
; ![]() , что дополняет третий закон термодинамики.
, что дополняет третий закон термодинамики.
ЛИТЕРАТУРА
1. В.К Семенченко. Избранные главы теоретической физики. Изд.
«Просвещение».М.1966.
2. В.П. Глушко, Л.В. Гуревич, Г.А.
Бергман и др. Термодинамические свойства индивидуальных веществ. «Наука», М. 1978.
3. Федоров С.В. Термодинамические
особенности расчета изобарной теплоемкости и энтропии простых веществ. СПб ГПУ.
Материалы ХII Международной конференции, т.1., 294-299, 2005.
4. С.В. Федоров. Уравнение теплового
баланса и новые принципы расчета изобарной теплоемкости простых веществ. СПб
ГПУ. Материалы ХII Международной конференции, т.1., 290-294.
5. Киреев В.А. Методы практических
расчетов в термодинамике химических реакций. М. Изд. Химия, 1975.
6.
Maier C.G., Kelley K.K. – “ j. Amer.
Chem. Soc” 1932, 54,3243.