Біологічні науки
/ 6. Мікробіологія
Кащик
О.О., Сідашенко О.І., Воронкова О.С., Вінніков А.І.
Дніпропетровський
національний університет ім. Олеся Гончара
ВПЛИВ ІОНІВ МЕТАЛІВ НА ПЛІВКОУТВОРЕННЯ У ЕПІДЕРМАЛЬНОГО СТАФІЛОКОКА
Вступ
Аж до кінця минулого століття
мікробіологія розвивалась головним чином на основі досліджень чистих культур
мікроорганізмів. На сьогоднішній день відомо, що більшість бактерій існують в
природі не у вигляді вільних клітин, а у вигляді специфічно організованих
біоплівок [3, 10]. Біоплівка (Biofilm) – складний (найчастіше мультивидовий) шар
мікроорганізмів, що володіє просторовою та метаболічною структурою
співтовариства (колонія) мікроорганізмів, розташованих на поверхні розділу
середовищ і занурених у позаклітинний полімерний матрикс [5, 11]. Біоплівки
поширені повсюдно. Майже всі види мікроорганізмів, не тільки бактерії і археї
мають механізми, за допомогою яких вони можуть осідати на поверхні і агрегуватися
один до одного [2,4].
Мікробне угруповання біоплівки
більш стійке до впливу несприятливих чинників фізичної, хімічної та біологічної
природи. Порівняно з вільно плаваючими бактеріями, біоплівки виявилися дуже
стійкими до впливу ультрафіолетового випромінювання, дегідратації, вірусів,
антибіотиків і факторів імунного захисту. До того ж у складі плівки бактерії
набувають більшої стійкості до умов довкілля
[7, 9]. Тому вивчення впливу факторів зовнішнього середовища на
формування біоплівки є актуальним питанням сучасних біології та медицині.
Метою роботи
було вивчити
вплив іонів металів на формування біоплівки
у Staphylococcus epidermidis.
Матеріали та методи досліджень
Дослідження впливу
концентрації іонів металів на характеристики росту біоплівки проводили шляхом
вирощування біоплівки на середовищі з 0,5%, 1% та 2% глюкози. В якості контролю
виступало живильне середовище (МПБ) без додавання іонів металів. Для
дослідження готували МПБ з різними концентраціями іонів калію та натрію: 5%,
10% та 15% розчини KNO3 та NaCl.
Біоплівки
культивували у 6-лунковому планшеті, куди вносили 2 мл середовища з
досліджуваними концентраціями солей. Засівали 100 мкл бактеріальної суспензії
біоплівкоутворюючого штаму, що містила 1,0 × 104 клітин / мл.
Інкубували 5 діб.
Вивчення впливу іонів металів на ріст біоплівки
Вплив іонів К+ на
утворення біоплівки S. epidermidis визначали за
змінами кількості колонієутворюючих одиниць (КУО), що виросли у плівці
культивованій протягом 5 діб. Контроль
(без додавання солі) склав – 6,9×107 КУО, при додаванні 5% солі калію (KNO3) кількість клітин становила 6,7×108 КУО, 10% – 3,8×108 КУО, 15%
– 3,4×107 КУО (рис. 1).
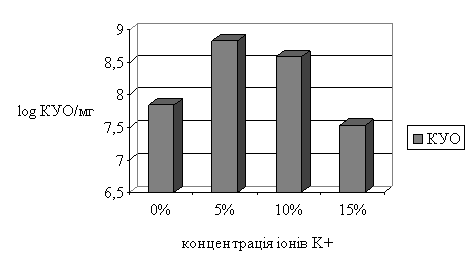
Рис. 1 Динаміка приросту біоплівки при впливі іонів К+
З приведених на діаграмі даних
можна зробити висновок, що 5% та 10% концентрації солі – донора іону K+ здійснювали стимулюючий вплив на розвиток біоплівки, а 15% концентрація,
навпаки, інгібувала приріст клітинної масти порівняно з контролем.
Вплив іонів Na+ на утворення біоплівки
епідермального стафілококу вивчали за змінами кількості КУО у плівці, яку
культивували протягом 5 діб з додаванням солі натрію (NaCl). У контролі кількість КУО складала –
6,9×107
КУО. При використанні 5% концентрації солі вміст клітин у плівці становив
6,7×108 КУО, при 10% – 3,8×108 КУО, 15% –
3,4×107 КУО (рис. 2). Результати
дослідів показали, що кількість колоній була максимальною при 5% концентрації Na+, а найменше значення при
15%.
Стійкість і невибагливість стафілококів проявляється в
тому, що вони розмножуються в присутності високих концентрацій хлориду натрію
(до 10-15%). Саме ця властивість експериментально підтверджується, аналізуючи отримані данні.
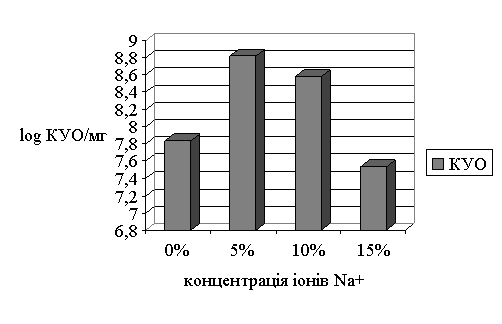
Рис. 2 Динаміка приросту біоплівки під впливом різних концентрацій Na+
Про кількісні показники приросту
біоплівки робили висновок, що максимальне значення КУО спостерігали при 5%
концентрації К+, 10% – проміжне значення, а 15%
концентрація інгібувала приріст біоплівки.
Висновки
1. Встановлено, що при культивуванні біоплівки протягом 5
діб на 1 мл середовища приріст клітин становить 6,9 × 107 КУО.
2. Встановлено, що 15% концентрація іонів Na+
та К+ інгібує приріст клітин у біоплівці порівняно із середовищем
без додавання цих іонів. Натомість, при 5% та 10% вмісті солей натрію та калію
у середовищі спостерігали приріст кількості клітин у біоплівці.
Перелік посилань:
1.
Определитель бактерий Берджи: Пер. с англ. / Под ред. Хоулта Дж., Криля Н.,
Синта П. и др. в 2-х тт. – М: Мир, 1997. – Т.1 – 430 с.; Т.2 – 368 с.
2.
Adherence of coagulasenegative staphylococci to plastic tissue culture
plates: a quantitative model for the adherence of staphylococci to medical
devices /
G.D.
Christensen, W.A. Simpson, J.J. Younger [et. al.] // J. Clin. Microbiol. – 1985. – Vol. 22. –P. 996-1006.
3.
Costerton J.W. Microbial biofilms / J.W. Costerton // Ann. Rev.
Microbiol. – 1995. – Vol. 49. – P. 711–745.
4. Costerton W.
Bacterial biofilm: a common cause of persistent infections / W. Costerton,
P.S. Steward, E.P. Greenberg //
Science. – 1999. – P. 1318-1322.
5.
Gotz F. Staphylococcus and biofilms / F. Gotz // Mol. Microb. – 2002. –
Vol. 43, №6. – P. 1367–1378.
6.
Methods for studying biofilms produced by Staphylococcus epidermidis / M.A. Deighton, J.
Capstick, E. Domalewski [et. al.] // Methods Enzymol. – 2001. – Vol. 336. – P. 177-195.
7.
O’Toolе G.A. Biofilm formation as
microbial development /
G.A. O’Toolе, H.B. Kaplan, R. Kolter // Ann Rev Microbiol. – 2000. – Vol. 54. – P. 49-79.
9. Tetz V.V.
Extracellular phospholipids of isolated bacterial communities. Biofilms / V.V.
Tetz // Med Microbiol: Lett. – 2004. – Vol. 1. – P. 149-55.
10. Watnick P. Biofilm: city of microbes / P. Watnick, R. Kolter // J. Bacteriol. – 2000. – Vol. 72. – P.
2675-9.
11. Wolcott R.D. Biofilm / R.D. Wolcott, G.D. Ehrlich // JAMA. – 2008. – Vol. 299. – 2682 p.