Біологічні науки/5.Молекулярна біологія
Семесюк Н.І., Рудик М.П., Позур В.В., Позур В.К., Кокозей
В.М., Сківка Л.М.
Київський національний університет імені Т.Г.Шевченка, біологічний
факультет, м. Київ
Імуномодулюючий вплив гетерополіядерних
сполук перехідних металів
Багато соматичних, психічних та інфекційних
захворювань супроводжуються статистично достовірними порушеннями загальної
картини оптимальних концентрацій різних мікроелементів на субклітинному,
клітинному й органному рівнях. В останні десятиріччя достеменно встановлено
незамінність так званих біометалів у механізмах нормального функціонування
систем організму й змінах гомеостазу, які супроводжуються чи викликаються
аномаліями вмісту необхідних металів [1]. Між тим,
перехідні або d-метали ( які за
ендогенним вмістом відносять до мікроелементів) вважаються основними факторами
структуроутворення та функціонування активних центрів більшості ферментів [2]. Велика
кількість важливих ферментних систем міститься у фагоцитуючих клітинах. Тому
саме за належного стану ферментних систем фагоцитів і відбувається
реалізація функцій останніх у захисті
організму від чужорідних агентів.
Комплексні сполуки - найбільший і найрізноманітніший клас природних і
синтетичних сполук. При взаємодії речовин спостерігається взаємна координація
їх частинок, що супроводжується переносом електронних пар і призводить до
утворення чи руйнування сполук вищого порядку, які називають комплексними або
координаційними сполуками. Особливістю комплексних сполук є наявність у них координаційного зв’язку, який
виникає за донорно-акцепторним механізмом між комплексоутворювачем і лігандами.
Здатність лігандів до координації залежить від наявності
в них атомів або груп з неподіленими парами електронів, через які здійснюється
зв’язок з центральним атомом. Сполуки, до складу яких входять два і більше центральних атоми називаються
поліядерними координаційними сполуками [3].
d-елементи утворюють найбільш стійкі і різноманітні
комплекси за складом і функціями, які вони виконують. Особливо важливе значення
мають комплексні сполуки таких перехідних металів: заліза, марганцю, кобальту,
міді, цинку і молібдену, які виступають в якості комплексоутворювачів [4].
В дослідах використовували
нелінійних білих мишей розводки віварію біологічного факультету КНУ імені
Тараса Шевченка, самців віком 2-3 місяці, середньої ваги 24-26г. Експериментальними
речовинами виступали гетерополіядерні комплексні сполуки (ГПЯК) перехідних
металів РО39 [Cu(en)2ZnCl4]*dmso і PO252 [Cu(en)2CdBr4]*dmso, синтезовані на хімічному факультеті КНУ
імені Тараса Шевченка. В роботі використовували водні розчини препаратів.
Дослідження проводились in vitro. На першому етапі проводилась оцінка впливу ГПЯК на життєздатність перитонеальних
макрофагів (МФ) мишей. Препарати комплексних сполук додавали в середовище
культивування у 5-ти різних концентраціях (0,04 мг/мл, 0,08 мг/мл, 0,16 мг/мл,
0,24 мг/мл, 0,32 мг/мл) та інкубували протягом 3 год. Токсичний вплив
характеризували, оцінюючи життєздатність макрофагів в тесті з трипановим синім [5].
Гетерополіядерні
комплекси РО39 і РО252 проявляли помірний цитотоксичний вплив на перитонеальні
макрофаги мишей, який мав дозозалежний характер. Виразність ефекту зберігалась
із збільшенням терміну інкубації. Координаційна сполука РО39 у середніх
концентраціях (0,08 мг/мл і 0,16 мг/мл) і комплекс РО252 у максимальній
концентрації (0,32 мг/мл) здійснювали найвиразніший негативний вплив на
життєздатність клітин.
На другому етапі досліджень
здійснювалась оцінка впливу ГПЯК на цитотоксичну активність макрофагів з
використанням 3-х різних концентрацій (0,08 мг/мл, 0,16мг/мл, 0,32 мг/мл).
Комплекси додавали до суспензії клітин з концентрацією 4*106/ мл та інкубували протягом
30 хв. Після цього проводили тестування цитотоксичної активності фагоцитів в
НСТ-тесті як з використанням класичного активатора кисеньзалежного метаболізму
фагоцитів – форболмеристатацетатом (ФМА), так і без нього .
Як показали результати
досліджень (рис.1) комплексні сполуки РО252 і РО39 спричиняли стимулюючий ефект
на спонтанну цитотоксичну активність макрофагів. Рівень активації, спричиненої
гетерополіядерними комплексами, був порівняний з таким при застосуванні
форболового ефіру.
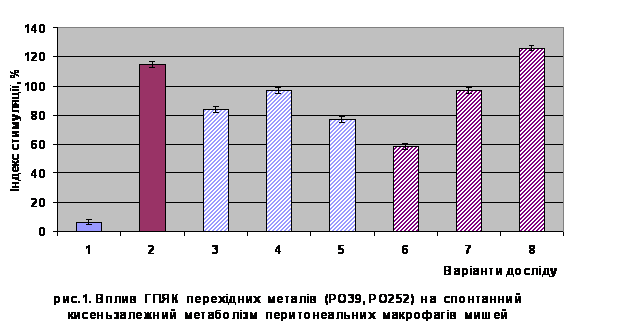
1 – контроль спонтанний
2 – контроль стимульований
(ФМА)
3 – МФ оброблені РО39 (0,08
мг/мл)
4 – МФ оброблені РО39 (0,16 мг/мл)
5 – МФ оброблені РО39 (0,32
мг/мл)
6 – МФ оброблені РО252 (0,08
мг/мл)
7 – МФ оброблені РО252 (0,16
мг/мл)
8 – МФ оброблені РО252 (0,32
мг/мл)
Комплексна сполука РО252 стимулювала спонтанну метаболічну
активність фагоцитів у дозозалежний спосіб.
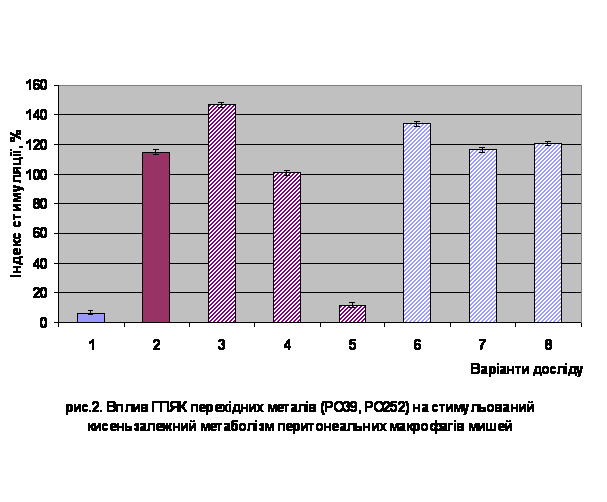
Комплексні сполуки, використані в
даній роботі, були здатні чинити костимуляторний вплив на цитотоксичну
активність перитонеальних макрофагів при їх сумісному застосуванні з класичним
активатором кисень- залежного метаболізму – форболмеристатацетатом (рис.2).
1 –
контроль спонтанний
2 – контроль стимульований
(ФМА)
3 – стимульовані МФ+РО39 (0,08
мг/мл)
4 – стимульовані МФ+РО39 (0,16мг/мл)
5 – стимульовані МФ+РО39 (0,32 мг/мл)
6 – стимульовані МФ+РО252
(0,08 мг/мл)
7 – стимульовані МФ+РО252 (0,16 мг/мл)
8 – стимульовані МФ+РО252 (0,32 мг/мл)
При цьому костимуляторну дію
чинили обидві координаційні сполуки у низьких концентраціях. Підвищення
концентрації препаратів супроводжується гальмуванням стимульованого ФМА “дихального
вибуху” фагоцитів, більш виразного у випадку РО39.
Таким чином, гетерополіядерні
комплекси РО39 і РО252 посилюють як спонтанний, так і стимульований кисеньзалежний
метаболізм перитонеальних макрофагів мишей . Характер активуючої дії
досліджених сполук відрізняється, що, ймовірно, обумовлено відмінностями
хімічної будови комплексів. Кисеньзалежний метаболізм, крім макрофагів,
притаманний ще цілому ряду клітин-ефекторів неспецифічної резистентності:
моноцитам, нейтрофілам, природним кілерам. Отримані результати дають підставу
для дослідження впливу гетерополіядерних сполук перехідних металів на
функціональну активність цих популяцій клітин.
Література
1. Григор’єва Г.С., Киричок Л.М. Координаційні сполуки d-перехідних металів // Современные проблемы
токсикологии. – 1998 - №1 – с.21-24.
2. Видавская А.Г., Кресюк В.И., Сейфулина И.И. Фармакологические параметры одночастевых моделей нового биологически активного вещества – координационного соединения ОЭДФ с германием и никотинамидом // Теоретична і експериментальна медицина. – 2002. - №2 – с.25-27.
3. Карнаухов О.І., Копілевич В.А., Мельничук
Д.О. Загальна хімія, підр.- Київ: Фенікс, 2005.
4. Под ред. Яцимирского К.Б. Биологические аспекты координационной химии. –Киев: Наук.думка, 1979. –266с.
5.
Дж.
Клаус Лимфоциты. Методы: Пер. с англ.-
М.: Мир, 1990, 393с.
Семесюк Надія
Іванівна (1986 р.н.) – студент кафедри мікробіології та загальної імунології
біологічного факультету Київського національного університету імені
Т.Г.Шевченка.
Адреса:
Контактний
телефон: +380971946269.
Електронна
скринька: nadijka@inbox.ru
Рудик Марія
Петрівна (1984 р.н.) – аспірант кафедри мікробіології та загальної імунології
біологічного факультету Київського національного університету імені
Т.Г.Шевченка.
Позур Валентина
Володимирівна (1983 р.н.) – аспірант кафедри мікробіології та загальної
імунології біологічного факультету Київського національного університету імені
Т.Г.Шевченка.
Позур Володимир
Костянтинович(1948 р.н.) – доктор біологічних наук, професор, завідувач кафедри
мікробіології та загальної імунології біологічного факультету Київського
національного університету імені Т.Г.Шевченка.
Кокозей Володимир
Миколайович (1953 р.н.) – доктор хімічних наук, професор, завідувач
науково-дослідної лабораторії біологічно активних речовин хімічного факультету
Київського національного університету імені Т.Г.Шевченка.
Сківка Лариса
Михайлівна (1964 р.н.) – кандидат біологічних наук, асистент кафедри
мікробіології та загальної імунології біологічного факультету Київського
національного університету імені Т.Г.Шевченка.