Біологічні
науки/6. Мікробіологія
Рудик М.П.,
Позур В.В., Сківка Л.М., Сенчило Н.В., Позур В.К.
Київський
національний університет імені Тараса Шевченка, кафедра мікробіології та
загальної імунології, Україна
Вплив тейхоєвої кислоти Staphylococcus aureus WOOD 46
на функціональну активність природних
кілерів мишей
в нормі і при пухлинному рості
Бактерії та їх субклітинні компоненти вже близько 100 років
застосовуються в терапії хворих зі
злоякісними пухлинами, зокрема, в якості додаткових компонентів, що посилюють
імуногенність вакцинних препаратів. Однак, пошук бактеріальних адьювантів
триває, про що свідчать літературні дані.
Тейхоєві кислоти (ТК) – одні із основних компонентів клітинної стінки
грампозитивних мікроорганізмі. За
типом поліолу, що входить до складу полімеру, тейхоєві кислоти поділяють на
рибіттейхоєві та гліцеролтейхоєві кислоти. За останні роки найбільш широко
досліджено біологічну дію ТК, зв’язаних із гліколіпідом цитоплазматичної
мембрани, – ліпотейхоєвих кислот
(ЛТК). ЛТК є сильним ендотоксином, здатним викликати під час
бактеріальних інфекцій серйозні порушення в організмі та призводити до
септичного шоку [1,2,3]. Відомості стосовно імуномодулюючих властивостей
рибіттейхоєвих кислот, які використовувались нами, практично відсутні. Здатність
ТК спричиняти запальну імунну відповідь знаходить використання в клінічній
практиці при патологічних станах, лікування яких потребує імунокорекції, в тому
числі і при онкологічних патологіях. Метою роботи було, дослідити вплив ТК S. aureus Wood 46 на функціональну
активність природних кілерів мишей в нормі та при пухлинному рості.
Природні кілери є важливою ланкою протипухлинного імунітету. В спектр їхніх
функцій входять контроль появи та неспецифічне знищення
злоякісно-трансформованих власних клітин організму в основному за
перфорин-гранзимним механізмом [4].
Дослідження проведені на мишах лінії
С57/Black, самицях віком 2-3 місяці, середньої ваги 24-26 г. Тейхоєву кислоту отримували із клітинних
стінок бактерій штаму Staphylococcus aureus Wood 46 за методикою
Арчібальда [5], шляхом обробки клітинних стінок 10% трихлороцтовою кислотою. В якості експериментальної пухлини використовували
перещеплювану метастазуючу карциному легені Л′юїс (3LL) у вигляді
20% клітинної суспензії. ТК
вводили у дозах 0,5мкг/г, 2мкг/г,
1мкг/г, одночасно з
трансплантацією пухлинних клітин, в ділянку
крижового відділу. Інтактним тваринам ТК вводили аналогічним способом. Цитотоксичну активність природних кілерів мишей
досліджували за допомогою методу проточної цитофлюориметрії, за здатністю
мононуклеарних спленоцитів лізувати клітини сингенної пухлини [6]. Реакція проводилась на момент закінчення експерименту
(35 доба після перещеплення експериментальної пухлини). Цей період пухлинного
росту характеризується метстазуванням карциноми легені Л’юїс і загибеллю тварин.
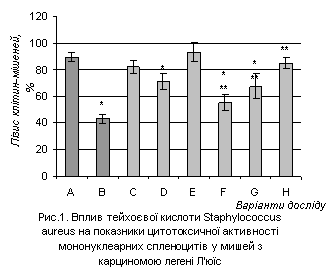 Існує
певна залежність між показниками цитотоксичної активності мононуклеарних
спленоцитів мишей і дозою, введеної їм, ТК (рис.2). Відмічався інгібуючий вплив
препарату на цю ланку імунітету у тварин без пухлини.
Існує
певна залежність між показниками цитотоксичної активності мононуклеарних
спленоцитів мишей і дозою, введеної їм, ТК (рис.2). Відмічався інгібуючий вплив
препарату на цю ланку імунітету у тварин без пухлини.
A –
контрольні інтактні тварини, n=5;
B –
контрольні тварини-пухлиноносії, n=5;
С
– тварини, що отримали ТК у дозі 0,5мкг/г,
n=5;
D –
тварини, що отримали ТК у дозі 1мкг/г, n=5;
E –
тварини, що отримали ТК у дозі 2мкг/г, n=5;
F – тварини-пухлиноносії, що отримали ТК у дозі 0,5мкг/г, n=5;
H–
тварини-пухлиноносії, що отримали ТК у дозі 1мкг/г, n=5;
G –
тварини-пухлиноносії, що отримали ТК у дозі 2мкг/г, n=5;
Примітка: * - P<0,05 в порівнянні з
контрольними здоровими тваринами;
** - P<0,05 в порівнянні з контрольними
тваринами-пухлиноносіями
Однак, у всіх групах мишей з пухлиною, які отримували ТК, здатність
спленоцитів лізувати клітини-мішені була достовірно вищою в порівнянні з цим
показником у контрольних мишей-пухлиноносіїв. Найбільша доза ТК (2мкг/г),
характеризувалася найсильнішим впливом і підвищувала кілерну активність
мононуклеарів до контрольних рівнів. Слід зазначити, що показники цитотоксичної
активності природних кілерів характеризувались значною індивідуальною
варіабельністю.
Література:
1. 1.Bhakdi, S., T. Klonisch, P. Nuber, and W. Fischer. Stimulation of monokine production by
lipoteichoic acids// Infect. Immun. – 1991. – Vol.59. –
P.4614-4620.
2. Gao J.J., Xue Q.,. Zuvanich E.G,.
Haghi K.R,
Morrison D.C Commercial preparations
of lipoteichoic acid contain endotoxin that
contributes to activation of mouse macrophages in
vitro // Infect. Immun. – 2001. – Vol. 69, N 2. – P.751-757.
3. Levels J.H.M., Abraham P.R., van
Barreveld E.P., Meijers J.C.M., van Deventer S.J.H. Distribution
and kinetics of lipoprotein-bound lipoteichoic acid // Infect. Immun. – 2003. –
Vol.71(6). - P.3280-3284.
4. Okamoto
M., Ohe G., Furuichi S., Nishikawa H., Oshikawa T., Tano T., Ahmed S.U.,
Yoshida H., Moriya Y., Matsubara S., Ryoma Y., Saito M., Sato M. Enhancement of anti-tumor immunity by lipoteichoic acid-related
molecule isolated from OK-432, a streptococcal agent, in athymic nude mice
bearing human salivary adenocarcinoma: role of natural killer cells // Anticancer Res. – 2002. – Vol.22(6A). –
P.3229-3239.
5.
Арчибальд А.Р. Методы исследования углеводов. – М: ”Выс. школа”, 1975. – 350 с.
6. Vitale M., Caruso A., Licenziati
S. // Cytometry – V.39. – P. 189-194.