Биологические науки /9.Биохимия, биофизика.
Преображенская Ю.В.1, Стенько А.И.
1, Луговцев В.Ю.2, Мойсеенок А.Г.3, Мандрик К.А.
1
· 1Гродненский
государственный университет им. Я. Купалы, Гродно, Беларусь;
2Food and Drug Administration, Бетесда, США;
3НПЦ биохимии и фармакологии, Гродно,
Беларусь.
· Стехиометрия
связывания АТФ и его производных рекомбинантной селенофосфатсинтетазой и её каталитически
неактивным мутантом С17S
Универсальным донором селена в клеточных процессах как у прокариот, так и эукариот служит
селенофосфат, образование которого катализируется селенофосфатсинтетазой (СФС),
у бактерий - продуктом гена selD [1]. Этот АТР-зависимый белок
осуществляет реакцию превращения АТР и селенида в селенофосфат, АМР и
ортофосфат в стехиометрическом соотношении 1: 1: 1 [2, 3]:
ATP + HSe- + H2O
→ H2SePO3- + AMP + Pi .
Ранее было показано, что СФС
проявляет АТФазную активность в отсутствие в среде ионов селена, и конечные
продукты реакции – АМФ и Фн – совпадают с таковыми в реакции, идущей
с участием селенида [2]. Нами использовался гомогенный препарат селенофосфат-синтетазы
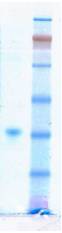
(СФС), полученный после стадии иммуноаффинной хроматографии (Рис 1). Наблюдаемая
полоса соответствует белку с Mr ~38 кДа, что согласуется с
полученными ранее данными для СФС из E.coli.
 Экспрессионная система для СФС из
E. coli была создана на основе плазмиды
для сверхэкспрессии pET11a (Stratagene, США).
Экспрессионная система для СФС из
E. coli была создана на основе плазмиды
для сверхэкспрессии pET11a (Stratagene, США).
Рис.1.
ДСН-Электрофорез СФС в ПААГ.Окраска Кумасси Brilliant BlueG. Маркеры SeeBlue® Plus Pre-Stained Standard.
Определялась
АТФазная активность СФС в отсутствие селена в реакционной смеси. Реакция
проводилась в 0,1 М К-трициновом буфере при 37˚С и при концентрации
фермента 37 мкМ. Затем реакционную смесь нагревали до 95˚С, ставили в лед
и фильтровали перед нанесением на колонку для ВЭЖХ. Проводили разгонку
образующихся нуклеотидов на колонке с реверсионной фазой С18, используя
оборудование для ВЭЖХ фирмы Agilent 1100. По улучшенной нами
методике разгонки нуклеотидов ацетонитрилом (линейный градиент 0→5 %) пик
АМФ как конечного продукта реакции хорошо отделяется от других пиков, АДФ и
остатка субстрата (АТФ) (Рис 2).
Рис.2. Хроматограмма
разгонки нуклеотидов АТФ, АДФ и АМФ с помощью ВЭЖХ (Agilent
1100).
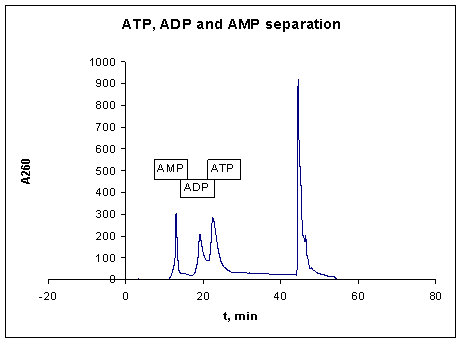

Наличие пика АДФ говорит о том,
что, возможно, существует промежуточная стадия реакции, где АДФ является
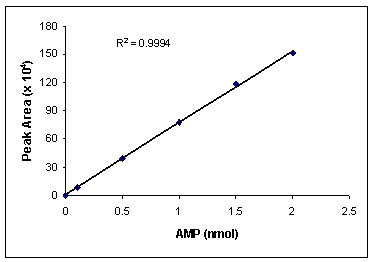
интермедиатом. Калибровка по АМФ представляет собой линейную зависимость
АТФазной активности фермента от концентрации продукта, значит, активность можно
определять по образующемуся АМФ (Рис 3). Активность фермента в данных условиях
определения составляла 34 нмоль/мин*мг. Было выявлено наличие конкурентного
замещения флуоресцентного производного АТФ, ТНФ-АТФ, в активном центре
селенофосфатсинтетазы АТФ с IC50 = 0,46 мМ, что свидетельствует о
возможности его использования для определения количества АТФ-связывающих сайтов
фермента. Нами была исследована стехиометрия связывания АТФ с молекулой СФС с
помощью флуоресцентного производного АТФ, ТНФ-АТФ для рекомбинантной СФС с
одной синонимической заменой, дикого типа. Итоговым значением соотношения
оказалось 2:1 (моль/моль) субстрат:фермент соответственно, полученные
графическим способом из графика Скетчарда (не показано). Известно, что
мутантный белок СФС С17S каталитически неактивен и
способен только к гидролизу АТФ [4]. Созданный нами на основе той же плазмидной
конструкции, данный мутант показал способность к связыванию ТНФ-АТФ 1:1
(моль/моль).
Рис. 3. Калибровочный
график для определения количества АМФ после разгонки с помощью ВЭЖХ.
Методом аналитической гель-фильтрации исследовали монодисперсность
(однородность) фракции нативной рекомбинантной СФС и неполнофункциональной мутантной формы С17S фермента на колонке для ВЭЖХ TSK - S2000 SW. При этом проводили реакцию
связывания с субстратом АТФ, чтобы контролировать реакционную способность, и,
таким образом, функциональную конформацию белковой молекулы. Реакцию связывания
вели в среде 100 мM Tricine-KOH, pH 8,0, 30 мM KCl, 0,5 мM дитиотреитол (DTT), 4 мM MnCl2, соответствующий белок перед нанесением на колонку
инкубировали с [14САТФ] в течение 10 мин. Если для нативной СФС в
данных условиях реакции получили разделение белкового пика на две фракции, что
может свидетельствовать о неоднородности СФС в реакционных условиях, то для ее
мутанта С17S, как видно из приведенной
хроматограммы (Рис.4), белковый пик совершенно однороден. При этом молекула мутанта
С17S, неспособного катализировать
основную реакцию СФС – образование селенофосфата, связывает субстрат АТФ в соотношении: АТР : фермент = 9,52
нмоль : 7,0 нмоль. 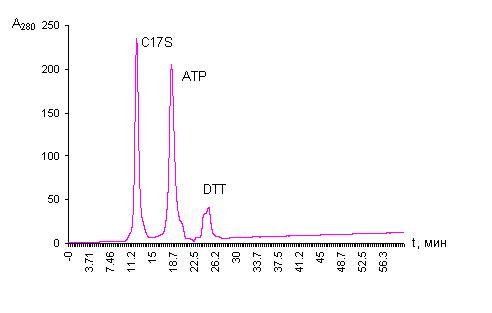 В связи с этим, приведенные в
статье [5] весьма показательные данные кристаллографии для С17S, кристаллизующегося в форме димера, очевидно, относятся
только к кристаллической форме протеина. В реакционных условиях
неполнофункциональный мутант является мономером. В связи с этим, требуется
дальнейшее изучение взаимосвязи функции и конформации СФС.
В связи с этим, приведенные в
статье [5] весьма показательные данные кристаллографии для С17S, кристаллизующегося в форме димера, очевидно, относятся
только к кристаллической форме протеина. В реакционных условиях
неполнофункциональный мутант является мономером. В связи с этим, требуется
дальнейшее изучение взаимосвязи функции и конформации СФС.
Рис.4.
Аналитическая гель-фильтрация методом ЖХВД на
колонке TSK - S2000
SW. 1 –белок, 2 – АТР, 3 –
дитиотреитол
Литература:
1.
Hirosava-Takamori
M., Jaecle H., Vorbruggen G. (2000). EMBO reports,1, 441-446.
2.
Veres, Z., Kim, I.Y., Scholz, T.D., and Stadtman, T.C (1994) J. Biol. Chem.,
269, 10597–10603.
3.
Lacourciere, G.M., Mihara, H., Kurihara, T., Esaki, N., and Stadtman, T.C. (2000) J. Biol. Chem., 275,
23769–23773.
4.
Kim, I.Y., Veres, Z., Stadtman, T.C. (1992) J. Biol. Chem.,
267, 19650–19654.
5.
Noinaj N., et
al. (2012) J.Bacteriol., 194, 499-508.