К.т.н. Колесников А.С., д.т.н. Шевко В.М., д.т.н.
Капсалямов
Б.А.,
Аринова Д.Б., Колесникова О.Г., Кадишаев
Н.Ж., Ишанкулов Р.
РГКП «Южно-Казахстанский государственный университет
им. М. Ауезова», Шымкент, Казахстан
Моделирование в системах nSiO2-mFe3C-fC, kSiO-gFe3C-zС, lSiO2-rFe3C-tFeО-bС образования силицидов железа
Возможность образования силицидов железа (Fe3Si, Fe5Si3, FeSi, FeSi2) в
присутствии Fe3C в литературе
в достаточной мере не описана. В настоящем разделе, для определения
возможности образования силицидов железа рассматривались системы: nSiO2-mFe3C-fC; kSiO-gFe3C-zС;
lSiO2-rFe3C-tFeО-bС.
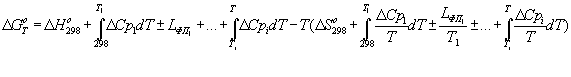 Термодинамическая
вероятность образования силицидов железа определялась посредством расчета
изменения энергии Гиббса (ΔGTo) по программе разработанной нами [1]. Расчет ΔGTo проводили в температурном интервале 300-2100К по
уравнению:
Термодинамическая
вероятность образования силицидов железа определялась посредством расчета
изменения энергии Гиббса (ΔGTo) по программе разработанной нами [1]. Расчет ΔGTo проводили в температурном интервале 300-2100К по
уравнению:
(4)
где ![]() - тепловой эффект химической реакции при 298К,
представляющий разницу между суммой теплоты образования продуктов и
исходных компонентов реакции:
- тепловой эффект химической реакции при 298К,
представляющий разницу между суммой теплоты образования продуктов и
исходных компонентов реакции:
![]() (5)
(5)
![]() - изменение теплоемкости системы, представляющие собой разницу
между теплоемкостями конечных и исходных реагентов:
- изменение теплоемкости системы, представляющие собой разницу
между теплоемкостями конечных и исходных реагентов:
![]()
(6)
Обычно теплоемкость
веществ зависит от температуры по следующему уравнению:
![]() (7)
(7)
Для расчета 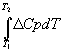 необходимо
необходимо ![]() выразить посредством уравнения 2 в
виде:
выразить посредством уравнения 2 в
виде:
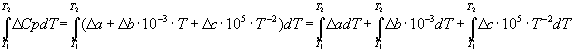 (8)
(8)
где ![]() - разница между суммой коэффициентов “а” конечных веществ и суммой коэффициентов “а” исходных
компонентов:
- разница между суммой коэффициентов “а” конечных веществ и суммой коэффициентов “а” исходных
компонентов:
![]() (9)
(9)
![]() - разница между суммой коэффициентов “b”
конечных
веществ и суммой коэффициентов “b” исходных компонентов:
- разница между суммой коэффициентов “b”
конечных
веществ и суммой коэффициентов “b” исходных компонентов:
![]() (10)
(10)
![]() - разница между суммой коэффициентов “c” конечных веществ и
суммой коэффициентов “c” исходных компонентов:
- разница между суммой коэффициентов “c” конечных веществ и
суммой коэффициентов “c” исходных компонентов:
![]() (11)
(11)
![]() - энтропия реакции при 298К, подсчитывается как разница
стандартных энтропий продуктов и исходных компонентов реакции:
- энтропия реакции при 298К, подсчитывается как разница
стандартных энтропий продуктов и исходных компонентов реакции:
![]() (12)
(12)
![]() - теплота фазовых
переходов (для продуктов) берется со знаком
+ (плюс), а для исходных — (минус).
- теплота фазовых
переходов (для продуктов) берется со знаком
+ (плюс), а для исходных — (минус).
Количество интегралов в уравнении
1 зависит от количества фазовых переходов от 298 до Т.
Результаты определения ΔGTo для реакций группы nSiO2-mFe3C-fC приведены
в таблице 1 , из которой следует, что в
температурной области 1655-1738К становится вероятным образование всех
силицидов (1655К-FeSi, 1685К-Fe5Si3, 1710К-Fe3Si, 1738К-FeSi2). Причем, на 1 моль О2, вероятность образования
силицидов располагается в следующей последовательности: FeSi>Fe5Si3>Fe3Si>FeSi2, а на 1
моль силицида эта закономерность имеет вид: Fe5Si3>FeSi2>FeSi>Fe3Si.
Таблица 1-Влияние температуры на ΔGTº (ккал/моль)
систем nSiO2-mFe3C-fC.
|
Реакции |
Температура, К |
||||||||||
|
298 |
463 |
848 |
1468 |
1493 |
1500 |
1573 |
1693 |
1883 |
2200 |
||
|
I |
А |
342,5 |
299,7 |
199,8 |
- |
- |
30,6 |
- |
-19,5 |
-68,8 |
-149,5 |
|
В |
117,78 |
103,95 |
71,68 |
- |
- |
17,04 |
10,92 |
- |
-15,05 |
-41,1 |
|
|
С |
1040,65 |
914,75 |
620,99 |
147,91 |
- |
123,49 |
- |
- |
-168,74 |
-405,93 |
|
|
D |
737,30 |
651,66 |
451,85 |
- |
117,10 |
113,47 |
- |
- |
-85,29 |
-246,69 |
|
|
II |
А |
114,2 |
99,9 |
66,6 |
- |
- |
10,2 |
- |
-6,5 |
-22,9 |
-49,8 |
|
В |
117,78 |
103,95 |
71,68 |
- |
- |
17,04 |
10,92 |
- |
-15,05 |
-41,10 |
|
|
С |
115,63 |
101,64 |
69,00 |
16,43 |
- |
13,72 |
- |
- |
-18,75 |
-45,10 |
|
|
D |
122,88 |
108,61 |
75,31 |
- |
19,52 |
18,91 |
- |
- |
-14,22 |
-41,12 |
|
|
III |
А |
114,18 |
99,91 |
66,60 |
- |
- |
10,20 |
- |
-6,49 |
-22,93 |
-49,83 |
|
В |
117,78 |
103,95 |
71,68 |
- |
- |
17,04 |
10,92 |
- |
-15,05 |
-41,1 |
|
|
С |
346,88 |
304,92 |
207,00 |
49,30 |
- |
41,16 |
- |
- |
-56,25 |
-135,31 |
|
|
D |
245,77 |
217,22 |
150,62 |
- |
39,03 |
37,82 |
- |
- |
-28,43 |
-82,23 |
|
|
I- общее ΔGTº, II- ΔGTº
на моль О2, III- ΔGTº
на моль ферросплава. Реакции: А) 3SiO2+Fe3C+5C=3FeSi+6CO; В) SiO2+Fe3C+C=Fe3Si+2CO; С) 9SiO2+5Fe3C+13C=3Fe3Si3+18CO; D) 6SiO2+Fe3C+11C=3FeSi2+12CO. |
|||||||||||
Для
второй группы реакций kSiO-gFe3C-zС значения ΔGTo приведены в таблице 2, из которой следует, что в
температурном интервале 298-2200К образование всех силицидов из SiO-
возможно.
Таблица 2-Влияние температуры на ΔGTº
(ккал/моль) систем kSiO-gFe3C-zС.
|
Реакции |
Температура, К |
||||||||
|
298 |
463 |
1468 |
1493 |
1500 |
1573 |
1693 |
2200 |
||
|
I |
E |
-64,87 |
-64,88 |
- |
- |
-64,93 |
- |
-64,94 |
-63,08 |
|
F |
-18,02 |
-17,57 |
- |
- |
-14,8 |
-14,6 |
- |
-11,92 |
|
|
G |
-180,0 |
-176,5 |
-155,6 |
- |
-155,0 |
- |
- |
-128,9 |
|
|
H |
-77,53 |
-77,54 |
- |
-77,59 |
-77,59 |
- |
- |
-69,97 |
|
|
II |
E |
-43,25 |
-43,25 |
- |
- |
-43,29 |
- |
-43,29 |
-42,05 |
|
F |
-36,04 |
-35,14 |
- |
- |
-29,6 |
-29,2 |
- |
-23,84 |
|
|
G |
-39,99 |
-39,23 |
-34,58 |
- |
-34,43 |
- |
- |
-28,64 |
|
|
H |
-25,84 |
-25,85 |
- |
-25,86 |
-25,86 |
- |
- |
-23,32 |
|
|
III |
E |
-43,25 |
-43,25 |
- |
- |
-43,29 |
- |
-43,29 |
-42,05 |
|
F |
-36,04 |
-35,14 |
- |
- |
-29,6 |
-29,2 |
- |
-23,84 |
|
|
G |
-39,99 |
-39,23 |
-34,58 |
- |
-34,43 |
- |
- |
-28,64 |
|
|
H |
-25,84 |
-25,85 |
- |
-25,86 |
-25,86 |
- |
- |
-23,32 |
|
|
I- общее ΔGTº, II- ΔGTº
на моль О2, III- ΔGTº на моль ферросплава Реакции: E) 3SiO+Fe3C+2C=3FeSi+3CO;
F)
SiO+Fe3C=Fe3Si+CO; G) 9SiO+5Fe3C+8C=3Fe5Si3+9CO; H) 6SiO+Fe3C+5C=3FeSi2+6CO |
|||||||||
Причем, например, при температуре 1900К вероятность
образования силицидов имеет вид: FeSi>Fe5Si3>Fe3Si>FeSi2, а на 1 моль силицида железа ряд имеет вид: Fe5Si3>FeSi2>FeSi>Fe3Si.
В третьей группе реакций lSiO2-rFe3C-tFeО-bС (таблица 3) температурный интервал начала образования силицидов
наблюдается при 1440-1660К (1440К-Fe3Si,
1570К-FeSi,
1580К-Fe5Si3,
1660К-FeSi2).
Т.е. по мере увеличения Fe в
ферросплаве температура начала его образования уменьшается. На 1 моль кислорода
в этой группе реакций (например, при 1883К) вероятность образования силицидов
железа имеет вид: Fe3Si>FeSi>Fe5Si3>FeSi2, а на 1 моль силицида железа закономерность
имеет вид: Fe5Si3>Fe3Si>FeSi2>FeSi.
Таблица 3- Влияние температуры на ΔGTºсистем
lSiO2-rFe3C-tFeО-bС.
|
Реакции |
Температура, К |
||||||||
|
298 |
463 |
848 |
1500 |
1651 |
1693 |
1883 |
2200 |
||
|
I |
Q |
366,64 |
317,2 |
201,82 |
6,42 |
-38,83 |
-51,41 |
-108,35 |
-202,98 |
|
V |
141,89 |
121,43 |
73,7 |
-7,13 |
-25,85 |
- |
-54,61 |
-93,54 |
|
|
W |
1064,76 |
932,23 |
623 |
99,31 |
-21,96 |
- |
-208,3 |
-462,54 |
|
|
K |
761,4 |
669,14 |
453,86 |
89,29 |
4,86 |
- |
-124,86 |
-301,73 |
|
|
II |
Q |
104,75 |
90,63 |
57,66 |
1,83 |
-11,09 |
-14,69 |
-30,96 |
-57,99 |
|
V |
94,59 |
80,95 |
49,13 |
-4,75 |
-17,23 |
- |
-36,41 |
-62,36 |
|
|
W |
112,08 |
98,13 |
65,58 |
10,45 |
-2,31 |
- |
-21,93 |
-48,69 |
|
|
K |
117,14 |
102,94 |
69,82 |
13,74 |
0,75 |
- |
-19,21 |
-46,42 |
|
|
III |
Q |
122,21 |
105,73 |
67,27 |
2,14 |
-12,94 |
-17,14 |
-36,12 |
-67,66 |
|
V |
141,89 |
121,43 |
73,7 |
-7,13 |
-25,85 |
- |
-54,61 |
-93,54 |
|
|
W |
354,92 |
310,74 |
207,67 |
33,10 |
-7,32 |
- |
-69,43 |
-154,18 |
|
|
K |
253,80 |
223,05 |
151,29 |
29,76 |
1,62 |
- |
-41,62 |
-100,58 |
|
|
I- общее ΔGTº, II-
ΔGTº
на моль О2, III- ΔGTº
на моль ферросплава. Реакции: Q) FeO+0.666Fe3C+3SiO2+6.334C=3FeSi+7CO; V) FeO+0.666Fe3C+SiO2+2.334C=
=Fe3Si+3CO; W) FeO+4.666Fe3C+9SiO2+14.334C=3Fe5Si3+19CO; K) FeO+0.666Fe3C+6SiO2+12.334C=3FeSi2+13CO. |
|||||||||
Литература
1 Шевко В.М. и др. Построение диаграмм парциальных
давлений систем Вi-О-С и Сd–О-Cl с
учетом образования оксихлоридов висмута и кадмия с использованием ЭВМ//Деп.в
Каз НИИ НТИ 25.06.85,№1010 Ка-15-9с.