К.х.н.
Перевозкина М.Г.
ФГБОУ ВПО «Государственный аграрный университет Северного
Зауралья», Россия
Результаты разработки кинетического
способа тестирования биоантиоксидантов
В связи с
широким внедрением ингибиторов окисления, актуальной является проблема
предварительного тестирования их антиоксидантной активности. Поскольку
большинство известных моделей для тестирования антиоксидантов являются
гидрофобными, представлялось актуальным подобрать гидрофильную липидную систему
и проверить её эффективность на примере известных ингибиторов окисления дибуноле и a-токофероле.
Особенности
окисления липидов в клетке обусловлены, прежде всего, каталитической активностью
катионов металлов и возможностью участия ферментов в регулировании этих
процессов. Известны многочисленные работы по тестированию активности катионов
металлов, которые относятся, в основном, к катализу гомогенных липидных систем
[1,2,3,4,5].
Эти результаты имеют ограниченное значение для описания процессов окисления,
протекающих в мицеллах и живой клетке. Мало работ, в которых сравниваются
антиоксидантные свойства соединений различных классов в безводной и
водно-эмульсионной (ВЭС) средах в условиях инициирования и катализа.
Целью данного
исследования являлась разработка кинетического способа тестирования
антиоксидантной активности различных классов органических соединений, в
условиях, приближенных к биологическим средам, изучение антиоксидантной
активности стандартных ингибиторов окисления - дибунола и a-токоферола (α-ТФ) при различных способах
инициирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Антиоксидантную активность (АОА) изучали
манометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении модельного
субстрата метиллинолеата (МЛ), в присутствии триметилцетиламмоний бромида (ЦТМАБ) в качестве
поверхностно-активного вещества (ПАВ) (10-4–10-2 М), с
добавками растворов солей металлов в количестве (10-6-10-1 М)
при t=(60±0,2)0С. Соотношение воды и эфира составляло 3:1, а
общий объем пробы 4 мл [6]. Кинетику поглощения кислорода в безводной среде
изучали в среде инертного растворителя хлорбензола, процесс инициировали за счет термического разложения азобисизобутиронитрила
(АИБН). Использовали термостатируемую окислительную
ячейку объёмом 2 см3, окисление проводили кислородом воздуха,
температура опытов составляла (60±0,2)0С. Графическим методом определяли величину периода
индукции (ti), представляющей собой отрезок оси
абсцисс, отсекаемый перпендикуляром, опущенным из точки пересечения
касательных, проведенных к кинетической кривой. Эффективность торможения
процесса окисления липидного субстрата определяется совокупностью реакций
ингибитора и обозначает его антиоксидантную активность, количественно
определяемой по формуле АОА= ti-tS /tS, где tS и ti – периоды индукции окисления субстрата в
отсутствие и в присутствии исследуемого АО соответственно, сравнивали с
действием ингибитора, принятого за стандарт, используя отношение ti / tреп,, где tреп. – период индукции реперного
ингибитора. Скорость
инициирования определяли уравнением Wi = f [InH] / ti, где f -
стехиометрический коэффициент ингибирования, [InH] - концентрация ингибитора, ti - период индукции.
Критическую концентрацию
мицеллообразования ЦТМАБ изучали методом Ребиндера и рефрактометрически.
В биологическом эксперименте исследовали влияние дозы и кратности
введения a-токоферола
ацетата per os животным на изменение антиоксидантной, антирадикальной
активности липидов плазмы крови и эритроцитов.
Для эксперимента использовали 4 группы по 10 белых крыс самцов линии
Виста. Животные имели массу тела 160 - 200 г, их содержали в условиях вивария
на стационарном рационе без ограничений в воде и пище с естественной сменой
освещенности.
Первой группе животных вводили однократно per os по 20 мг a-токоферола ацетата. Через 6
часов забирали из аорты кровь в количестве 3 мл, из которой выделяли плазму и
эритроциты. В липидах плазмы крови и эритроцитах анализировали кинетическим
методом антиоксидантную активность, спектрофотометрическим, флуориметрическим
методами определяли концентрацию сопряженных диеновых соединений и продуктов,
реагирующих с 2-тиобарбитуровой кислотой соответственно. Параллельно
фотоколориметрическим методом анализировали концентрацию общих липидов в плазме
крови и эритроцитах [7].
Второй группе животных вводили одну и ту же дозу a-токоферола ацетата 7 раз в
8 часов утра каждого из семи дней. Через 6 часов после введения последней дозы
забирали кровь и анализировали по перечисленным выше показателям.
Третьей группе животных вводили одну и ту же дозу a-токоферола ацетата 10 раз в
8 часов утра каждого из 10 дней. Через 6 часов после введения последней дозы
забирали кровь и анализировали по перечисленным выше показателям.
Четвертая группа животных была контрольной.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В основу
разработки кинетического метода легло представление о том, что в клетке
процессы протекают с очень высокими скоростями, биоантиоксиданты действуют в
водно-липидном окружении. В качестве способа максимального ускорения процесса
окисления был выбран металлокатализ. Другим приближением к биологическим
условиям являлась водно-эмульсионная среда. Разработка кинетического метода
базировалась на исследовании активности солей переходных металлов: FeSO4, FeCl3, NiCl2, CoCl2, CuCl2 в водно-липидных
субстратах. Для эмульгирования модельного субстрата использовали
поверхностно-активное соединение ЦТМАБ. С целью выбора наиболее эффективного
катализатора изучали в сравнительном аспекте влияние упомянутых выше солей на
процесс окисления МЛ.
Механизм
действия катализатора при окислении субстратов может быть охарактеризован по
характеру кинетических кривых (КК). При участии катионов металлов только в
зарождении цепей процесс окисления должен начинаться и протекать с постоянной
скоростью. Если катализатор участвует в зарождения цепей и распаде
гидропероксидов, то кинетика процесса должна быть более сложной: КК должны
содержать прямолинейный начальный участок, который соответствует только участию
катионов в зарождении цепей и накоплению необходимых концентраций
гидропероксидов. При достижении критических концентраций гидропероксидов
начинается их распад с участием катионов, ускорение процесса и достижения
максимальной скорости. Конкурентное участие катионов в обрыве цепей должно
приводить к замедлению процесса и S-образному характеру КК.
Замедление процесса возможно также за счет перехода катиона металла в менее
активную форму.
Первым в
качестве катализатора исследовали соли железа (II,III), исходя из того, что
железо в свободном и связанном в комплексные соединения виде является
естественным катализатором процессов ПОЛ в живой клетке организма.
На рис.1. приведены кинетические кривые поглощения кислорода МЛ в присутствии различных концентраций хлорида железа (III). КК имеют классическую S-образную форму с двумя участками. Первый участок характеризует аутоускоренный процесс, выход реакции на максимальную стационарную скорость, второй – замедление и достижение предельной скорости. В соответствии с приведенной выше общей концепцией механизма катализа, результаты могут быть интерпретированы следующим образом: начальный участок кинетических кривых характеризует процесс медленного накопления радикалов за счет участия катализатора в реакциях зарождения цепей. Второй участок кинетической кривой характеризует процесс накопления гидропероксидов, катализатор участвует в разветвлении цепей за счет их радикального распада. При этом скорость достигает максимального значения. По мере накопления гидропероксидов или других продуктов окисления образуются их комплексы с катионами железа, которые распадаются затем по молекулярному механизму. На этом участке кривой появляется ингибирующая активность катализатора, при этом скорость окисления имеет нулевое значение.
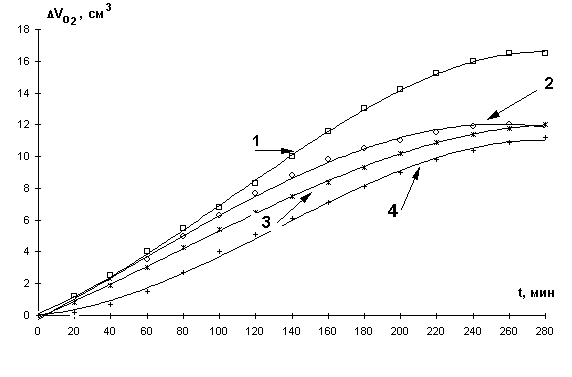
Рис
1. Кинетические кривые окисления МЛ в водно-эмульсионной среде в присутствии
добавок хлорида железа (III): 1- 1´10-2М; 2- 1´10-1М;3- 1´10-4М; 4- 1´10-3М, t=60° С.
КК окисления метиллинолеата в зависимости
от концентрации добавок сульфата железа (II) приведены на рис. 2. Наблюдали два
характера кинетических кривых при разных концентрациях катализатора. Первая
зависимость имеет аутоускоренный характер на всем протяжении кинетической
кривой. Второй вид кинетических кривых имеет два участка. Первый участок
характеризует аутоускоренный процесс, где поглощается небольшой объем
кислорода, второй - замедление, а затем достижение предельной скорости
процесса. Приведенные результаты свидетельствуют об участии катионов железа (II) в реакциях зарождения цепей, в радикальном распаде
гидропероксидов, что соответствует аутоускоренному характеру КК. При S-образном характере КК возможно образование комплексов
продуктов окисления с катионами железа (II). При этом молекулярный распад
комплексов приводит к снижению скорости окисления. На этом участке кривой
проявляется ингибирующая активность катализатора, и скорость снижается до
нулевых значений.
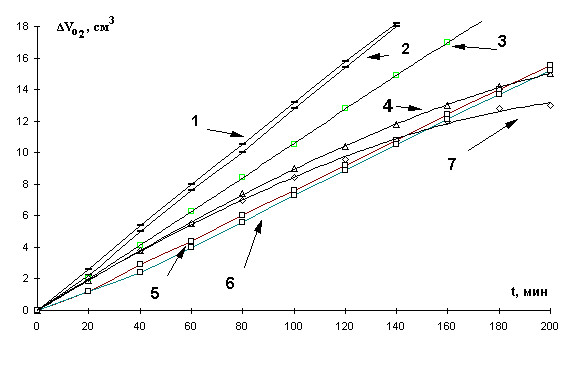 Рис
2. Кинетические кривые окисления в водно-эмульсионной среде МЛ в присутствии
добавок сульфата железа (II),
М: 1- 1×10-4, 2- 2×10-4, 3- 1×10-5,
4- 1×10-2, 5- 5×10-4, 6- 1×10-6,
7- 1×10-3, t=60° С.
Рис
2. Кинетические кривые окисления в водно-эмульсионной среде МЛ в присутствии
добавок сульфата железа (II),
М: 1- 1×10-4, 2- 2×10-4, 3- 1×10-5,
4- 1×10-2, 5- 5×10-4, 6- 1×10-6,
7- 1×10-3, t=60° С.
На рисунке 3 представлены кинетические кривые (КК) поглощения кислорода в присутствии равных добавок (1´10-3 М) солей железа (II,III), никеля (II), кобальта (II) и меди (II). Из рис. 3 видно, что в сравнимых концентрациях наиболее эффективным катализатором является хлорид меди (II). Для него отмечается наибольшая скорость процесса, оцениваемая из наклона кинетических кривых (КК). При сопоставлении абсолютных значений максимальной скорости окисления (Wмах) исследуемые катализаторы располагаются в следующем поряке: NiCl2 < FeCl3 < Fe2SO4 < CoCl2 < CuCl2.
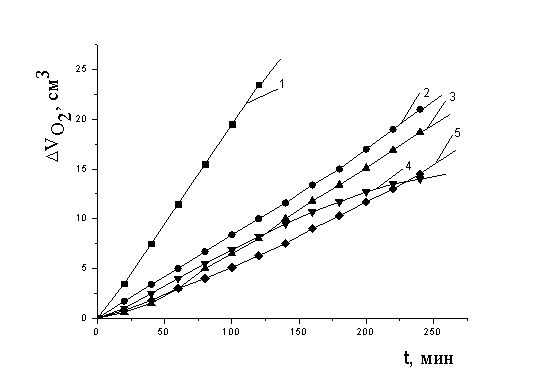
Рис 3. Кинетика окисления МЛ в водно-эмульсионной среде в присутствии
добавок солей металлов в концентрации 1×10-3 моль/дм3
: 1 - CuCl2, 2- FeSO4, 3- CoCl2, 4- FeCl3, 5- NiCl2, t=60° С.
В результате
исследований установлено, что аутоускоренный характер имеет кинетика окисления
водно-липидных субстратов только в присутствии катионов Fe2+, Co2+ и Cu2+. Характер кинетических
кривых окисления липидных субстратов в зависимости от концентрации катионов
позволил предполагать преобладающее участие Fe3+ , Ni2+ в обрыве цепей, участие Fe2+, Co2+, Cu2+ в зарождении и разветвлении цепей.
Действие
упомянутых выше солей было изучено в широком диапазоне концентраций для отбора
среди них наиболее эффективных катализаторов. На рисунке 4 приведены закономерности
изменения максимальной скорости процесса окисления от концентрации
катализатора. Можно видеть, что концентрационные зависимости для всех веществ
носят экстремальный характер, экстремумы проявляются в разных диапазонах.
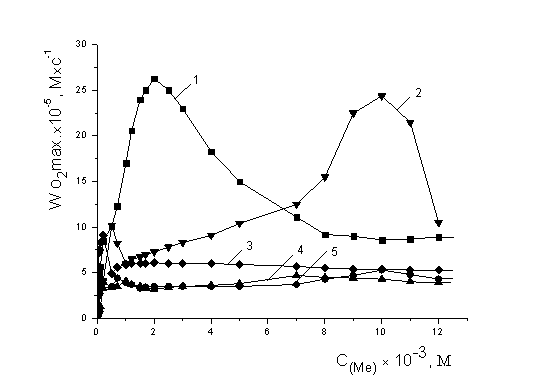 Рис. 4. Зависимость
стационарных скоростей окисления МЛ в присутствии солей катализаторов от их
концентрации, М:1 – NiCl2, 2- FeCl3, 3-Fe2SO4, 4-CoCl2, 5-CuCl2, t=60° С.
Рис. 4. Зависимость
стационарных скоростей окисления МЛ в присутствии солей катализаторов от их
концентрации, М:1 – NiCl2, 2- FeCl3, 3-Fe2SO4, 4-CoCl2, 5-CuCl2, t=60° С.
Скорости
окисления липидных субстратов в присутствии солей NiCl2 и FeCl3 выходят на максимум при
концентрациях 1,0×10-3 М, далее с ростом концентрации их
значение не меняется и составляет (4,0±0,2)×10-5 М×с-1
и (5,0±0,3)×10-5М×с-1 соответственно.
Максимальная скорость при окислении с добавками сульфата железа отмечается в
диапазоне (0,1-1,0) М и составляет (9,4±0,4)×10-5 М×с-1,
при дальнейшем росте концентрации – остается постоянной и составляет
(6,0±0,2)×10-5 М×с-1. Зависимость Wmax систем с добавками хлорида кобальта имеет ″пик″ при
концентрации (9-11)×10-3 М, при которой ее величина составляет
(24,4±0,4)×10-5 М×с-1. Хлорид меди по своим
каталитическим свойствам выделяется среди всех исследуемых веществ. Скорость
окисления в присутствии хлорида меди
выше в 5 раз, чем в присутствии других солей металлов переменной
валентности и при концентрации 2×10-3 М составляет
(26,3±0,3)×10-5 М×с-1 (табл.1).
Таблица 1
Кинетические
параметры окисления метиллинолеата в присутствии солей железа ( II,III ),
никеля ( II ), кобальта ( II ) и меди ( II ) в ВЭС, t= 600С,
С ЦТМАБ
= 1´10-3 М, вода:липиды - 3:1.
|
Катализатор |
Fe2+ |
Fe3+ |
Ni2+ |
Co2+ |
Cu2+ |
Fe2+ |
Fe3+ |
Ni2+ |
Co2+ |
Cu2+ |
|
|
[Кат.],М |
2´10-3 |
1´10-3 |
|||||||||
|
[Кат.]/[МЛ] |
1 : 50 |
1 : 100 |
|||||||||
|
Wнач.´10-5, М´с-1 |
6,8 |
1,7 |
2,4 |
14,2 |
14,4 |
6,8 |
2,3 |
3,5 |
11,4 |
8,6 |
|
|
Wmax.´10-5, М´с-1 |
6,1 |
3,5 |
3,2 |
7,3 |
26,3 |
5,9 |
3,2 |
4,1 |
6,8 |
14,5 |
|
В нашем эксперименте каталитическая активность солей металлов
уменьшается в ряду: Cu2+ > Fe2+ > Fe 3+ > Co2+> Ni2+. Ранее
каталитическое действие металлов переменной валентности изучалось при окислении
растительных масел
и модельных липидных субстратов [1,3,4,5]. Был получен ряд
каталитической активности катионов : Cu2+ > Mn2+ > Fe2+ > Cr2+ > Ni2+ >> Zn2+. Как видно из приведенных выше
данных изученные соли вписываются в указанный ряд активности металлов, а хлорид
меди обладает наибольшей каталитической активностью при наименьшей концентрации
2´10-3 М.
Следующим этапом
создания модели для тестирования антиоксидантов был выбор концентрации ЦТМАБ.
Известно [8], что скорость окисления в гомогенных системах ниже, чем в
эмульсиях и зависит от степени ее дисперсности. В работе [1] установлено, что
соотношение констант скорости роста и обрыва цепи при инициированном окислении
кумола в эмульсиях и гомогенной системе соотносится как 5,5:1 и равно 110 и 20
соответственно.
Нами также было
установлено, что скорость окисления МЛ в водно-эмульсионной среде ~ в 1000 раз
выше, чем в безводной среде.
При выборе
оптимальной концентрации ЦТМАБ исследовали диапазон (10-4 - 10-2) М. Установлено, что с
ростом концентраций ПАВ скорость процесса проходит через максимум,
соответствующий концентрации 1 × 10-3 М. Дальнейшее повышение
концентрации ЦТМАБ приводит к снижению скорости окисления. Указанную
концентрацию детергента, обеспечивающую наибольшую скорость реакции, можно
рекомендовать для использования в гетерогенных моделях окисления. Методом
Ребиндера и рефрактометрически была определена критическая концентрация
мицеллообразования ЦТМАБ (1,0±0,2) × 10-3 М, что соответствовало
кинетическим данным.
Механизм
каталитического окисления липидов в водно-эмульсионной среде сводится к
следующему: в присутствии ЦТМАБ формируются мицеллы. Добавки катионного ПАВ
усиливают мицеллообразование, при этом катионы внедряются в промежутки между углеводородными
«хвостами» и образуют двойной электрический слой. При образовании свободных
радикалов высших жирных кислот катионы катализатора должны иметь доступ к
гидрофобным хвостам субстрата. При низких концентрациях катионы катализатора
имеют большую вероятность донорно-акцепторного взаимодействия с эфирными
группами субстрата, приводящего к образованию в присутствии катализатора
свободных радикалов по реакции:
Me(n+1)+ + RH + O2 ¾¾® Men+ + R° + HO2°
Вероятно,
существуют оптимальные концентрации ЦТМАБ, при которых количество контактов
катиона катализатора, липидов и кислорода максимально. При увеличении концентрации
ЦТМАБ количество катионов на поверхности мицеллы возрастает, происходит более
интенсивное отталкивание катионов катализатора, снижение скорости зарождения
цепей и скорости процесса окисления.
В соответствии с
приведенной гипотезой, добавки 1×10-3 М ЦТМАБ являются
оптимальными, обеспечивающими максимальный контакт катионов меди и кислорода с
жирно-кислотными радикалами. Увеличение концентрации ПАВ снижает количество
таких контактов, и скорость процесса соответственно.
Механизм
действия металлов связывают с каталитическим разрушением гидропероксидов в
соответствии с реакциями [1]:
ROOH + Fe3+ ¾¾® RO2° + H+ + Fe2+
ROOH + Cu2+ ¾¾® RO2° + H+ +
Cu1+
ROOH + Fe2+¾¾® RO2° + H+ + Fe3+
Образующиеся при этом
алкоксильные и пероксильные радикалы участвуют в дальнейшем в реакциях
продолжения цепей окисления. Катионы металлов могут конкурентно участвовать в
обрыве цепей, что должно приводить к замедлению процесса на глубоких стадиях
окисления. Замедление процесса возможно также за счет перехода катиона металла
в менее активную форму.
Таким образом, результаты настоящего исследования
демонстрируют возможности новой кинетической модели, которая может быть
предложена для изучения процессов свободно-радикального окисления липидных
субстратов различного происхождения.
На основе
проведенных исследований была предложена новая кинетическая модель для
тестирования антиоксидантов. Модельный субстрат содержит 2×10-3 М хлорида меди (II),
1×10-3 М ЦТМАБ, липиды (МЛ) и воду, соотношение липиды-вода 1 : 3.
Для
доказательства свободно-радикального механизма каталитического окисления
липидного субстрата использован метод ингибиторов. Проведено исследование
закономерностей окисления модельного субстрата в присутствии добавок
стационарных ингибиторов окисления дибунола и
a-ТФ.
На рисунке 5
приведены КК окисления в ВЭС метиллинолеата в присутствии добавок дибунола.
Показано, что дибунол проявляет себя как сильный ингибитор: наблюдается период
полного торможения, период аутоускорения и достижение максимальной скорости окисления.
Периоды индукции увеличиваются пропорционально увеличению концентрации
дибунола. Наличие торможения в присутствии добавок дибунола является признаком
радикально-цепного механизма процесса, а отсутствие комплексообразующей способности с катионами меди из-за
экранированности двумя трет.бутильными заместителями его донорно-акцепторного
центра.
Установлено, что a-токоферол
характеризуется чрезвычайно высокой константой скорости реакции с пероксильными
радикалами k7 = (3,3-3,5)´106 М-1´с-1
[9], что на два порядка превышает аналогичные константы скорости для дибунола k7 =1,40´104
М-1ґс-1. Между тем вопрос о роли a-токоферола в биомембранах
далек от своего решения. Известен сложный механизм действия a-токоферола в безводных
углеводородных и липидных субстратах, его участие не только в реакциях обрыва
цепей, но и реакциях продолжения цепей и распаде гидропероксидов. Последние
реакции приводят к снижению антиоксидантной активности a-токоферола.
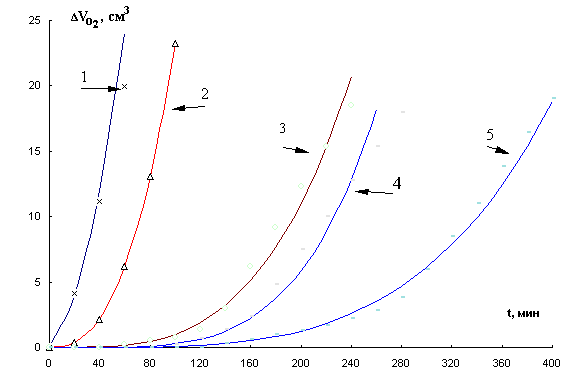
Рис.5. Кинетика
окисления МЛ в присутствии добавок дибунола в водно-эмульсионной среде, М : 1-
контроль, 2- 1×10-5, 3- 5×10-5, 4- 1×10-4,
5- 5×10-4, t= 600С.
В настоящей
работе приведены результаты тестирования антиоксидантного действия a-токоферола в условиях
инициирования и катализа, а также в биологическом эксперименте.
На рис.6. приведены КК окисления метиллинолеата в хлорбензоле (1:1) в присутствии 1×10-8-1×10-1 М a-токоферола и 6×10-3 М инициатора. Показано, что КК в присутствии 1×10-8-1×10-4 М a-токоферола имеют аутоускоренный характер без периода полного торможения. В этом интервале концентраций начальные скорости тем меньше, чем больше добавки a-токоферола, при всех концентрациях достигается одинаковая максимальная скорость. Период полного торможения появляется только при концентрациях 1×10-4 и 5×10-4 М и меняется пропорционально концентрации. При дальнейшем повышении концентрации a-токоферола увеличивается начальная скорость окисления, сокращается период полного торможения, максимальная скорость достигается тем позже и при более высоких концентрациях поглощенного кислорода, чем выше концентрация a-токоферола.
Результаты
расчета начальной (Wнач.), максимальной (Wmax.)
скоростей и периода индукции приведены в табл.2. Из табл. видно сохранение
близких Wmax. при концентрациях a-токоферола от 1×10-7 до 1×10-1 М и десятикратное снижение
Wнач. при этих концентрациях a-токоферола.
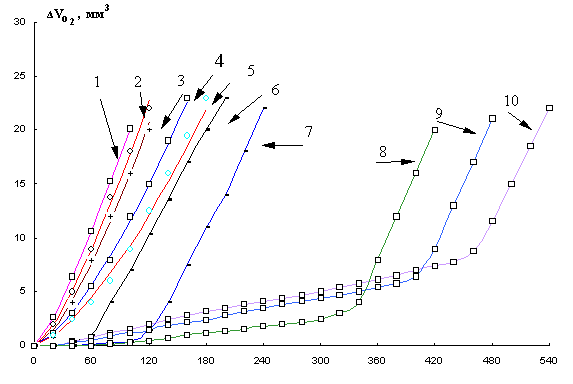
Рис. 6. Кинетика окисления МЛ в присутствии добавок α - токоферола в растворе хлорбензола, М : 1- контроль,
2- 1×10-8, 3- 1×10-7, 4- 1×10-6,
5- 1×10-5, 6- 1×10-4, 7- 5×10-4.
8- 1×10-3, 9- 1×10-2, 10- 1×10-1,
t= 600С.
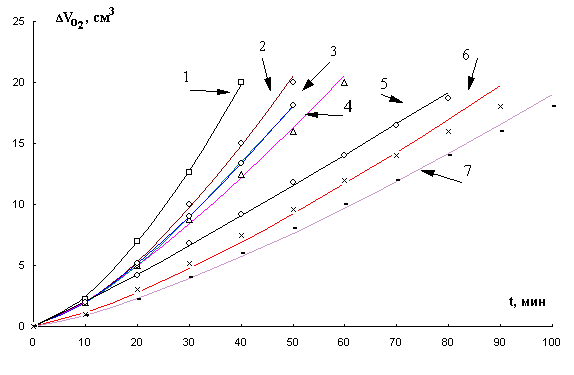
Рис. 7. Кинетика окисления МЛ в присутствии добавок α- токоферола в водно-эмульсионной среде, М:
1-1×10-1, 2-1×10-2, 3-1×10-3,
4-контроль,5-1×10-6, 6-1×10-5, 7- 1×10-4,
t= 600С.
Таблица 2
Кинетические параметры окисления МЛ в
растворе хлорбензола в присутствии 6×10-3 М АИБН и a-токоферола, t= 600С
|
№ п/п |
С(a-ТФ), М |
t, мин |
Wнач.×10-8,
М×с-1 |
Wmax.×10-7, М×с-1 |
|
1 |
Контроль МЛ |
15 |
4,3 |
2,6 |
|
2 |
1×10-8 |
17 |
4,3 |
2,3 |
|
3 |
1×10-7 |
20 |
3,6 |
2,0 |
|
4 |
1×10-6 |
35 |
2,5 |
1,9 |
|
5 |
1×10-5 |
44 |
2,3 |
1,8 |
|
6 |
1×10-4 |
67 |
1,1 |
1,8 |
|
7 |
5×10-4 |
120 |
0,5 |
2,0 |
|
8 |
1×10-3 |
350 |
0,6 |
1,7 |
|
9 |
1×10-2 |
405 |
0,5 |
1,8 |
|
10 |
1×10-1 |
420 |
0,2 |
1,8 |
Представленные результаты свидетельствуют
о сложном механизме действия a-ТФ в безводном растворе МЛ, об его участии не только в реакциях
обрыва, но и реакциях продолжения цепей.
Были изучены КК окисления метиллинолеата в
присутствии 1×10-8-1×10-1 М a-ТФ в ВЭС. Из рис.7 видно, что в этих условиях
окисление субстрата в присутствии любых концентраций a-ТФ происходит без периода индукции. Добавки
1×10-3-1×10-1 М a-ТФ ускоряют процесс, 1×10-8 М a-ТФ только незначительно уменьшает максимальную скорость, без заметного
влияния на начальные стадии окисления. Таким же образом влияют добавки
1×10-7 и 1×10-6 М a-ТФ. В присутствии 1×10-5 и 1×10-4 М a-ТФ наблюдается замедление начальных стадий окисления
и уменьшение максимальной скорости (Табл.3.).
Таблица 3
Кинетические параметры и состав субстрата
при окислении МЛ в водно-эмульсионной среде в присутствии a-ТФ и 2×10-3 М хлорида меди (II), t= 600С
|
№ п/п |
С(a-ТФ), М |
t, мин |
Wнач.×10-4,
М×с-1 |
Wmax.×10-4, М×с-1 |
|
1 |
Контроль МЛ |
5 |
1,4 |
2,6 |
|
2 |
1×10-8 |
10 |
1,4 |
2,1 |
|
3 |
1×10-7 |
15 |
1,1 |
2,1 |
|
4 |
1×10-6 |
20 |
1,0 |
1,9 |
|
5 |
1×10-5 |
25 |
0,7 |
1,8 |
|
6 |
1×10-4 |
35 |
0,5 |
1,4 |
|
7 |
1×10-3 |
15 |
1,4 |
3,2 |
|
8 |
1×10-2 |
6 |
1,6 |
3,4 |
|
9 |
1×10-1 |
5 |
1,7 |
5,7 |
Представленные результаты свидетельствуют
о том, что a-ТФ при каталитическом
окислении водно-липидных субстратов может при одних концентрациях инициировать
процесс или слабо замедлять его при других концентрациях. Инициирующая активность
a-ТФ может быть
обусловлена его комплексообразованием с катионами меди. Слабое торможение
действия a-ТФ может быть
обусловлено его участием в реакциях обрыва и продолжения цепей. В целом из
представленных результатов, очевидно, что механизм действия a-ТФ меняется от состава субстрата, а предлагаемый нами
способ может служить моделью для тестирования антиоксидантов.
Добавки a-токоферола, проявившие антиоксидантную активность в
водно-эмульсионной среде, были использованы в биологическом эксперименте,
методика которого описана выше.
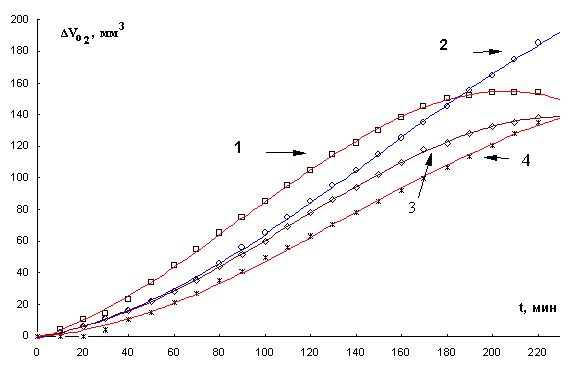
Рис.8. Кинетика
окисления липидов плазмы крови (2) и эритроцитов (4) контрольных животных,
плазмы (1) и эритроцитов (3) подопытных животных после введения per os a-токоферола ацетата.
На рис. 8 приведены кинетические кривые
окисления липидов плазмы крови ( кривая
1 ) и
эритроцитов ( кривая 2 )
контрольных животных, а также подобные кривые для фракций крови через 6
часов после введения 20 мг a-токоферола ацетата на 100 г массы животного. КК
окисления липидов контрольных проб имеют экспоненциальный характер: после
небольшого периода индукции,
аутоускорения, достигается максимальная скорость. Кривые окисления липидов
фракций крови после скармливания a-токоферилацетата имеют S-образный характер.
Наблюдается сокращение периода индукции, периода аутоускорения, идет быстрое
достижение максимальной скорости, а затем ее снижение. Из теории
цепных-разветвленных процессов известно [10], что такой характер кривых
соответствует глубоким стадиям окисления. Анализ концентрации продуктов
окисления подтверждает этот вывод. Через 6 часов после приема препарата
наблюдается 1,5 - кратное повышение
концентрации сопряженных диеновых соединений и 4 - кратное увеличение
концентрации сопряженных триенов в липидах плазмы крови и эритроцитов по
сравнению с показателями фракций крови контрольных животных. Показатели
концентрации первичных ( Д235 ), вторичных продуктов окисления ( ТБЧ ) и
концентрации общих липидов приведены в табл.4. Показано, что через 6 часов
после приема препарата антиоксидантная
активность уменьшается в 1,5 раза. Через 7 и 10
суток после приема препарата антиоксидантная активность липидов также ниже, чем
в контрольной группе. Суммарная скорость окисления липидов через 7 суток после
приема препарата несколько выше, чем в
контрольной группе, через 10 суток после приема этот показатель уменьшается
в 2 раза.
Таблица 4
Кинетические
параметры окисления липидов
плазмы крови и эритроцитов животных
после введения per os a-токоферола
ацетата
|
Условия экспери- мента |
ПОКАЗАТЕЛИ |
||||
|
t, мин. |
W, мм3/мин |
Д235, |
ТБЧ, |
Д534, |
|
|
|
ПЛАЗМА |
||||
|
контроль |
58,0 ± 0,3 |
1,04 ± 0,03 |
0,30 ± 0,02 |
3,6 ± 0,1 |
0,9 ± 0,1 |
|
однократный приём |
40,5 ± 0,6 |
1,13 ± 0,02 |
0,38 ± 0,04 |
3,4 ± 0,1 |
0,8 ± 0,1 |
|
приём в тече- ние 7 сут. |
47,0 ± 0,7 |
1,12 ± 0,02 |
0,36 ± 0,01 |
3,4 ± 0,1 |
0,8 ± 0,1 |
|
приём в тече- ние 10 сут. |
45,0 ± 0,5 |
0,55 ± 0,05 |
0,38 ± 0,01 |
3,3 ± 0,1 |
0,7 ± 0,1 |
|
|
ЭРИТРОЦИТЫ |
||||
|
контроль |
59,3 ± 0,4 |
0,95 ± 0,04 |
0,28 ± 0,01 |
3,7 ± 0,1 |
0,9 ± 0,1 |
|
однократный приём |
46,7 ± 0,4 |
0,98 ± 0,09 |
0,42 ± 0,08 |
3,6 ± 0,1 |
0,8 ± 0,1 |
|
приём в тече- ние 7 сут. |
43,3 0,5 |
1,20 ± 0,02 |
0,38 ± 0,06 |
3,3 ± 0,1 |
0,7 ± 0,1 |
|
приём в тече- ние 10 сут. |
42,5 0,4 |
0,76 ± 0,06 |
0,37 ± 0,04 |
3,3 ± 0,1 |
0,8 ± 0,1 |
Из табл. 4. видно, что под влиянием приема
препарата концентрация первичных продуктов окисления липидов на протяжении
всего эксперимента выше, чем в контрольной группе. Концентрация вторичных
продуктов в процессе эксперимента незначительно снижается. Представленные результаты
свидетельствуют о прооксидантном эффекте
a-токоферола на липиды
фракций крови при его приеме животными per os. Эффект усиливается с увеличением
дозы и длительности приема. Сравнение результатов биологического и кинетического
эксперимента свидетельствует в пользу использования каталитических водно-эмульсионных систем
липидов для тестирования биоантиоксидантов.
ВЫВОДЫ
1. Разработана кинетическая модель тестирования биоантиоксидантов в
водно-эмульсионной каталитической среде, выбраны оптимальные концентрации
катализатора и поверхностно-активного вещества.
2. Получен ряд каталитической
активности солей металлов переменной валентности: Cu2+ > Fe2+ > Fe 3+ > Co2+> Ni2+.
3. Показан идентичный механизм
действия стационарного антиоксиданта дибунола при окислении безводных и
водно-эмульсионных липидных субстратов.
4. Установлена слабая
антиоксидантная активность a-токоферола при каталитическом окислении
водно-эмульсионных липидных субстратов и возможность его
участия в комплексообразовании с катионами меди (II).
СПИСОК ЛИТЕРАТУРЫ
1. Владимиров Ю.А., Суслова Т.Б., Оленев В.И. Митохондрии.
Транспорт электронов и преобразование энергии. М.: Наука. 1976. 109 с.
2. Арутюнян Р.С., Налбандян Дж.М., Бейлерян Н.М. //
Кинетика и катализ. 1985. Т.26. № 6. С.
1475-1477.
3. Allen Y.C., Farag P. A comparison between the metal-catalysed
autoxidation of agueous emulsions of linoleic acid, trilinolein and
phospholipids 3 Symp. int. oxide lipides catalyses metaux. 1974.
Paris. P. 44-56.
4. Ohlson R. Fats and oils demetalization : its intlulnce on their
oxidative stability // 3. Symp. int. oxide lipides catalises metaux. Paris.
1973. P. 184-192.
5.
Pokorny J. Effect of metallic compounds on
the autoxidation of fatty acids and their derivatives. 3. Effect of metallic
chlorides on the autoxidation of stabilized isopropyl oleate // Sb. VSCHT V Praze. 1969. E.27.
P. 67-81.
6. Ушкалова В.Н., Перевозкина М.Г., Барышников Э.В.
Разработка способа тестирования средств антиоксидантотерапии // В сб.:
Свободно-радикальное окисление липидов в эксперименте и клинике. Тюмень, Из-во
Тюм.ГУ. 1997. С. 77-82.
7. Кадочникова Г.Д.,
Перевозкина М.Г., Ушкалова В.Н. Исследование антиоксидантной активности a-токоферола в зависимости от природы субстрата // В
сб.: Свободно-радикальное окисление липидов в эксперименте и клинике. Тюмень,
Из-во Тюм.ГУ. 1997. С. 83-90.
8. Мицеллярно -
каталическическое окисление углеводоров. 2 Влияние медных и натриевых солей
лауриновой и пальмитиновой кислот на кинетику окисления кумола кислородом в
присутствии водной фазы / Л.П. Паничева, Н.Ю. Третьяков, С.А. Эйхман, А.Я. Юффа
// Кинетика и катализ. 1991. Т.32. вып. 1. С. 45-49.
9. Бурлакова Е.Б. Биоантиоксиданты и синтетические
ингибиторы радикальных реакций // Успехи химии. - 1975. - Т. 44. - N 10. -
С.874 – 886.
10. Денисов Е.Т. Элементарные реакции ингибиторов
окисления // Успехи химии. 1973. Т. 42. вып. 3. С. 361- 390.