УДК 661.185
Ж.Б.
Рахимберлинова, А.С. Утегенова, А.Д. Мехтиев, В.В. Югай, Г.А. Белик, Н.Б.
Калиаскаров
ОЦЕНКА ПАРАМЕТРОВ МОДИФИЦИРОВАННЫХ УГОЛЬНЫХ СОРБЕНТОВ
Перед
производственными предприятиями и коммунальным хозяйством всегда стоит проблема
очистки воды. Очистка сточных вод производится ионообменными материалами.
Производимых для этой цели ионитов используется из всей массы около 65% [1-3].
Особенности ионитов обусловлены селективной сорбцией металлов в разных
средах и технологией очистки
природных, шахтных вод. Технология
сорбции металлов, попавших в водоемы, загрязняющих окружающую среду химических
элементов и извлечение различных элементов из природных вод имеет большую
перспективу [4-5].
Работа по поиску недорогих, удобных,
эффективных сорбентов, катионитов, анионитов для казахстанских
научно-исследовательских институтов является актуальной проблемой [6-9]. Было
предложено применение для очистки сточных вод высокоэффективный синтетический
полимер, но возникают вопросы по его приемлемости. Поэтому важно получить
иониты природного происхождения. Для Карагандинской области с хорошо развитой угольной промышленностью получение
ионитных реагентов является ключевой проблемой. Одним из путей решения этой
проблемы будет предложение в качестве ионообменных материалов (сорбентов) хлор-
и сульфопроизводные, полученные из отходов Шубаркольских
углей.
Хлор- и сульфопроизводные были получены: хлоруголь (ХУ) – через электрохимическую генерацию угля;
аминохлоруголь (АХУ) – через реакцию хлоругля с алифатическими аминами;
сульфоуголь (СУ) – через реакцию сульфирования угля серной
кислотой. Были изучены сорбционные качества угольных производных и получены нижеприведенные результаты. Для
оценки сорбционных качеств угольных
хлор- и сульфопроизводных было изучено
поглощение ими ионов металлов [10]. В начале были подготовлены модельные
растворы солей металлов, для модельных
растворов были взяты три вида металла - Cu2+, Pb2+, Ni2+
и их разные концентрации. Угольные производные при
соотношении с растворами солей металлов Т : Ж - 1 : 25 (твердое
тело : жидкость) взаимодействуют в течение суток. Опыт проводится в статических
условиях при температуре 25°С. Исследование сорбционных
качеств было проведено методом изотермы. После достижения в растворе сорбционного равновесия
образование ионов металлов равновесного комплексообразования (Ст)
определяется 0,05-0,10 н раствором трилона Б. Сорбционная способность угольных
производных характеризуется величиной статической обменной емкости (СОЕ) и по
величине сорбции α. Количество сорбированных ионов металлов (А∞)
определяется по разности начальной концентрации (С0) и равновесной
концентрации (Ст). Величина сорбции (α) находится как отношение
количества сорбированного металла и начальной концентрации металла.
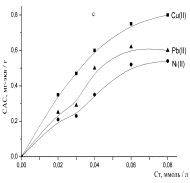
По результатам исследования была построена
изотерма сорбции ионов металла
угольными производными (1 рисунок), оценена в условиях равновесия влияние на
сорбцию природы иона металла.
|
|
|
|
|
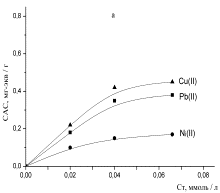
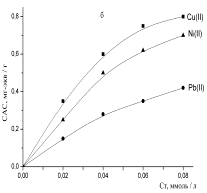
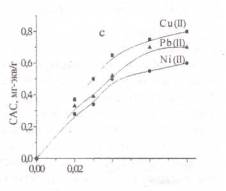
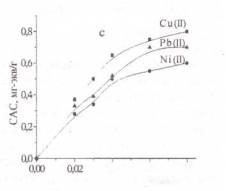
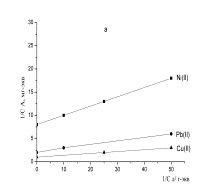
Рисунок 1- Изотермы
сорбции ионов тяжелых металлов: а - хлоруголь, б - аминохлоруголь, с -
сульфоуголь |
||
Изотерма сорбции металлов
угольным хлорпроизводным была получена в виде L,
т.е. описывается уравнением Ленгмюра. Изотерма Ленгмюра для микропористых
сорбентов равномерная [11]. Из 1 рисунка можно наблюдать, что в условиях
сорбции свинца в низко концентрированной области происходит объемное заполнение
микропор сорбента. Начальный отрезок изотермы сорбции этого металла очень
ровный, дальнейший изгиб изотермы показывает, как функциональные группы сорбента
со свинцом образуют устойчивые соединения.
Для полной оценки
сорбционных качеств угольных хлорпроизводных все изотермы сорбции были проанализированы в
соответствующих координатах уравнений Фрейндлиха и Ленгмюра. Уравнение Фрейндлиха характеризует сорбцию
растворенных веществ в области объемного заполнения. Для определения постоянной
уравнения проводится логарифмирование, β и 1/п – постоянные величины находятся путем
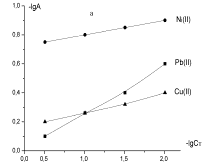
вычисления. На 2 рисунке показана в логарифмических координатах вычисленная по
уравнению Фрейндлиха изотерма сорбции, в 1 таблице приведены параметры по разным ионам.
Таблица 1 – Сорбционные
параметры угольных производных по уравнению Фрейндлиха
|
Сорбент |
Ni2+ |
Си2+ |
РЬ2+ |
|||
|
|
β |
1/п |
β |
1/п |
β |
1/п |
|
ХУ |
1,06 |
0,14 |
1,28 |
0,18 |
|
0,36 |
|
СУ |
1,86 |
0,22 |
1,66 |
0,12 |
2,51 |
0,16 |
|
АХУ |
1,99 |
0,38 |
1,47 |
0,44 |
1,12 |
0,42 |
|
|
|
|
|
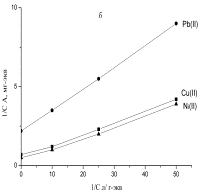
Рисунок
2 – Изотермы сорбции угольных производных в логарифмических координатах уравнения
Фрейндлиха: а - хлоруголь, б - аминохлоруголь, с -
сульфоуголь |
||
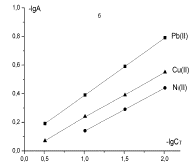
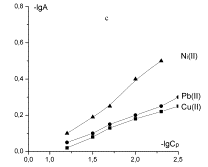
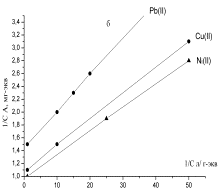
Изотерму сорбции можно описать уравнением Ленгмюра.
Уравнение Ленгмюра применяется в образце линеаризации, определяется параметр А∞, отвечающий за граничную сорбцию монослоя емкости, постоянную величину
равновесия сорбции Кт (3 рисунок, 2 таблица).
|
|
|
|
|
Рисунок 3 – Изотермы сорбции угольных производных в
логарифмических координатах уравнения Ленгмюра: а - хлоруголь,
б – аминохлоруголь, с - сульфоуголь |
||
Таким образом, для полной оценки сорбционных
качеств угольных производных изотермы сорбции
проанализированы уравнениями Фрейндлиха и Ленгмюра. По уравнению Фрейндлиха 1/п
постоянная величина растет от никеля к свинцу, от
значения 0,12 растет до 0,44, потом меняется незначительно.
Значение
β для меди в 1,06 выше, чем для
никеля, а для свинца в 2,51 раз выше,
чем для меди. Величина 1/п при постоянном значении чем выше, чем выше значение
β, тем быстрее протекает процесс сорбции и ион
металла эффективнее извлекается. При значении параметра 1/п для сульфоугля 0,16 - 0,22, значении β для никеля -
1,86, для свинца - 2,51, тем более в 1,35 раза быстрее протекает процесс сорбции.
В уравнении Ленгмюра величина Кт характеризует сорбент и в водных растворах извлечение иона металла. Чем
больше величина Кт, тем
лучше сорбент извлекает из водных растворов ион металлов. По увеличению
постоянной, константы сорбции Кт от 0,61 до 2,66 и до 3,96-10-2
можно судить, что аминохлоруголь и сульфоуголь извлекают из водных растворов
ионы свинца с очень высоким показателем.
В изученных сорбентах угольных производных
по отношению к ионам металлов наблюдаются хорошие и приемлемые сорбционные
свойства. Для анализа этих свойств можно применить вышеперечисленные уравнения.
Проведенные исследования показали, что есть возможность использования
производных угля в качестве недорогих и эффективных ионитов.
Использованная литература
1 Гриссбах Р. Теория и
практика ионного обмена. - М.: Изд. иностр. литература, 1986. - 499с.
2 Иониты. Каталог/Под ред.
А.Б. Пашкова. - Черкассы: ОНИИТЭХИМ, 1980.- 179 с.
3 Ярославский З.Я.,
Николадзе Г.И., Пальгунов П.П. и др. // Водные ресурсы. - 1974. - №2. - С.
120-138.
4 Бакач Тибор. Охрана
окружающей среды. -М.: Медицина, 1980.-210 с.
5 Цыганков А.П., Баллацкий
О.Ф., Сенин В.И. Технический прогресс - химия - окружающая среда. - М.: Химия, 1979.- 138 с.
6 Гамаюнов Н.И.,
Масленников Б.И., Шульман Ю.А. Ионный обмен в гуминовых кислота //Химия
твердого топлива. -1991. - № 3. - С. 32-37.
7 Будаева А.Д., Золтоев
Е.В., Тихова В.Д., Бодоев Н.В. Взаимодействие ионов тяжелых металлов с
гуматами аммония //Журнал прикладной химии. - 2006. - Т. 79, вып. 6. - С. 930-933.
8 Любченко В.И., Думбай
И.Н., Губанова Е.А., Кочканян P.O. Гранулированные сорбционные материалы на основе гуматов бурых
углей //Химия твердого топлива. -1999. - № 2. - С. 38-41.
9 Александрова И.В.,
Канделаки Г.И., Куликова И.П. Цеолит-гуминовые сорбенты для очистки сточных
вод //Химия твердого топлива. -1994. - № 4-5. - С. 136-141.
10 Шварценбах Т.Т. Флашка.
Комплексонометрическое титрование. - М.: Химия, 1970. -360с.
11 Фролов Ю.Г. Курс
коллоидной химии (Поверхностные явления и дисперсные системы). - М.: Химия,
1982. - 400 с.