Жаркова
Л.П.1,2, Князева И.Р.3, Иванов В.В.3,
Кутенков О.П.2, Ростов В.В.2, Большаков М.А.1,2
1Томский государственный университет, Россия
2Институт сильноточной электроники СО РАН, Россия
3Сибирский государственный медицинский университет, Россия
Влияние НАНОСЕКУНДНого импульсно-периодического миковолнового
излучения на ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ митохондрий печени мышей
Одним из возможных механизмов влияния импульсно-периодического
микроволнового излучения (ИПМИ) с импульсами наносекундной длительности может
быть изменение уровня активных форм кислорода (АФК) с последующей окислительной
модификацией липидов и белков клеток [1]. В результате окислительной
модификации фосфолипидного бислоя могут изменяться физико-химические свойства
биологических мембран и ионные потоки через них. Это будет затрагивать
функциональное состояние митохондрий, прежде всего, интенсивность работы
дыхательной цепи. Изменение ионных потоков в митохондриях под воздействием ИПМИ
должно приводить к изменению их объёма, поскольку накопление или обеднение
матрикса органелл теми или иными ионами сопровождается переносом молекул воды в
него или из него соответственно. Поэтому, измеряя интенсивность дыхания и
изменение объема митохондрий, можно оценить действия импульсных микроволн на
митохондрии как первичные мишени биологического действия исследуемого излучения.
Целью настоящего исследования являлось изучение влияния
наносекундного импульсно-периодического микроволнового излучения на скорость
потребления кислорода изолированными митохондриями в различных метаболических
состояниях и на изменение объема этих органелл.
МАТЕРИАЛЫ И МЕТОДИКА
Эксперименты выполнены на препаратах интактных митохондрий,
полученных стандартным методом дифференциального центрифугирования из печени беспородных
белых мышей-самцов [2]. Содержание животных и все манипуляции с ними проводились
в соответствие с общепринятыми этическими нормами и правилами [3].
Изолированные митохондрии подвергались однократному
воздействию 4000 микроволновых импульсов с частотами повторения в диапазоне 8 –
22 имп./с.
В работе сравнивались показатели дыхания и набухания митохондрий, облученных
ИПМИ и ложнооблученных (подвергавшихся аналогичным манипуляциям, что и
облученные, но без включения источника излучения). Источником ИПМИ служил
лабораторный импульсный генератор на основе магнетрона МИ-505 (Россия, несущая
частота 10 ГГц, выходная пиковая мощность 180 кВт, длительность импульсов 100
нс). Облучение проводилось из открытого конца волновода сечением
10 × 33 мм. Интенсивность воздействия оценивалась по
величине пиковой плотности потока мощности, которая в данном исследовании
составляла от 70 до 1500 Вт/см2.
Дыхание митохондрий определялось по скорости потребления
кислорода. Для этого использовался измеритель кислорода АКПМ-02Л (Россия), снабженный
амперометрическим сенсором АСрО2-01 (Россия) и полярографическая
ячейка объемом 1.3 мл. Среда инкубации содержала 250 мМ сахарозы, 2.5 мМ МgCl2, 5 мМ КН2РО4
(рН 7.4) и 1,0 мг/ мл белка митохондрий. В качестве экзогенного энергетического
субстрата использовался сукцинат (5 мМ). Скорость дыхания выражалась в нмоль О2/мин
на мг белка. Содержание белка в пробах суспензии митохондрий определялось по
Бредфорду [4]. Скорость потребления кислорода изолированными митохондриями
определялась в различных состояниях по Чансу [5]. Для оценки эффективности
работы дыхательной цепи рассчитывался дыхательный коэффициент (отношение
скоростей фосфорилирующего и нефосфорилирующего дыхания), по величине которого
можно судить о степени сопряженности процессов окисления и фосфорилирования, а
также о степени интактности митохондриальных препаратов [5].
Изменение объема митохондрий в суспензии после облучения
ИПМИ регистрировалось с помощью спектрофотометра СФ 103 (Россия) по изменению
оптической плотности пробы при длине волны 540 нм. Состав среды инкубации и
содержание в ней митохондрий были такими же, как и в экспериментах с измерением
дыхания. Регистрация набухания проводилась после добавления в качестве
экзогенного субстрата 5 мМ сукцината. Для измерения скорости набухания
митохондрий в присутствии ионов Ca2+ в инкубационную среду сразу после воздействия ИПМИ
добавлялся раствор CaCl2
в конечной концентрации 200 нмоль/мг белка.
Выборки использованных показателей для каждого из режимов
воздействия получались из экспериментальных данных в 6 повторностях. Измеренные
показатели анализировались в виде средней арифметической величины показателя и
её стандартной ошибки. Статистическая значимость различий между показателями
облученных и ложнооблученных выборок определялась с помощью непараметрического U-критерия Манна-Уитни с использованием пакета программ
Statistica 6.0.
РЕЗУЛЬТАТЫ
Дыхание митохондрий было оценено по
скорости потребления кислорода в разных метаболических состояниях: дыхание на
эндогенных субстратах (V0); в присутствии в среде инкубации 5 мМ сукцината
(V2); фосфорилирущее дыхание в присутствии 200 мкМ АДФ (V3). После облучения
суспензии митохондрий ИПМИ с пППМ 70, 700 и 1500 Вт/см2 выяснилось,
что скорость потребления кислорода
митохондриями на эндогенных субстратах (в метаболическом состоянии 1 по Чансу)
не изменялась после воздействия импульсно-периодического микроволнового
излучения всех используемых интенсивностей и частот повторения импульсов.
Добавление к суспензии облученных органелл сукцината (5 мМ) переводило митохондрии в состояние 2, в результате чего скорость потребления кислорода после воздействия ИПМИ с пППМ 70 Вт/см2 при частотах 8
и 13 имп./с, с пППМ 700 Вт/см2 при частотах 8 и 22 за секунду и с
пППМ 1500 Вт/см2 при частоте 22 имп./с. повышалась до двух раз по отношению к
группе ложного облучения Облученние митохондрий ИПМИ с остальными параметрами
оказалось неэффективным в отношении изменения скорости потребления кислорода в
состоянии 2 в присутствии экзогенного субстрата сукцината и в отсутствие синтеза
АТФ (рисунок 1).
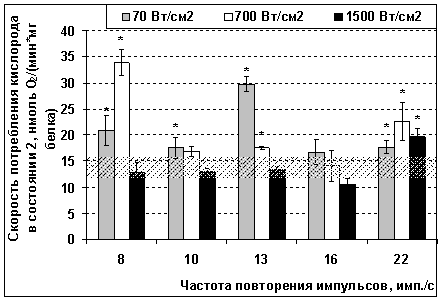
Рисунок 1 – Влияние
импульсно-периодического микроволнового излучения с пиковой плотностью потока
мощности 70, 700 и 1500 Вт/см2 и частотами повторения 8–22 имп./с на скорость
потребления кислорода митохондриями после добавления экзогенного субстрата
дыхания
сукцината (в метаболическом состоянии 2 по Чансу).
Штриховой полосой обозначен 95% доверительный
интервал значений для группы ложного облучения; * – различия между
показателями облученной и ложнооблученной выборок статистически значимы с
уровнем р ≤ 0,05
Коэффициент дыхательного контроля, отображающий степень
сопряжения процессов окисления и фосфорилирования после воздействия
микроволновых импульсов увеличивается только после воздействия с пППМ 1500
Вт/см2 с частотой повторения 10 имп./с (рисунок 2). Во всех
остальных случаях дыхательный коэффициент либо не изменялся (в большинстве из
облученных групп), либо значимо снижался, как после воздействия с
интенсивностью 70 Вт/см2 при частотах 8, 10 и 13 имп./с, а также
после воздействия с пППМ 700 Вт/см2 при частоте 8 имп./с (рисунок
2). Снижение уровня дыхательного коэффициента свидетельствует о разобщении процессов
окисления и фосфорилирования. Поэтому даже на фоне стимуляции дыхания может
наблюдаться снижение продукции АТФ.
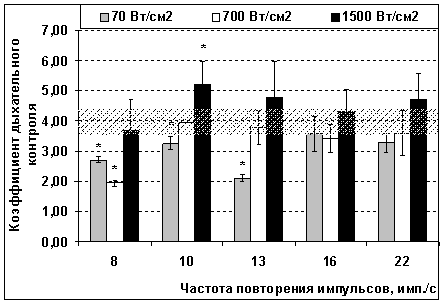
Рисунок 2 – Изменение величины
коэффициента дыхательного контроля после воздействия импульсно-периодического
микроволнового излучения с пиковой плотностью потока мощности 70, 700 и 1500
Вт/см2 и частотой повторения 8–22 имп./с. Обозначения аналогичны
рисунку 1.
Изменение
функционального состояния митохондрий после воздействия ИПМИ должно
сопровождаться изменением ионных потоков через мембрану. В свою очередь, это
должно приводить к изменению их объёма. Изменение объёма митохондрий приводит к
изменению светопропускания суспензии органелл [6-9]. Регистрация изменения
объема митохондрий в среде, содержащей ионы Ca2+, позволяет оценить изменение чувствительности неспецифической
проницаемости митохондрий в ответ на действие различных факторов [7].
На рисунке 3 представлены типичные кривые регистрации
набухания митохондрий по изменению оптической плотности суспензии органелл
после воздействия ИПМИ. Для унификации оценивания эффекта воздействия,
показатели изменения объёма митохондрий регистрировались через 5 мин после прекращения
облучения и, соответственно, через 5 мин после добавления ионов Ca2+, которое
осуществлялось сразу же после прекращения облучения.
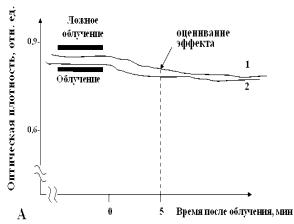
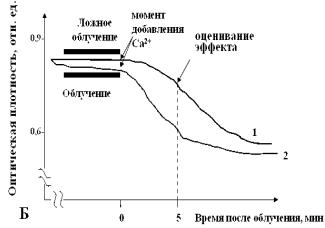
Рисунок 3 – Типичные кривые регистрации
изменения оптической плотности суспензии изолированных митохондрий печени мышей
после воздействия: А – в среде без ионов Ca2+, Б – с
добавлением ионов Са2+ (200 нмоль/мг белка) (подробности в тексте).
После облучения
митохондрий ИПМИ с пППМ 70, 700 и 1500 Вт/см2 при всех использованных
частотах повторения импульсов изменений оптической плотности энергизованных (с 5
мМ сукцината) митохондрий в среде без ионов Са2+ не наблюдалось
(рисунок 4, А). Это указывало на отсутствие существенного изменения
объема митохондрий и означает, что изменения ионных потоков не происходило,
либо потоки изменялись, но суммарный баланс переноса зарядов сохранялся.
При измерении индуцированного ионами Ca2+ набухания облученных
митохондрий наблюдался иной эффект. После воздействия ИПМИ с пППМ 70 Вт/см2
при всех использованных частотах оптическая плотность суспензии энергизованных
митохондрий (дыхание на экзогенном субстрате) повышалась относительно
ложнооблученных образцов (рисунок 4, Б). Это означало, что такое
воздействие приводит к снижению чувствительности неспецифической проницаемости
митохондрий, индуцированной ионами Ca2+. Более интенсивное воздействие ИПМИ (700 Вт/см2)
с частотами повторения 10 и 16 имп./с, наоборот, сопровождалось
уменьшением оптической плотности облученной суспензии. Это может быть результатом
того, что после воздействия с таким режимом повышается чувствительность
неспецифической проницаемости митохондрий к ионам Ca2+ и происходит
более раннее открытие пор неспецифической проницаемости, в органеллы поступает
вода и митохондрии быстрее набухают. Воздействие ИПМИ с интенсивностью 1500
Вт/см2 при всех использованных частотах повторения импульсов значимо
не меняло оптическую плотность, и, соответственно, объем митохондрий в среде с Ca2+ по сравнению с
ложнооблученными образцами.
Б А Б А

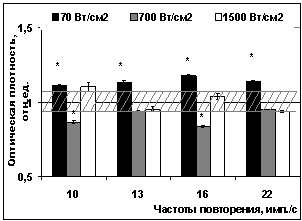
Рисунок 4 – Изменение оптической плотности суспензии митохондрий на 5-й
минуте после воздействия ИПМИ с пППМ 70, 700 и 1500 Вт/см2 и
частотами повторения импульсов 10, 13, 16 и 22 имп./с в среде инкубации: А – в среде без Ca2+, Б – с
добавлением Са2+ (200 нмоль/мг белка). Обозначения
аналогичны рисунку 1.
Заключение
Выполненные эксперименты
показали, что воздействие 4000 импульсов ИПМИ может изменять скорость дыхания митохондрий.
Наиболее эффективно ускорялось дыхание
после воздействий с частотами
повторения 8, 10 и 22 имп./с при интенсивностях 70 и 700 Вт/см2. В этих случаях величина
коэффициента дыхательного контроля уменьшалась, что определенно указывает на
ухудшение функционального состояния митохондрий с точки зрения уменьшения
степени сопряжения окисления и фосфорилирования и снижения возможности
продукции АТФ. Известно [10], что разобщение окисления и фосфорилирования
определяется, в первую очередь, состоянием внутренней мембраны митохондрий, характеризуемое
изменением ее проницаемости, как для протонов, так и для других ионов с соответствующим
набуханием этих органелл. Поэтому, наблюдавшееся изменение объема митохондрий
подтверждает влияние наносекундного ИПМИ на функциональное состояние
митохондрий.
Набухание митохондрий после воздействия
может быть связано с активацией перекисного окисления липидов (ПОЛ), в
результате чего происходит образование перекисей жирных кислот фосфолипидов
мембран митохондрий и увеличение проницаемости внутренней мембраны митохондрий
для протонов и других ионов [10]. Однако, существенного нарушения
фосфолипидного слоя мембран и связанного с этим изменения ионных потоков и
воды, по-видимому, не происходит, поскольку в отсутствие Ca2+ в среде
изменения объема митохондрий не отмечается. Другим механизмом, также приводящим
к повреждению митохондрий, может быть индукция поры неспецифической
проницаемости на внутренней мембране. АФК в определенных условиях могут
потенцировать открытие поры, поэтому эти два механизма обычно взаимосвязаны [7].
Ранее было показано, что воздействие ИПМИ на митохондрии приводит к изменению
уровня одной из АФК, пероксида водорода, в этих органеллах [11]. Поскольку
эффекты изменения объема митохондрий после облучения в отсутствии и при наличии
ионов кальция в среде существенно различаются, это указывает на важную роль
этого иона в реагировании митохондрий на воздействие, по-видимому, за счет
изменения чувствительности поры неспецифической проницаемости. В свое время
W.R. Adey [12] указал на важную роль ионов кальция в формировании эффектов
модулированных радиочастотных излучений. Применительно к митохондриям известно,
что Са2+ оказывают двойственное действие [13]. С одной стороны Са2+
стимулирует окислительное фосфорилирование [14], также стимулируют АТФ-синтазу [15],
а с другой стороны, высокие концентрации ионов Са2+ открывают в
митохондриях поры неспецифической проницаемости, что приводит к удалению
адениновых нуклеотидов из митохондрий [16] и их набуханию.
Таким образом, полученные результаты свидетельствуют, что
ИПМИ с импульсами наносекундной длительности оказывают влияние на
функционирование митохондрий. Поскольку эти органеллы играют важную роль в
поддержании кальциевого гомеостаза клетки [17], можно предполагать что
воздействие ИПМИ, изменяя уровень АФК в изолированных митохондриях, оказывает
влияние на чувствительность неспецифических пор проницаемости мембран органелл
и могут модулировать опосредуемые ионами Са2+сигнальные пути в
клетках.
Работа финансово поддержана Аналитической ведомственной
целевой программой «Развитие научного потенциала высшей школы (2009-2010 и
2011)»; проекты № 2.1.1/2777 и № 2.1.1/13778
Литература:
1. Bolshakov M.A.,
Knyazeva I.R., Rostov V.V., et al. Initiation of free-radical oxidation in
albino mice by exposure to pulse periodic microwaves and x-rays // Biophysics,
2005. Vol. 50. Suppl. 1. PP. 104–109.
2. Pallotti F.,
Lenaz G. Isolation and subfractionation of mitochondria from animal cells and
tissue culture lines// Methods Cell Biology. 2001. Vol. 65. PP. 1–35.
3.
Euroguide on the accommodation and care of animals used for experimental
and other scientific purposes. (Based
on the revised Appendix A of the European Convention ETS 123) FELASA:
Federation of European Laboratory Animal Science Associations, London, UK.
2007. 17 с. www.felasa.eu.
4.
Bradford,
M. M. A rapid and sensitive method for the quantitation of microgram
quantities of protein utilizing the principle of protein-dye binding // Analytical
Biochemistry. 1976. Vol. 7, № 1. PP. 248-254.
5. Chance B.,
Williams G.R. Respiratory enzymes in oxidative phosphorylation. I. Kinetics of
oxygen, utilization // Journal of Biological Chemistry. 1955. Vol. 217. PP.
383–393.
6.
Николс Д. Биоэнергетика. Введение в
хемиосмотическую теорию: Пер. с англ. М.: Мир, 1985. 190 с.
7.
Оливьер П.Дж., Сантос М.С., Узллас К.В.
Тиолзависимые изменения неспецифической проницаемости и дыхания митохондрий,
вызываемые доксорубицином // Биохимия. 2006. Т. 71.
№ 2. С. 247–254.
8.
Пазялова А.А. Влияние микотоксинов
боверицина и энниатина на функциональные системы митохондрий//Известия ПГПУ.
2007. №3. С. 300–307
9.
Crichton P.G., Parker N., Vidal-Puing A.J., et al. Not all mitochondrial carrier proteins support permeability transition pore formation: no involvement of uncoupling protein1 // Bioscience
reports. 2009. V. 30(3). P. 187–192.
10. Брайловская И.В., Старков А.А., Мохова Е.Н. Индукция Ca2+-зависимой поры в
митохондриях печени под действием аскорбата в присутствии низких концентраций
ионов железа // Биохимия. 2001. Т. 66. № 8. С. 1117–1121.
11. Жаркова Л.П., Князева И.Р., Иванов В.В., с соавт. Влияние
импульсно-периодического рентгеновского и микроволнового излучений на уровень
перекисей в изолированных гепатоцитах // Вестник Томского государственного
университета. 2010. № 333. С. 161–163.
12. Adey W.R. Tissue interaction with
nonionising electomagnetic fields // Physiology Review. 1981. V. 61(2).
PP. 435–514.
13. Brookes P.S., Yoon Y., Robotham
J.L., et al. Calcium, ATP, and ROS; a mitochondrial love-hate triangle //
American Journal of Physiology. Cell Physiology. 2004. V. 287.
PP. 817–833.
14. McCormack J.G., Denton R.M.
Mitochondrial Ca2+ transport and the role of intramitochondrial Ca2+
in the regulation of energy metabolism. // Dev Neuroscience. 1993. V. 15.
PP.165–173.
15. Mildaziene V., Baniene R., Nauciene Z.,
et al. Calcium
indirectly increases the control exerted by the adenine nucleotide translocator
over 2-oxoglutarate oxidation in rat heart mitochondria. // Archives of
Biochemistry and Biophysics. 1995. V. 324. PP. 130–134.
16. Halestrap A.P.,
Brennerb C. The adenine nucleotide translocase: a central component of the
mitochondrial permeability transition pore and key player in cell death //
Current Medicinal Chemistry. 2003/ V. 10. PP. 1507–1525.
17. Gunter T.E., Yule D.I., Gunter K.K.,
et al. Calcium and mitochondria. // FEBS Letters. 2004. V. 567.
PP. 96–102.