Биологические науки/5. Молекулярная биология
Булгакова О.В., Берсимбай Р.И.
Евразийский национальный университет
им. Л.Н. Гумилева, Астана, 010008,Казахстан
Роль mTOR сигнальной системы регуляция клеточных функций
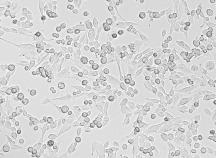
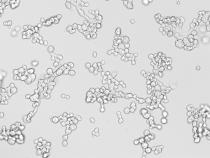
Проведенные нами эксперименты (рис. 1
В, С) продемонстрировали как уменьшение количества клеток, вследствие
апоптоза, так и изменение формы и клеточных размеров по
сравнению с контролем (рис. 1 А).
Причиной последнего эффекта является ингибирование сигнального пути,
опосредованного действием факторов роста, прежде всего инсулино подобного фактора роста (IGF),
ключевым регулятором которого является Akt.
А В
C 
Рисунок
1 -
Морфология клеток линии MDA-MB-435 (Olympus BX61,
увеличение 10Х) (А) контроль Luciferase (B) нокдаун mTOR и линии НЕК 293 Т (С) нокдаун mTOR
Для активации Akt необходимо фосфорилирование данной киназы по двум сайтам
– Thr308
и Ser437
[1-3]. Фосфорилирование Akt по
остатку тирозина Thr308 осуществляется PDK1,
по сайту Ser437
Akt
фосфорилирует mTORC2. Нокдаун mTOR приводит к
нарушению формирования второго комплекса и как следствие снижение
активности Akt. Вестерн-блотинг с применением pAkt437
антител выявил ингибирование фосфорилирования Akt в
клетках, где наблюдается сайленсинг mTOR (рис.2).

Рисунок
2 - Вестерн-блот иммунопреципитатов
полученных из клетоной линии HEK 293T (контроль
и mTOR
нокдаун) с применением mTOR, tubulin, pAkt437
антител.
Все выше изложенное
подтверждает, что mTOR сигналинг регулирует рост
и размер клеток путем активации биосинтеза
белков. Однако данный факт широко известен в научной литературе. Но так как mTOR
функционирует в составе, по крайней мере, двух известных на данный момент
комплексов возникает закономерный вопрос,
какой из компонентов выше названных комплексов (или комплекс в целом)
играет существенную роль в клеточной пролиферации. Для того чтобы найти ответ
на этот вопрос нами был проведен ряд
эксперементов, целью которых являлось ингибирование mTOR
сигнальной системы двумя различными ингибиторами - рапамицином и торином 1.
Хотелось бы подчеркнуть, что выше
названные ингибиторы имеют в основе своего действия различный механизм.
Как известно комплекс FKBP12
– рапамицин дестабилизирует mTORC1 ослабляя присоединение белка раптора к mTOR, и
как следствие происходит снижение уровня фосфорилирования основных субстратов mTORC1 –
S6K1 (рис. 3) и 4E-BP.
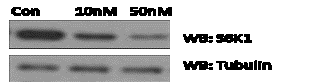
Рисунок
3 - Ингибирование рапамицином (клеточная линия НЕК 293Т, концентрация 10 nM,
50 nM,
экспозиция 10 минут, в качестве контроля (Con)- DMSO;
для вестерн-блотинга использовались pS6K1 (Thr
389) антитела).
Торин 1 в отличие от рапамицина не является
аллостерическим игибитором, и как свидетельствует ряд исследователей, даный
ингибитор полностью подавляет активность как так mTORC 1 и mTORC2 [150].
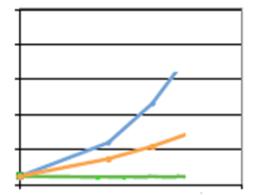
Согласно полученным результатам, хотя
рапамицин-обусловленное ингибирование и приводит к незначительному снижению
клеточной пролиферации, (рис.4 В),
торин 1 обладает более выраженным
эффектом (рис.4 С и 4 А) и если
представить экспериментальные данные в графическом варианте, то можно
проследить четкую обратнопропорциональную зависимость между количеством клеток
и ингибирующим действием торина 1 (рис. 4 D). Как
уже было сказано клетки подвеергшиеся обработке рапамицином хотя и замедляют
свой рост, но не прекащают его полностью (рис.
4 В), в то время как воздействие торина 1 приводит к полной остановке
клеточной пролиферации (рис. 4 С и D). Более того торин 1
вызывает также и уменьшение размера клеток.
Так как в случае рапамицина речь идет об ингибировании активности mTORC1,
то нами было выдвинуто предположение, что выше описанные эффекты торина 1
обусловлены воздействием последнего на mTORC2.
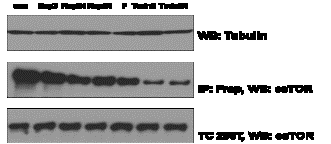
А


В С
![]()
![]()

D
Рисунок 4 –
Ингибирование mTORC1
(А) – результаты иммуноблотинга (использвались рапамицин ( Rap) в
концентрации 10 nM и торин (Torin) – 50 nM,
экспозиция составила 3 часа и 24 часа,
контролем (C) являлся
DMSO) ;
(В)- морфология клеток НЕК 293 Т после 24 часовой инкубации с рапамцином; (С) –
морфология клеток НЕК 293 Т после 24 часовой инкубации с торином 1; (D) –
сравнительный анализ клеточной пролиферации
в контроле, после обработки рапамицином и торином 1 (клеточная линия HEK
293 T,
пассаж клеток 3.5х 106, экспозиция 24 часа).
Однако при
анализе литературных данных (Thoreen и Sabatini), мы выяснили, что
обработка клеток линии MEF Rictor
-/- (нокаутных по гену риктора) торином 1 имела выраженный антипролиферативный
эффект. Что было подтверждено и результатами наших экспериментов.
Таким
образом, выше изложенные факты позволяют нам сделать вывод, что именно mTOR (а
не раптор или риктор) играет основную роль в пролиферации клеток .
ЛИТЕРАТУРА
1. Copp,
J., Manning, G., and Hunter, T. (2009). TORC-specific phosphorylation of
mammalian target of rapamycin (mTOR): phospho-Ser2481 is a marker for intact
mTOR signaling complex 2. Cancer Res 69, 1821-1827.
2. Frias,
M.A., Thoreen, C.C., Jaffe, J.D., Schroder, W., Sculley, T., Carr, S.A., and
Sabatini, D.M. (2006). mSin1 is necessary for Akt/PKB phosphorylation, and its
isoforms define three distinct mTORC2s. Curr Biol 16, 1865-1870.
3. Ikenoue,
T., Inoki, K., Yang, Q., Zhou, X., and Guan, K.L. (2008). Essential function of
TORC2 in PKC and Akt turn motif phosphorylation, maturation and signalling.
EMBO J 27, 1919-1931.