Зиядуллаев
О.Э., Турабджанов С.М., Жураев Р.С., Абдурахманова С.С.
Ташкентский химико-технологический институт, Узбекистан
СИНТЕЗ АРОМАТИЧЕСКИХ АЦЕТИЛЕНОВЫХ СПИРТОВ
НА ОСНОВЕ АНИЛИНА
В молекуле ацетиленовых спиртов имеются тройная
связь и гидроксильная группа, что придаёт им разнообразные химические свойства
[1]. Такие соединения на основе ацетилена синтезируются различными способами,
среди которых широко используемыми являются методы Фаворского, Гринъяра-Иоцича
и диазотирования [2, 3]. Надо отметить, что эти методы для синтеза
ароматических ацетиленовых спиртов (ААС) на основе анилина не использованы.
ААС благодаря важному прикладному значению
используются в широком масштабе в разных отраслях, в том числе в нефте- газовой
промышленности как ингибиторы биокоррозии металлических оборудований, в
качестве ионитов для очистки вредных и сточных вод переработки нефти и газа [4],
в качестве присадки для авиабензинов [5], легкой промышленности,
в сельском хозяйства и в медицине [6].
Метод диазотирования широко используется при
синтезе различных соединений из первичных ароматических аминов с образованием
промежуточных солей диазония [7].
Проведено синтез ААС методом диазотирования
ароматических аминов. Образующиеся диазосоединения взаимодействуют с
ацетиленовыми спиртами (АС) с образованием соответствующих ААС. При этом в
качестве АС были использованы 3-метилбутин-1-ол-3, 3-метилпентин-1-ол-3,
3,4-диметилпентин-1-ол-3, 3,4,4-триметилпентин-1-ол-3
и фенилбутин-1-ол-3 полученные
по методам Фаворского и Гринъяра-Иоцича из ацетилена и соответствующих
карбонильных соединений.
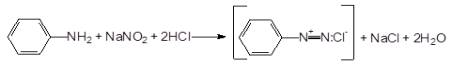
Реакция диазотирования заключается во
взаимодействии нитрозирующих реагентов в кислой среде с первичными
ароматическими аминами с образованием соли диазония. При этом в растворах
разбавленной соляной кислоты и NaNO2 происходит
диазотирование С6Н5NH2 с образованием
устойчивой соли диазония:
Вначале образуется азотистая кислота по реакции:
![]()
Далее образуется ион нитрозония:
![]()
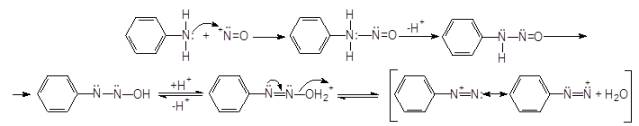
В результате взаимодействия, анилином вначале
образуется N-нитроза аммоний ион, затем N-нитрозамин и за счет
миграции протона образуетсядиазогидроксид и соответствующий ароматический ион
диазония. Пара электронов ковалентной связи С:N в соли диазония
переходит к атому азота, в результате чего происходит нуклеофильное замещение
[8]:
Согласно механизму данная реакция сопровождается
выделением азота и образованием ААС:
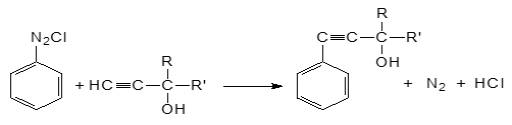
где: R= -CH3, RI=
-CH3; R= -CH3, RI= -C2H5;
R= -CH3,
RI= изо -C3H7, R= -CH3, RI=
-C(СH3)3; R= -CH3, RI= -С6H5.
Процесс диазотирования проводили при температуре
0-5оС. Обоснованием этому является то, что промежуточные диазосоединения
при низких температурах являются устойчивыми, с повышением температуры их выход
уменьшается, при этом увеличивается образование побочных продуктов. Процесс
осуществляли в течение 2 часа при перемешивании реакционной смеси. Полученные
экспериментальные данные представлены в таблице.
Таблица
Сравнительные выходы синтезированных ААС по методу диазотирования
|
Исходный АС |
Полученный ААС |
Выход ААС, % |
|
НСºССОН(СН3)2 |
С6Н5СССОН(СН3)2 |
70,0 |
|
НСºССОН(СН3)С2Н5 |
С6Н5СССОН(СН3)С2Н5 |
58,9 |
|
НССС(СН3)ОНСН(СН3)2 |
С6Н5ССС(СН3)ОНСН(СН3)2 |
56,2 |
|
НССС(СН3)ОНС(СН3)3 |
С6Н5ССС(СН3)ОНС(СН3)3 |
52,7 |
|
НССС(СН3)ОНС6Н5 |
С6Н5ССС(СН3)ОНС6Н5 |
73,4 |
При синтезе ААС по методу диазотирования в
качестве побочных продуктов, образуется фенилхлорид, диазофенилхлорид, а также
фенол.
Методика синтеза 1-фенил-3-метилбутин-1-ола-3. Спирт получен по реакции
Зандмейера через диазотирование анилина. Для этого в колбу помещали 23,25 г
(0,25 моль) анилина в 18 мл разбавленной (1:1) соляной кислоты (0,25 моль),
после чего при перемешивании и охлаждении льдом с солью к смеси добавляли
водный раствор нитрита натрия (0,25 моль) в количестве, эквимолярном взятому
анилину. Последний прикапывали медленно с такой скоростью, чтобы температура не
поднималась выше 5 оС. После этого полученную массу охлаждали до 0 оС
и по капле в течение часа прибавляли 21 г (0,25 моль) 3-метилбутин-1-ола-3.
Далее реакционную смесь 2 часа нагревали на кипящей водяной бане, при этом
бурно выделялся азот, по окончании выделения которого содержимое колбы
перегоняли с водяным паром. Образовавшийся продукт 3 раза (по 100мл)
экстрагировали диэтиловым эфиром, обрабатывали 2н раствором едкого натрия потом
водой, сушили и перегоняли в присутствии гидрохинона. Получено 21,25 г (70,0%)
1-фенил-3-метилбутин-1-ола-3. Ткип=147 оС, d![]() ,
,
![]() .
.
Аналогичным способом из 24,5 г (0,25 моль)
3-метилпентин-1-ол-3 и 23,25 г (0,25 моль) анилина синтезировали
1-фенил-3-метилпентин-1-ола-3 (58,9%). Ткип=160-162 оС, d![]() ,
,
![]() из 28,0 г (0,25 моль)
3,4-диметилпентин-1-ол-3 и 23,25 г (0,25 моль) анилина синтезировали
1-фенил-3,4-диметилпентин-1-ола-3 (56,2%). Ткип=137 оС. d
из 28,0 г (0,25 моль)
3,4-диметилпентин-1-ол-3 и 23,25 г (0,25 моль) анилина синтезировали
1-фенил-3,4-диметилпентин-1-ола-3 (56,2%). Ткип=137 оС. d![]() ,
,
![]() ,
из 31,5 г (0,25 моль) 3,4,4-триметилпентин-1-ол-3и 23,25 г (0,25 моль)
анилина синтезировали 1-фенил-3,4,4-триметилпентин-1-ола-3 (52,7%).
Ткип=134 оС. d
,
из 31,5 г (0,25 моль) 3,4,4-триметилпентин-1-ол-3и 23,25 г (0,25 моль)
анилина синтезировали 1-фенил-3,4,4-триметилпентин-1-ола-3 (52,7%).
Ткип=134 оС. d![]() ,
,
![]() , из 36,5 г (0,25 моль) фенилбутин-1-ол-3 и 23,25 г (0,25 моль) анилина синтезировали
1,3-дифенилбутин-1-ола-3 (73,4%). Ткип=183-185 оС, d
, из 36,5 г (0,25 моль) фенилбутин-1-ол-3 и 23,25 г (0,25 моль) анилина синтезировали
1,3-дифенилбутин-1-ола-3 (73,4%). Ткип=183-185 оС, d![]() ,
,
![]() .
.
Для изыскания возможных областей применения
синтезированных ААС изучена их микробиологическая активность против биокоррозии
трубопроводов нефтяной промышленности [9].
ЛИТЕРАТУРА:
1. Темкин О.Н., Шестаков
Г.К., Трегер Ю.А. Ацетилен: Химия. Механизмы реакций. Технология. М.: 1991, 416
с.
2. Трофимов Б.А.
Некоторые аспекты химии ацетилена // Журнал органической химии. 1995, №9. С.
1368-1372.
3. Новокшонов В.В.,
Медведева А.С., Мареев А.В. 1,4-миграция группы Et3Ge в 1-триэтилгермокси-2-пропине
под действием реактивов Гриньяра // Журнал органической химии. 2001, №4. С.
626-627.
4. Мавланий М.Э., Нурманов С.Э., Зиядуллаев О.Э. Бактериальная микрофлора
нефтяных месторождений Кукдумалак и Северный Уртабулак // Узбекский журнал
нефти и газа. 2013. №2. С. 73-78.
5. Курбанов Ф.К.
Исследование и разработка высокотемпературных ингибиторов коррозии на основе
ацетиленовых соединений. Диссертация доктора химических наук. М.: 1981. С.
4146.
6. Кажева О.Н. Структурные аспекты новых реакций ацетилена и его
производных. Диссертация
доктора химических наук. Черноголовка. 2011. С. 87.
7. http://www. knowledge allbest.ru/chemistry. Реакции диазотирования.
С. 25
8. Белов
Б.И., Козлов В.В. Условия
диазотирования и свойства диазосоединений // Журнал успехи химии. 1963. Том 32,
№ 2, С. 153.
9. Зиядуллаев О.Э. Синтез
и технологии ароматических ацетиленовых спиртов, и их виниловых эфиров на
основе фенилацетилена: дис. канд. хим. наук. Ташкент. 2011. 213 с.