Химия и химические технологии / 5.
к.т.н.
Родионов И.В.
Саратовский государственный технический
университет
Особенности технологии
высокотемпературного
оксидирования металлов
имплантационного назначения
Металлы имплантационного назначения применяются в производстве костных имплантатов для стоматологии, травматологии, ортопедии и нейрохирургии. В соответствии с существующими биотехническими и биомедицинскими требованиями имплантационные металлы должны обладать высоким уровнем совместимости с биоструктурами и действующими механическими нагрузками [1]. Данным условиям удовлетворяет ограниченное число металлических материалов, включающее наиболее широко используемые биоинертные титан ВТ1-0, ВТ1-00 и титановые сплавы ВТ-6, ВТ-16, а также биотолерантную нержавеющую сталь 12Х18Н9Т, 12Х18Н10Т. При этом костные имплантаты из титана и его сплавов чаще применяются в хирургической стоматологии при восстановлении утраченных корней зубов и имеют постоянный характер функционирования в организме. Имплантаты из нержавеющей стали используются, в основном, в травматологии и ортопедии при лечении переломов и исправлении деформаций костей с помощью аппаратов внешнего остеосинтеза. Такие имплантаты имеют временный характер функций и по истечении заданного периода лечения удаляются из организма.
Надежность закрепления имплантатов в кости определяется состоянием поверхности металла и достигается за счет придания ей таких показателей фазово-структурного состояния, которые обеспечивают интеграцию имплантатов с окружающей биотканью с формированием прочной биотехнической системы «имплантат – ткань».
Для придания костным металлоимплантатам биоинтеграционных качеств и высокого уровня биосовместимости на их поверхности создается специальное оксидное покрытие со способностью эффективного физико-механического взаимодействия с костными клеточными структурами, обусловливающего срастание имплантата с костью [2]. Указанная биоинтеграционная способность оксидного покрытия характеризуется наличием у него высокой степени шероховатости и морфологической гетерогенности поверхности при необходимой толщине и благоприятном фазовом составе.
Наиболее простой и распространенной технологией получения оксидных биопокрытий на металлических имплантатах является высокотемпературное оксидирование в различных газовых средах [3-5]. В зависимости от природы металла и характера формирования свойств поверхностных оксидов выбирается способ термооксидирования. Так, для создания биоинтеграционного оксидного покрытия на имплантатах из титана и его сплавов, целесообразно осуществлять оксидирование в среде перегретого водяного пара или в контролируемой атмосфере из смеси инертного (Ar, Ne, Нe) и окисляющего (О2, СО2) газов [6]. В данных физико-химических условиях исключается образование малопрочного и низкокоррозионностойкого нитрида TiN и достигается формирование преимущественно однофазного состава покрытия, состоящего из биоинертного диоксида TiO2. При создании биоинтеграционного покрытия на имплантатах из нержавеющей стали можно использовать воздушно-термическое и паротермическое оксидирование, способствующее образованию металлооксидных слоев с благоприятным фазовым составом, высокими показателями параметров шероховатости и морфологической гетерогенности поверхности при среднем уровне коррозионной стойкости в жидких биосредах [7].
Кроме выбора рациональных условий проведения высокотемпературного оксидирования костных имплантатов необходимо учитывать состояние их поверхности перед обработкой. От исходного состояния поверхности металла в значительной степени зависит качество получаемого оксидного покрытия.
Гладкая шлифованная либо полированная поверхность обеспечивает протекание окислительных процессов равномерно по всей обрабатываемой площади. За счет этого качественное защитное покрытие имеющее, как правило, небольшую толщину (1-3 мкм), отличается высокой структурной плотностью и низкой открытой пористостью при незначительной микрогетерогенности поверхности. Данные характеристики высокооднородного покрытия не позволяют создать условия для интеграции оксидированного имплантата с костью. Формирование покрытия повышенной толщины (20-30 мкм) на гладкой поверхности приводит к его разрушению и отслаиванию от основного металла из-за возникновения в оксидных слоях больших внутренних напряжений. Это делает невозможным использование такого покрытия на костных имплантатах для придания им качеств биомеханической совместимости.
Шероховатая поверхность имплантатов, обработанная абразивно-струйным методом, позволяет создавать оксидные покрытия большой толщины (20-50 мкм) с повышенной адгезионной прочностью и высокими показателями параметров шероховатости и морфологии поверхности, благоприятными для протекания процесса биоинтеграции и надежного закрепления оксидированных имплантатов в организме. При этом морфологически развитая поверхностно-пористая структура имплантатов может быть достигнута как при формировании тонкослойного покрытия, так и при создании толстого слоя оксидов.
В случае создания тонкослойного покрытия выраженная микрогеометрия его поверхности является следствием копирования оксидным слоем рельефа микронеровностей исходной шероховатой поверхности металла (рис. 1).
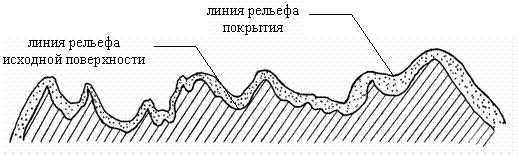
Рис. 1. Копирование микрорельефа шероховатой
металлической
поверхности тонкослойным оксидным покрытием
При формировании толстослойного покрытия поверхность приобретает высокоразвитую трещиноватую структуру за счет микрорастрескивания наружных оксидных слоев (рис. 2). Данное явление обусловлено фрагментацией толстослойного покрытия и появлением новых открытых пор из-за концентрации в нем больших внутренних напряжений. В этих условиях возникающие напряжения превосходят предел прочности оксидных слоев, за счет чего происходит их микрорастрескивание с образованием множества микро- и макрочастиц, создаются структурные несплошности и повышается морфологическая гетерогенность поверхности.
Как показывают оптико-микроскопические исследования фрагментации подвергаются, в основном, поверхностные слои толстого покрытия, обладающие пониженной прочностью. Граничащий с металлом оксидный слой сохраняет свою сплошность и не подвергается трещинообразованию вследствие высокой структурной плотности, механической и адгезионно-когезионной прочности. Данный нижний слой предохраняет металлическую поверхность от коррозии и придает ей достаточный уровень защитных свойств при функционировании оксидированных имплантатов в химически нейтральных биосредах организма.

Рис. 2. Образование трещиноватой структуры и высокой
морфологической
гетерогенности поверхности толстослойного покрытия
Характерной особенностью трещиноватой поверхности оксидных покрытий имплантатов является создание необходимых для биоинтеграции физико-механических условий, которые за счет увеличенных значений размера и глубины пор, а также величины суммарной открытой пористости позволяют осуществлять направленный остеогенез и эффективное взаимодействие оксидированных имплантатов с костными структурами.
Таким образом, высокотемпературное оксидирование шероховатых титановых и стальных имплантатов при определенных технологических режимах позволяет сформировать биосовместимое покрытие с высокой биоинтеграционной способностью (табл.).
Таблица
Рекомендуемые
технологические режимы методов высокотемпературного оксидирования металлоимплантатов для формирования оксидных покрытий с
высокой биоинтеграционной способностью
|
Методы оксидирования |
Металл имплантатов |
Режим |
Характеристики покрытия |
|||||||
|
Фазовый состав |
Толщина, мкм |
Пористость, % |
Коррозионный потенциал в физрастворе (н.х.с.э), В |
Шероховатость, мкм |
||||||
|
t,
0С |
τ, ч |
Ra |
Rmax |
Sm |
||||||
|
Воздушно-термическое |
сталь 12Х18Н9Т, 12Х18Н10Т |
400-500 |
0,5 |
Fe2O3, FeNi, Ti3O5 |
25-40 |
35 |
- 0,36 |
1,0 |
5,8 |
7,3 |
|
Паротермическое |
сталь 12Х18Н9Т, 12Х18Н10Т |
450-550 |
1,5-2 |
Fe, Ti3O5 |
35-50 |
31 |
- 0, 30 |
1,0 |
4,4 |
11,2 |
|
титан ВТ1-0, ВТ1-00, титановый
сплав ВТ-16 |
500 |
2-3 |
TiO2 |
30-40 |
45 |
0,16 |
1,2 |
5,1 |
9,5 |
|
|
Аргонокислородное |
титан ВТ1-0, ВТ1-00, титановый
сплав ВТ-16 |
600-1000 |
2-3,5 |
TiO2 |
45 |
36 |
0, 33 |
1,4 |
6,4 |
14,0 |
Примечание. Перед оксидированием поверхность имплантатов должна пройти предварительную пескоструйную
обработку корундовым абразивом для создания исходной микрошероховатости
и повышения химической активности
Результаты клинических испытаний термооксидированных металлоимплантатов
на лабораторных животных (кролики породы «черный великан») показали, что
оксидные покрытия обеспечивают надежное срастание имплантатов
с костными структурами без возникновения металлоза и
появления воспалительных реакций тканей [8].
На данном основании можно считать, что
технология высокотемпературного оксидирования является эффективным инструментом
придания имплантационным металлам повышенной биосовместимости
и способности адаптации к различным средам организма.
Литература
1. Бутовский К.Г., Протасова Н.В. Материалы, используемые в производстве дентальных имплантатов // Современные проблемы имплантологии. Сборник научных статей по материалам 6-й Международной конференции 20-23 мая, Саратов, 2002. С. 21-29.
2. Родионов И.В., Бутовский К.Г.
Структурно-функциональные характеристики термических и электрохимических
оксидных биопокрытий медицинских костных имплантатов / Маtеriały II Międzynarodowej naukowi-praktycznej konferencji «Perspektywiczne opracowania nauki i techniki – 2007». Przemyśl,
Polsкa:
Nauka i studia. Tym 12. S. 15-19.
3. Родионов И.В. Биоинтеграционная способность покрытий стальных ортопедических имплантатов, полученных высокотемпературной пассивацией на воздухе и в среде перегретого водяного пара / Маtеriály
IV Mezinárodní vĕdecko-praktická konference
«Evropská vĕda XXI století – 2008». Praha, Czech Republic:
Publishing House «Education and Science» s.r.o. Díl 14 (Lékařství).
S. 39-44.
4. Родионов И.В., Бутовский
К.Г. Получение биосовместимых морфологически гетерогенных
покрытий на стальных остеофиксаторах
воздушно-термическим оксидированием / Материалы Всероссийской
научно-практической конференции «Новые технологии создания и применения биокерамики в восстановительной медицине». Томск: Изд-во
ТПУ, 2007. С. 103-108.
5. Родионов
И.В., Бутовский К.Г., Ткачева
А.В., Бейдик О.В. Металлооксидные
биопокрытия фиксаторов для чрескостного
остеосинтеза // Инженерная физика. №4, 2007. С.
58-61.
6. Родионов И.В.
Способ получения биопокрытий на стоматологических и
ортопедических костных имплантатах термооксидированием в смесях инертных и окисляющих газов / Маtеriály IV Mezinárodní vĕdecko-praktická konference «Efektivní nástroje moderních vĕd – 2008». Praha, Czech
Republic: Publishing House «Education and Science» s.r.o. Díl 15 (Chemie
a chemická technologie). S. 52-55.
7. Родионов И.В., Бутовский К.Г., Анников В.В., Хапрова Т.С. Фазовый состав и коррозионное поведение биопокрытий чрескостных фиксаторов из стали 12Х18Н9Т, полученных термическим оксидированием / Сб. докладов 2-го Междунар. научно-технического симпозиума «Наноструктурные функциональные покрытия и материалы для промышленности» Харьковской нанотехнологической ассамблеи – 2007. Т.1. Наноструктурные материалы. Украина, Харьков, 2007. С. 134-138.
8. Родионов
И.В. Клинико-биологическая оценка уровня приживления имплантатов
с электрохимическими и газотермическими оксидными биопокрытиями / Маtеriály IV Mezinárodní vĕdecko-praktická konference «Efektivní nástroje moderních vĕd – 2008». Praha, Czech Republic: Publishing House «Education and Science» s.r.o. Díl 13 (Lékařství). S. 17-23.