Технічні науки / Металургія
Грицай В.П., Печеннікова
В.М., Іванов В.І., Моісейко Ю.В.
Запорізька державна
інженерна академія
про осадження міді з розчину сульфату цинку
Відомий метод одержання цинку з сульфідних цинкових концентратів передбачає
випалювання концентрату за температури 950…1050° С, його
подальше розчинювання за температури 50…70° С в слабкому
розчині сірчаної кислоти (70…100 г/дм3) та очищення одержаного
розчину сульфату цинку від заліза, міді, миш’яку й інших домішок для подальшого
електролізу цинку [1,2].
Через недостатнє вивчення стадії очищення розчину сульфату цинку від
домішок одержані розчини не завжди задовольняють вимогам електролізу цинку, що
знижує техніко-економічні показники зазначеного методу в цілому.
Як початкові матеріали для розглядання кінетики осадження міді (однієї з
небажаних домішок під час електролізу цинку) з водяного розчину сульфату цинку
використовували хімічні чисті сульфати цинку та міді, а також цинковий пил
наступного гранулометричного складу, %:
фракція +2,0 мм – 0,98; фракція -2,0…+1,0 мм – 17,20; фракція
-1,0…+0,5 мм – 24,42; фракція -0,4…+0,25 мм – 19,90; фракція -0,25 мм –
46,50.
Осадження міді з водяного розчину сульфату цинку здійснювали за температури
20, 40 і 60° С
методом цементації за допомогою цинкового пилу в кількості, що відповідає
напів-, одно- та двократній витраті за стехіометрією згідно реакції:
![]() . (1)
. (1)
Для всіх експериментів початковий вміст міді та цинку в розчині, що
досліджували, був постійним: 3,0 і 130,0
г/дм3 відповідно.
Вивчали ступінь осадження міді з розчину сульфату натрію залежно від
тривалості експерименту, температури розчину та витрати цементатора.
Встановлено, що з підвищенням температури розчину ступінь осадження міді
помітно зростає.
Аналіз результатів проведених експериментів свідчить про достатню
ефективність осадження міді з водяного розчину сульфату цинку за температури
40…60° С.
Завершення осадження всієї міді з розчинів, що містять цинк, спостерігали за
температури 60° С і
двократної витрати цинкового пилу та тривалості процесу осадження шість хвилин.
Під час використання такої ж кількості цинкового пилу, але за температури 20 і
40° С,
ступінь осадження міді дорівнював відповідно 76 і 87 %.
Математичну обробку результатів експериментів, одержаних за раціональних
технологічних параметрів, здійснювали з використанням відомих кінетичних
рівнянь [3,4]:
![]() ;
(2)
;
(2)
![]() , (3)
, (3)
де К – константа швидкості реакції
осадження міді з розчину; t – тривалість
експерименту; а, х – початковий вміст міді та кількість
міді, що виділено з розчину сульфату цинку, відповідно; V – швидкість осадження міді з
розчину; t – температура
експерименту; m – порядок
реакції.
З використанням рівняння (2) обчислювали значення константи швидкості
реакції осадження міді К з
водяного розчину сульфату цинку для різних часових інтервалів, а також
її середнє значення (![]() ) за прийнятими температурними режимами:
) за прийнятими температурними режимами: ![]() = 0,277 за температури 20° С;
= 0,277 за температури 20° С; ![]() = 0,454 за температури
40° С;
= 0,454 за температури
40° С; ![]() = 0,610 за температури
60° С.
= 0,610 за температури
60° С.
Набутих значень константи швидкості реакції осадження міді підставляли до
рівняння (3) та розраховували порядок реакції:
m = 0,65.
Значення константи, що визначено експериментально-розрахунковим шляхом,
дозволили обчислити величину уявної енергії активації процесу осадження міді з
розчину сульфату цинку за допомогою цинкового пилу: Е = 7940 Дж/моль.
Враховуючи залежність К від
різних чинників, рівняння (3) можна записати як
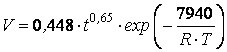 ,
(4)
,
(4)
Невелике значення уявної енергії активації та порядок реакції (1), який є
близьким до першого, дозволяють припустити, що процес осадження міді з розчину
сульфату цинку здійснюється за дифузійним режимом.
Література:
1. Худяков И.Ф.,
Дорошкевич А.П., Карелов С.В. Металлургия вторичных тяжелых цветных металлов. -
М.: Металлургия, 1967. - 528 с.
2. Зайцев В.Я.,
Маргулис Е.В. Металлургия свинца и цинка. - М.: Металлургия, 1985. - 263 с.
3. Гетерогенные
химические реакции / Под ред. М.М. Павлюченко. - Минск: Изд-во Министерства высшего и среднего
образования БССР, 1961. - 262 с.
4. Вейнис С.М.
Химическая кинетика и расчеты промышленных реакторов. - М.: Химия, 1967. - 414 с.