Д. х. н. професор Братенко М. К., к.х.н.
Панасенко Н. В.
Буковинський державний медичний університет.
58000, м. Чернівці, пл. Театральна 2, Україна.
ПІРАЗОЛОВМІСНІ 1,3-БЕНЗОТІАЗИН-4-ОНИ
Розроблено метод синтезу
2-(піразол-4-іл)-2,3-дигідро-4Н-1,3-бензотіазин-4-онів, який грунтується на
реакції циклоконденсації N- алкіл(арил) 1,3-дизаміщених
4-піразолілімінів із тіосаліциловою кислотою при довготривалому кип’ятінні в
толуолі.
Ключові
слова: 4- піразоліліміни, тіосаліцилова кислота,
2-(піразол-4-іл)-2,3-дигідро-4Н-1,3-бензотіазин-4-они, циклоконденсація
3,4-Дигідро-1,3-бензотіазин-4-они
належать до біциклічних систем із вираженим комплексом біологічної дії. Серед
них виявлені селективні інгібітори циклооксигенази другого типу (СОХ-2) [1],
локальні анестетики [2], імунопотенціюючі [3], антимурацидні [4], антималярійні
[5] та бактерицидні [6, 7]
агенти. Саме тому впродовж останніх років не втрачає своєї актуальності
проблема хімічної модифікації частково гідрованого бензотіазинового скафолда
різноманітними фрагментами. Відомі на сьогодні представники цього типу сполук,
зазвичай містять у положенні 2 тіазинолінового циклу аліфатичні та ароматичні
замісники. Їх гетерилвмісні аналоги обмежуються прикладами 2-хінолініл- [6] та
2-індоліл- [7] 2,3-дигідробензотіазин-4-онів. У силу цього для одержання нових
потенційно біоактивних речовин, предметом нашого дослідження стали сполуки
бензотіазинового ряду, в яких у положенні 2 циклу «вмонтовані» фармакофорні
піразолільні структурні елементи [8].
З урахуванням літературних даних [4, 6, 7]
поставлена задача розв’язувалася шляхом формування 2,3-дигідробензотіазинової
системи за рахунок циклоконденсації 4-піразолілімінів (І а-ж) із
тіосаліциловою кислотою. Установлено, що нагрівання вказаних реагентів у
киплячому толуолі впродовж 10 год призводить до утворення
2-(4-піразоліл)-2,3-дигідро-4Н-бензотіазин-4-онів
(ІІІ а-ж) із
виходами 39-73 %.
Зауважимо, що використання з цією метою трикомпонентної однореакторної реакції
відповідних 4-формілпіразолів, аліфатичних амінів і тіосаліцилової кислоти
(пор. [1]) менш ефективне, оскільки виходи продуктів при цьому зменшуються на
20-30 %.
Відносно довгий інтервал перебігу процесу порівняно з імінами ароматичних
альдегідів [7], очевидно, пов’язаний зі стеричними перешкодами в імінопохідних
(І а-ж),
обумовленими впливом об’ємних ароматичних замісників у положенні 3 піразольного
ядра.
Найвірогідніше, що подібно до конденсації за участю 3-меркаптопропанової
кислоти [9], реакція реалізується за схемою первинного утворення проміжних
продуктів тіоамінального типу (А), подальша дегідратація яких призводить до
замикання циклу й утворення цільових сполук (ІІІ а-ж).
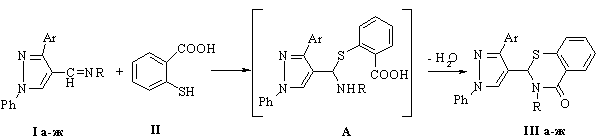
І, ІІІ, R=Ме, Ar=Ph (а),
4-ClC6H4 (б), 4-BrC6H4 (в), 4-MeOC6H4 (г),
3,4-(MeO)2C6H3 (д),
2-тіє-ніл (е); R=PhCH2, Ar=Ph (є); R=4-ClC6H4CH2, Ar=Ph (ж)
Індивідуальність та склад синтезованих піразолілбензотіазинів (ІІІ а-ж)
підтверджені даними елементного аналізу та хроматомас-спектрів (табл. 1), а
структура – результатами вимірів ІЧ- та ЯМР 1Н спектрів (табл. 2). В
останніх найвагоміша доказова база - це наявність синглетів СН-протонів у
положення 2 дигідротіазинового циклу в діапазоні 6.41-6.61 м.ч.
Експериментальна частина
ІЧ-спектри сполук у таблетках КВr записані на
прикладі UR-20. Спектри ЯМР 1Н виміряні на прикладі Bruker Avance
DRX (500.13 МГц), внутрішній стандарт – ТМС. Хроматомас-спектри одержані на приладі PE SCXAPI 150 EX, детектори UV (250 нм) та ELSOJ.
3-Заміщені
2-[3-арилтієніл-1-феніл-1Н-піразол-4-іл]-2,3-дигідро-4Н-1,3-бензотіазин-4-они
(ІІІ а-ж)
Суміш 0.003 моль 4-піразоліліміну (І а-ж) та 0,318 г (0,003 моль) тіосаліцилової кислоти (ІІ)
кип’ятили впродовж 10 год у 10 мл безводного толуолу. Розчинник випарювали,
залишок кристалізували з етанолу.
Висновки
Розроблено спосіб синтезу 2-(піразоліл-4-іл)-2,3-дигідро-4Н-1,3-бензотіазин-4-онів, який базується
на циклоконденсації 4-піразолілімінів з тіосаліциловою кислотою в киплячому
толуолі.
Таблиця 1
Характеристики
сполук ІІІ а-ж
|
Сполука |
Формула |
[М+1]+ |
Знайдено, % Вирахувано |
Ттопл ºС. |
Вихід, % |
||
|
C |
H |
N |
|||||
|
ІІІ а |
C24H19N3OS |
398 |
72.28 72.52 |
4.93 4.82 |
10.35 10.57 |
143-145 |
57 |
|
ІІІ б |
C24H18ClN3OS |
432 |
66.44 66.74 |
4.32 4.20 |
9.97 9.73 |
196-198 |
68 |
|
ІІІ в |
C24H18BrN3OS |
477 |
60.30 60.51 |
3.93 3.81 |
8.64 8.82 |
273-275 |
41 |
|
ІІІ г |
C25H21N3O2S |
428 |
70.06 70.24 |
5.04 4.95 |
9.94 9.83 |
187-189 |
52 |
|
ІІІ д |
C26H23N3O3S |
458 |
68.53 68.25 |
5.18 5.07 |
9.01 9.18 |
137-139 |
73 |
|
ІІІ е |
C22H17N3OS2 |
404 |
65.76 65.48 |
4.17 4.25 |
10.54 10.41 |
197-199 |
39 |
|
ІІІ є |
C30H23N3OS |
474 |
76.34 76.08 |
4.99 4.90 |
8.71 8.87 |
181-183 |
73 |
|
ІІІ ж |
C30H22ClN3OS |
509 |
71.23 70.93 |
4.25 4.36 |
8.46 8.27 |
209-211 |
68 |
Таблиця
2
Спектри
ІЧ та ЯМР 1Н сполук ІІІ а-ж
|
Сполука |
ІЧ
спектр, С=О |
Спектри
ЯМР1Н, δ. м.ч.( J,
Гц) |
|
ІІІ а |
1665 |
3.34 с (3Н, CH3),
6.53 с (1H, Н2бензотіазин),
7.16-8.06 м (15Н, 14Наром+ Н5піразол) |
|
ІІІ б |
1660 |
3.30 с (3Н, CH3),
6.61 с (1H, Н2бензотіазин),
7.18-8.11 м (14Н, 13Наром+ Н5піразол) |
|
ІІІ в |
1660 |
3.26 с (3Н, CH3),
6.58 с (1H, Н2бензотіазин),
7.14-8.08 м (14Н, 13Наром+ Н5піразол) |
|
ІІІ г |
1665 |
3.24 с (3Н, CH3),
3.84 с (3Н, CH3),
6.49 с (1H, Н2бензотіазин),
7.08-8.12 м (14Н, 13Наром+ Н5піразол) |
|
ІІІ д |
1665 |
3.23 с (3Н, CH3),
3.84 с (3Н, CH3),
3.86 с (3Н, CH3),
6.47 с (1H, Н2бензотіазину),
7.07-8.04 м (13Н, 12Наром+1Н5піразол) |
|
ІІІ е |
1665 |
3.21 с (3Н, CH3),
6.52 с (1Н, Н2бензотіазин), 7.22-8.10 м (13Н, 12Наром+Н5піразол) |
|
ІІІ є |
1616 |
4.62 д (1Н, CHА, J 14.8
Гц), 5.26 д (1Н, CHВ, J 14.8
Гц), 6.41 с (1H, Н2бензотіазин),
7.19-8.13 м (20Н, 19Наром+1Н5піразол) |
|
ІІІ ж |
1660 |
4.63 д (1Н, CHА, J 15.2
Гц), 5.20 д (1Н, CHВ, J 15.2
Гц), 6.47 с (1H, Н2бензотіазин),
7.19-8.08 м (19Н, 18Наром+1Н5піразол) |
Список літератури
1. Zarghia
A. Design and synthesis of new 1,3-benzthiazinan-4-one
derivatives as selective cyclooxygenase (COX-2) inhibitors / A. Zarghia, T. Zebardasta, B. Daraieb [et.al.] //
Bioorg. Med. Chem. - 2009. - Vol.
17, № 15. - P.
5369-5373.
2. Pat.
WO 2004013111(A1). 2-Substituted bicyclic benzoheterocyclic compounds and their
use as sodium channel blockers / D. J. Kyle, Q.Sun, S. F. Victory. applicant Euro Celtique Sa. - № 023791.
filed. 30.07.2003; publ.
12.02.2004. http:// espacenet.com.
3. Lia
X. Synthesis and biological activity of bi/tricyclic azasugars fused
thiazolidin-4-one and thiazinan-4-one by microwave-assisted tandem
Staudinger/aza-Wittig/cyclization / X. Lia, Z. Qina, T. Yanga, [et.al.] //
Bioorg. Med. Chem. Lett.
-2012. - Vol. 22, № 8. - P. 2712-2716.
4. Krapcho
J. Syntheses and pharmacological activity of compounds related to the
antidepressant,
5-(2-dimethylamino-ethyl)-2,3-di-hydro-2-phenyl-1,5-benzothiazepin-4(5H)-one
(thiazesim). III / J. Krapcho, C. F. Turk, J. J. Piala [et.al.] // J. Med. Chem. -1968. - Vol. 11,
№ 2 - P. 361-364.
5. Mei Z.-W.
Synthesis and in Vitro Antimalarial Testing of Neocryptolepines: SAR Study for
Improved Activity by Introduction and Modifications of Side Chains at C2 and
C11 on Indolo[2,3-b]quinolines / Z.-W. Mei, L. Wang,
W.-J. Lu [et.al.]
// J. Med. Chem. -
2013. - Vol.
56, № 4. - P.
1431-1442.
6. Mohamed
E. A. Synthesis and biological activity of some
3-heterocyclyc-4-hydroxy-6-methyl-2(1H)- quinolones / E. A. Mohamed, M. M.
Ismail, Y. Garb [et.al.]
// Ind. J. Chem.
B -1995. - Vol. 34,
№ 1. - P. 21-26.
7. Kamel
M. M. Synthesis, antitumor activity and molecular docking study of novel
Sulfonamide-Schiff's bases, thiazolidinones, benzothiazinones and their
C-nucleoside derivatives / M. M. Kamel, H. I. Ali, M. M. Anwar [ et al.]
// Eur. J. Med. Chem. -
2010. - Vol.
45, № 2- P.
572-580
8. Vovk М.V. 4-Funktsiоnalnozamishchеnі pіrаzоly. / М. V. Vovk, М. К.
Brаtеnkо, V. О. Chоrnоus - Chernivtsi.: Prut,
2008.- 285 s.
9. Surrey
A. R. Central Nervous System Depressants. The Preparation of Some
2-Aryl-4-metathiazanones / A. R. Surrey, W. G. Webb, R. M. Gesler [ et al.]
// J. Am. Chem. Soc.- 1958.-Vol. 80,
№ 7. - P. 3469-3471.