Кухарская Т.А., к.б.н. Ерошевская Л.А., к.х.
д.х.
Институт микробиологии НАН Беларуси, Минск
*Институт биоорганической химии НАН Беларуси, Минск
Факторы,
влияющие на образование комплекса
(3'−5')-специфическая
нуклеаза/фосфатаза грибом
Spicaria violacea
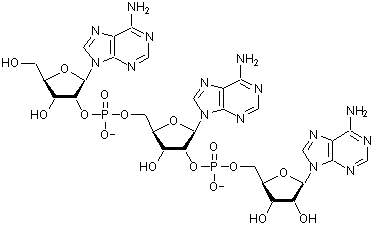 (2'-5')-Олигоаденилаты
общей формулы А(2'р5'А)n-1 [далее (2'-5')Аn] представляют собой олигонуклеотиды, состоящие из нескольких фрагментов аденозина, связанных между собой (2'-5')-фосфодиэфирной связью
(рисунок).
(2'-5')-Олигоаденилаты
общей формулы А(2'р5'А)n-1 [далее (2'-5')Аn] представляют собой олигонуклеотиды, состоящие из нескольких фрагментов аденозина, связанных между собой (2'-5')-фосфодиэфирной связью
(рисунок).
Рисунок –
Структурная формула тримера (2'-5')А3
Эти соединения обладают
активностью против вирусов растений и животных [1−3]. При этом наибольшую
биологическую активность проявляют три- и тетрамеры. Главными
недостатками химических способов получения (2'-5')Аn является их сложность и многостадийность.
Ранее нами селектирован гриб Spicaria violacea, мицелий и фильтрат культуральной
жидкости (КЖ) которого содержит фосфатазу и специфическую нуклеазу, способную
гидролизовать (3'-5')-, но не (2'-5')- фосфодиэфирные связи [4]. Указанные
свойства гриба могут позволить использовать его при химико-ферментативном
получении (2'-5')Аn, основанном на избирательном гидролизе химически
синтезированного полиаденилата, содержащего (3'-5')-
и (2'-5')-межнуклеотидные фосфодиэфирные связи [5].
Цель настоящей работы состояла
в подборе питательной среды, обеспечивающей высокий уровень рассматриваемого
комплекса ферментов и изучении факторов, влияющих на его образование.
Объекты и методы исследования. В работе использовали штамм гриба Spicaria violacea
БМ-105Д (далее S. violacea),
хранящийся в Белорусской коллекции непатогенных микроорганизмов Института
микробиологии НАН Беларуси. Для культивирования гриба в качестве исходной
использовали среду Чапека. Для поддержания кислых
значений рН среды в процессе роста гриба в нее
вносили 0,4% молочной кислоты. Культивирование гриба проводили глубинным
способом в колбах Эрленмейера объёмом 250 мл, содержащих
по 100 мл питательной среды, на биологической качалке (180–190 об /мин) в
течение 5 сут. при 25оС.
Смешанный
(2'-5')/(3'-5')-полиаденилат (далее смешанный полиаденилат) получали полимеризацией
2′(3′)-АМФ [5].
Активность
изучаемого комплекса ферментов определяли по скорости накопления аденозина. Для этого смесь (0,5 мл), содержащую 5 мг/мл
смешанного полиаденилата в
Результаты и обсуждение. При изучении влияния
источников углерода на способность гриба S. violacea продуцировать комплекс
(3'-5')-специфическая нуклеаза/фосфатаза нами были исследованы гексозы,
дисахариды, крахмал и многоатомные спирты. Результаты экспериментов по подбору
источников углерода представлены в табл. 1.
Таблица 1
Влияние источников углерода на продуцирование комплекса
(3'-5')-специфическая нуклеаза/фосфатаза грибом S. violacea
|
Источник углерода, 2% |
Биомасса, мг/мл |
Ферментативная активность комплекса,
ед/мл |
|
Глицерин |
8,5 |
845 |
|
Глюкоза |
9,2 |
1010 |
|
Крахмал |
9,4 |
730 |
|
Лактоза |
3,6 |
250 |
|
Сахароза |
8,9 |
935 |
|
Сорбит |
5,4 |
240 |
|
Фруктоза |
8,6 |
869 |
|
Мальтоза |
10,2 |
845 |
|
Арабиноза |
6,4 |
670 |
|
Ксилоза |
2,1 |
206 |
Как видно из данных,
представленных в табл. 1, гриб хорошо рос на всех изученных источниках
углерода, за исключением лактозы и ксилозы, но максимальная биосинтетическая
активность – 1010 ед/мл наблюдалась при росте на
среде с глюкозой. Изучение влияния концентрации глюкозы на продуцирование
комплекса (3'-5')-специфическая нуклеаза/фосфатаза показало, что оптимальной
является 5% концентрация этого углевода.
Из литературы известно,
что добавление к синтетическим питательным средам органических источников азота
стимулирует синтез микроорганизмами фосфогидролаз [6].
Результаты опытов по исследованию влияния таких добавок на продуцирование
ферментного комплекса приведены в табл. 2.
Как видно из данных,
представленных в табл. 2, хуже всего гриб растет на среде с добавкой дрожжевого
экстракта, а лучше всего на среде с пептоном, где также наблюдается и
максимальный уровень ферментативной активности.
Таблица 2
Влияние органических источников азота на продуцирование комплекса
(3'-5')-специфическая нуклеаза/фосфатаза грибом S. violacea
|
Источник азота, 0,1% |
Биомасса, мг/мл |
Ферментативная активность комплекса,
ед/мл |
|
Гидролизат казеина |
8,4 |
1240 |
|
Дрожжевой экстракт |
5,0 |
635 |
|
Пептон |
10,7 |
1 360 |
|
Кукурузный экстракт |
8,6 |
1 090 |
Эксперименты по
определению оптимальной концентрации пептона в среде культивирования показали,
что наиболее высокий выход ферментативной активности наблюдался при 0,5%-ной
концентрации этого источника азота.
Поскольку ортофосфат, являясь одним из конечных продуктов ферментативного
расщепления полинуклеотидов, он способен
репрессировать биосинтез ферментов, участвующих в этом расщеплении. Как следует
из результатов наших экспериментов, представленных в табл. 3, увеличение
концентрации фосфата в среде свыше 0,015% приводит лишь к незначительному
увеличению роста культуры, но резко снижает уровень ферментативной активности филь-трата КЖ.
Таблица 3
Влияние концентрации фосфата на продуцирование комплекса
(3'-5')-специфическая нуклеаза/фосфатаза грибом S. violacea
|
Концентрация фосфата, % |
Биомасса, мг/мл |
Ферментативная активность комплекса,
ед/мл |
|
0,010 |
14,0 |
2 750 |
|
0,015 |
14,2 |
2 940 |
|
0,030 |
14,5 |
1 500 |
|
0,060 |
15,1 |
560 |
Для изучения влияния аэрации среды на рост культуры и
продуцирование комплекса (3'-5')-специфическая нуклеаза/фосфатаза гриб выращивали
в колбах с различной степенью заполнения средой. Как видно из табл. 4, наиболее
активно ферментный комплекс накапливается в КЖ при величине отношения объема
питательной среды к объему колбы, равной 0,3–0,4. Как увеличение, так и
уменьшение этого параметра приводит к снижению уровня активности ферментного
комплекса. Следует отметить, что неблагоприятное влияние избыточной аэрации на
биосинтез фосфогидролаз отмечали и другие авторы [6].
Таблица 4
Влияние аэрации на продуцирование комплекса (3'-5')-специфическая нуклеаза/фосфатаза
грибом S. violacea
|
Степень заполнения колбы питательной
средой, % |
Биомасса, мг/мл |
Ферментативная активность комплекса,
ед/мл |
|
60 |
9,9 |
1 310 |
|
50 |
13,0 |
2 480 |
|
40 |
14,2 |
2 930 |
|
30 |
14,4 |
2 800 |
|
20 |
14,7 |
2 370 |
|
10 |
15,3 |
1 930 |
Результаты экспериментов по влиянию рН
питательной среды на продуцирование комплекса (3'-5')-специфическая
нуклеаза/фосфатаза грибом S. violacea суммированы в табл. 5. Видно,
что гриб растет в
достаточно широких пределах рН, но максимальное накопление
ферментативной активности достигается при культивировании в среде с узким диапазоном
рН, равном 4,5–5,0. Увеличение начального рН выше этих значений ведет к значительному снижению активности,
не оказывая заметного влияния на выход биомассы продуцента.
Таблица 5
Влияние начального рН питательной среды на
продуцирование комплекса (3'-5')-специфическая нуклеаза/фосфатаза грибом S. violacea
|
Начальный рН
питательной среды |
Биомасса, мг/мл |
Ферментативная активность
комплекса, ед/мл |
|
4,5 |
14,1 |
2 910 |
|
5,0 |
14,2 |
3 110 |
|
5,5 |
14,5 |
2 230 |
|
6,0 |
14,8 |
1 850 |
Таким образом, в результате проведенных исследований оптимизированы состав питательной
среды и условия культивирования гриба S. violacea БМ-105Д – продуцента комплекса (3'-5')-специфическая нуклеаза/фосфатаза, что позволило повысить выход комплекса ферментов
в 3 раза по сравнению с исходным уровнем. Полученные результаты открывают
перспективу создания в будущем новых препаратов для защиты растений от вирусных
заболеваний.
Литература:
1. Devash, Y. Maltiplication of tobacco mosaic virus in tobacco leaf disks is inhibited by (2′-5′)oligoadenylate / Y. Devash, S. Biggs,
I. Sela // Science.
– 1982. – Vol. 216, № 4553. – P. 1415–1416.
2. Кaнавалава, Г.I. Выкарыстанне iнгiбiтарау вiрусау пры аздарауленнi бульбы метадам
культуры тканкi / Г.I. Кaнавалава // Весцi АН Беларусi,
cер. бiял. навук.
– 1990, № 6. – С. 70–72.
3. Kara, J. Изучение
антивирусного и антиклеточного действия синтетического
(2′-5′)-олигоаденилата (A2′p5′A2′p5′A) на
мышах с лейкемией Раушера / J. Kara,
O. Mach, J. Smrt // Acta Virol. – 1983. – Vol.
27, № 6. – P. 477–483.
4. Химико-энзиматический синтез 2′,5′-олигоаденилатов
с использованием нуклеазы мицелиального гриба Spicaria violacea / Т.И. Кулак [и др.] // Химия
природных соединений. – 2007. – № 2. – С. 200–201.
5. Применение нуклеаз для синтеза 2′-5′-олигоаденилатов
и их аналогов / М.Я. Карпейский [и др.] // Биоорган. химия. – 1983. – Т. 9, № 4. – С. 496–504.
6. Кислые фосфатазы грибов / Л.В. Югова [и др.]
// Микробиологическое производство (обзорн. информ.), М., ВНИИСЭНТИ СССР, 1991. – Вып.
8. – 18 с.