К.б.н. Титович О.И., д.б.н. Зинченко
А.И.
Институт микробиологии НАН Беларуси,
г. Минск
Ферментативный
синтез цитидин-5'-дифосфатхолина
Цитидин-5'-дифосфатхолин
(ЦДФХ) – коньюгат нуклеотида с холином, необходимый для биосинтеза
фосфолипидов, составляющих клеточные мембраны [1]. Изучение метаболизма ЦДФХ
привело к открытию его значительного фармакологического потенциала [2–4]. Установлено,
что экзогенный ЦДФХ может являться эффективным лекарственным средством для
терапии сосудистой недостаточности и неврологических заболеваний (в частности инсульта),
травм головного мозга и болезни Паркинсона [3, 5].
Показано, что применение ЦДФХ эффективно при лечении глаукомы [6].
В
настоящее время известно, что ЦДФХ образуется из цитидин-5′-трифосфата (ЦТФ)
и холинфосфата в результате обратимой реакции, катализируемой
холинфосфат-цитидилтрансферазой (КФ 2.7.7.15), которая широко распространена
среди про- и эукариот [7].
Целью настоящего исследования
является разработка метода получения ЦДФХ с помощью клеток пекарских дрожжей.
Материалы и методы. В работе использовали цитидин-5′-монофосфат
(ЦМФ), ЦТФ, а также ЦДФХ, холин-хлорид и фосфохолин-хлорид фирмы «Sigma» (США). Цитидин-5′-дифосфат
(ЦДФ) синтезировали, как описано нами ранее в работе [8]. Ход всех реакций
контролировали с помощью тонкослойной хроматографии (ТСХ) на пластинах
Silufol-UV254 фирмы Serva (Германия) в системе растворителей:
диоксан–вода–25%-ный водный аммиак (6:6:1).
Для
количественного определения выхода реакции пятна, содержащие ЦДФХ, элюировали 5
мл
Клетки
коммерческих пекарских дрожжей (Saccharomyces cerevisiae)
высушивали при 28°С в течение 24 ч либо получали т.н.
«ацетоновый порошок» путем обработки их 2 объемами ацетона.
Реакцию
синтеза ЦДФХ проводили при 30°С в среде, содержащей
Результаты и их обсуждение. Выбор объекта исследований был обусловлен
следующими обстоятельствами. Как мы ранее показали [9], клетки пекарских
дрожжей способны трансформировать природные и модифицированные нуклеозид-5′-монофосфаты
(в том числе и ЦМФ) в нуклеозид-5′-трифосфаты в условиях протекания в
клетках процессов гликолиза. Также известно, что пекарские дрожжи содержат
ферментные системы, необходимые для синтеза ЦДФХ [10].
Ранее
в ряде работ, в том числе и нами [8], было установлено, что интактные клетки
дрожжей не проявляют киназной активности при биокаталитическом фосфорилировании
нуклеозидов и нуклеотидов и приобретают такую способность после перфорации
клеточной стенки. В связи с этим, на первом этапе разработки метода получения
ЦДФХ нами было изучено влияние способа обработки клеток пекарских дрожжей на выход
целевого продукта (табл. 1).
Таблица 1
Влияние способа обработки клеток
дрожжей на выход ЦДФХ
|
Ферментный
препарат |
Выход ЦДФХ,
% |
Время реакции,
ч |
|
Интактные клетки |
0 |
5 |
|
Клетки, высушенные при
28°С |
40–45 |
3–4 |
|
«Ацетоновый порошок» |
20–25 |
4,5–5 |
Примечание. Состав реакционной смеси:
Из
табл. 1 видно, что способ обработки клеток пекарских дрожжей довольно существенно
влияет на выход ЦДФХ. Однако даже в случае использования сухих клеток выход продукта
не превышает 40–45%.
Далее
было исследовано влияние различных исходных субстратов (ЦМФ, ЦДФ, ЦТФ) и
доноров холина (холин-хлорид, фосфохолин-хлорид) на выход реакции синтеза ЦДФХ ферментами
сухих пекарских дрожжей (табл. 2).
Таблица 2
Влияние различных нуклеотидных и
холинсодержащих субстратов
на выход ЦДФХ
|
Исходный
субстрат* |
Выход
ЦДФХ, % |
Исходный субстрат** |
Выход
ЦДФХ, % |
|
ЦМФ |
42–43 |
Фосфохолин-хлорид |
44–46 |
|
ЦДФ |
41–44 |
Холин-хлорид |
10–15 |
|
ЦТФ |
44–45 |
Холин-хлорид + АТФ |
60–65 |
Примечания: * – реакционная смесь содержала
Из
табл. 2 видно, что присутствие в реакционной среде ЦМФ, ЦДФ или ЦТФ практически
не влияет на выход реакции синтеза ЦДФХ, поскольку в условия гликолитического
расщепления глюкозы ферменты дрожжей способны быстро трансформировать ЦМФ и ЦДФ
в необходимый ЦТФ. Однако следует отметить, что с экономической точки зрения
целесообразно использовать именно ЦМФ как наиболее дешевый субстрат из
исследованных нуклеотидов.
Из
табл. 2 также видно, что в случае присутствия в среде фосфохолин-хлорида выход
целевого прдукта значительно выше, чем в присутствии холин-хлорида. Однако
дополнительное внесение в реакционную смесь АТФ приводит к повышению выхода ЦДФХ.
По-видимому, это связано с нехваткой внутриклеточного АТФ для действия
содержащегося в дрожжах АТФ-зависимого фермента – холинкиназы. Отметим также,
что холин-хлорид является намного более дешевым субстратом, чем фосфохолин-хлорид.
В
ходе дальнейшей оптимизации условий синтеза ЦДФХ нами было изучено влияние
концентрации глюкозы в реакционной смеси на выход целевого продукта (рис. 1). В
результате данных исследований нам удалось добиться повышения выхода целевого
продукта до 80–85%.
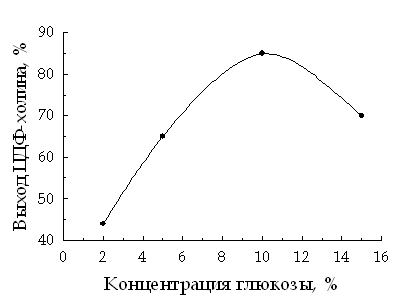
Рис. 1. Влияние концентрации глюкозы
на выход ЦДФХ
Состав
реакционной среды:
Таким
образом, в результате оптимизации условий синтеза ЦДФХ выход целевого продукта
увеличился с 40–45% до 80–85%. Разработанный метод предусматривает использование
в качестве биокатализатора сухих пекарских дрожжей, ферментные системы которых
способны в результате нескольких последовательных реакций трансформировать
смесь ЦМФ и холина в ЦДФХ.
Следует
отметить, что ранее были описаны методы получения ЦДФХ с использованием сухих
пекарских дрожжей [11, 12], однако трансформация исходных веществ (оротовая
кислота, ЦМФ) в ЦДФХ в указанных работах не превышала 40–60%.
Таким
образом, предложенный нами ферментативный метод синтеза ЦДФХ не уступает лучшим
методам, описанным в литературе, и открывает перспективу создания технологии
получения субстанции для лекарственных препаратов на основе этого метаболита.
Литература:
1.
Secades J.J. Frontera G. / Methods Find. Exp. Clin. Pharmacol. – 1995. – Vol. 17, Suppl. B.
– P. 1–54.
2.
Spiers P.A. et al. / Arch.
Neurol. – 1996. – Vol. 53, № 5. – P. 441–448.
3.
Dávalos A. et al. / Stroke. – 2002. – Vol. 33, № 12. – P. 2850–2857.
4.
Conant R., Schauss A. / Altern. Med.
Rev.– 2004. – Vol. 9, № 1.– P. 17–31.
5.
Sudo K. et al. / Lancet. – 2004. – Vol. 363, № 9418. –
P. 1364.
6.
Grieb P., Redjak R. / J. Neurosci.
Res. – 2002. – Vol. 67, № 2. – P. 143–148.
7.
Kent C. / Biochim. Biophys. Acta. –
1997. – Vol. 1348, № 1–2. – P. 79–90.
8.
Titovich O.I. et al. // Biocatalytic
Technology and Nanotechnology / Ed. G.E. Zaikov. –
9.
Zinchenko A.I. et al. / FEBS Lett. –
1990. – Vol. 260, № 2. – P. 254–256.
10. Friesen
J.A. et al. / Protein Expr. Purif. – 2001. – Vol. 21, № 1. – P. 141–148.
11. Пат. 6387667 США / A.
Maruyama, T. Fujio, S. Teshiba (Jp.); заявитель Kyowa Hakko Kogyo, Co., Ltd., Tokyo
(JP) – № 08/014012; заявл.
28.01.1993; опубл.
14.05.2002.
12. Kimura
A. et al. / J. Bacteriol. – 1976. – Vol. 125, № 2. – P. 744–746.