К.б.н. Квач
С.В., к.б.н. Ерошевская Л.А., д.б.н. Зинченко А.И.
Институт микробиологии НАН Беларуси, Минск
генно-инженерное конструирование штамма-продуцента бактериальной
аденозиндезаминазы
Микроорганизмы служат ценнейшим
источником ферментов для промышленных, медицинских и исследовательских целей.
Одним из ферментов, играющих важную роль в метаболизме пуриновых нуклеозидов
является аденозиндезаминаза (ЕС 3.5.4.4). Этот
фермент осуществляет необратимую реакцию превращения аденозина
в инозин путем отщепления аминогруппы от гетероциклического основания
нуклеозида. Помимо своего основного субстрата – аденозина,
аденозиндезаминаза Escherichia coli может использовать ряд других нуклеозидов
– 2′-дезоксиаденозин, 3′-дезоксиаденозин, 2′,3′-дидезоксиаденозин,
2-амино-6-метилпуринрибозид, 2,6-диаминопуринрибозид, аденинарабинозид
[1,2]. Способность фермента осуществлять дезаминирование
модифицированных пуриновых нуклеозидов делает его привлекательным для использования
в химико-ферментативных схемах получения различных субстанций с потенциальной
фармакологической активностью.
Целью настоящего
исследования явилось создание штамма-суперпродуцента
аденозиндезаминазы E. coli.
Объекты и методы исследования. Объектом исследований служил коллекционный штамм E. coli
БМТ-4Д/1а – донор гена, кодирующего аденозиндезаминазу,
штамм E. coli
BL21(DE3), использующийся в качестве акцептора рекомбинантного
вектора, несущего ген денозиндезаминазы, и штамм E. coli
DH5α, служащий промежуточным хозяином для наработки и анализа рекомбинантного вектора.
Культивирование всех штаммов
проводилось при 37oС на стандартной среде LB (рН
7,2), содержащей: 10 г/л триптона, 10 г/л NaCl и 5 г/л дрожжевого экстракта. Штаммы, содержащие плазмиды и векторы на их основе, культивировались на среде с
канамицином в концентрации 50 мкг/мл.
Клетки E. coli BL21(DE3), несущие плазмиду с геном аденозиндезаминазы,
выращивали на LB-среде до оптической плотности 0,6 (λ
= 600 нм), затем проводили индукцию синтеза белка путем внесения IPTG до
концентрации
Выделение геномной
ДНК проводили фенол-хлороформенным методом с дополнительной
очисткой при помощи цетавлона [3].
Подбор праймеров
для ПЦР проводили, используя данные о первичной структуре гена аденозиндезаминазы. На 5′-концах праймеров
были встроены сайты рестрикции NdeI и BamHI, дополненные 6-тью и 2-мя произвольными нуклеотидами.
Реакцию ПЦР проводили в буфере, содержащем
Электрофорез белков в
полиакриламидном геле, содержащем додецилсульфат
натрия (ДСН), проводили по методу Лэммли [4].
Белковые препараты солюбилизировали добавлением
буфера (в соотношении 1:1) следующего состава:
Активность аденозиндезаминазы
определяли по скорости дезаминирования аденозина. Реакционную смесь, содержащую
Результаты и их обсуждение. Ген add, кодирующий аденозиндезаминазу E. сoli, был изолирован из геномной
ДНК с использованием ПЦР и встроен в плазмиду pET24b+ (Novagen, США) под контролем Т7-промотора (сильного промотора 10-го гена капсида фага Т7). Полученной плазмидой
трансформировали клетки E. coli BL21(DE3),
предназначенные для экспрессии белка, находящегося под контролем T7-промотора. Полученный штамм был назван E. coli:pADD3. На первом этапе провели выращивание штамма
E. coli:pADD3 и индукцию синтеза аденозиндезаминазы согласно рекомендациям фирмы-производителя.
Клетки выращивали до оптической плотности 0,6, затем в среду вносили индуктор и
продолжали культивирование в течение 3-х ч. Для визуального контроля синтеза
целевого белка проводили ДСН-полиакриламидный
электрофорез белков, результаты которого представлены на рис. 1.
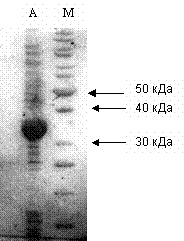
Рис. 1 – Электрофореграмма белков клеток E. coli:pADD3 при индукции экспрессии при помощи IPTG.
А – клетки,
индуцированные IPTG в течение 3 ч; М – маркерные белки.
Из электрофореграммы
видно, что через 3 ч индукции нарабатывается белок, составляющий большую часть
общего растворимого клеточного белка.
На следующем этапе работы
была изучена динамика накопления фермента от длительности индукции. Результаты
представлены на рис. 2.
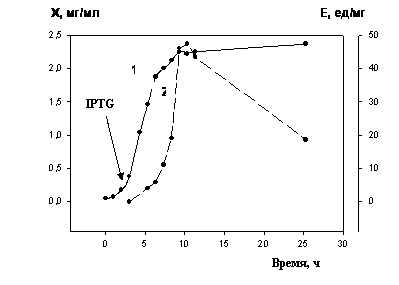
Рис. 2 − Динамика накопления в
среде биомассы (1;Х) и аденозиндезаминазы (2;Е) при
индукции экспрессии белка в штамме E. coli:pADD3
Изучение характера роста клеток E. coli:pADD3 и биосинтеза ими аденозиндезаминазы при индукции
Заключение. Проведена
амплификация гена аденозиндезаминазы из геномной ДНК E. coli. Выделенный
ген клонирован в плазмиду pET24b+. Получен новый генно-инженерный штамм E. coli:pADD3 – суперпродуцент аденозиндезаминазы.
Продуцируемая штаммом E. coli:pADD3 аденозиндезаминаза представлена активным водорастворимым белком.
Изучена
динамика накопления фермента при индукции экспрессии с помощью
Работа выполнена в рамках ГППИ «Новые биотехнологии».
Литература:
1. Nygaard,
P. Adenosine deaminase from Escherichia coli / P. Nygaard // Methods Enzymol. – 1978. – Vol. 51. – P.
508–512.
2. Okuyama, K. Enzymatic synthesis of 2′-deoxyguanosine
with nucleoside deoxyribosyltransferase-II / K. Okuyama, S. Shibuya, T. Hamamoto,
T. Noguchi // Biosci. Biotechnol. Biochem.
– 2003. – Vol. 67, № 5. – P. 989–995.
3. Sambrook,
J. Molecular cloning: a laboratory manual
/ J. Sambrook, E. Frittsch,
T. Maniatis. – 2-nd ed.– New York: Cold
Spring Harbor Laboratory Press, 1989. – 2222 p.
4. Laemmli,
U.K. Cleavage of structural proteins during the assembly
of the head
of bacteriophage T4 / U.K. Laemmli // Nature. – 1970. – Vol. 227, № 259. – P. 680–685.