Бурко Д.В., к.б.н. Квач С.В., д.б.н. Зинченко
А.И.
Институт микробиологии НАН Беларуси,
г. Минск
Создание
генно-инженерного штамма-суперпродуцента пирофосфатазы
Фермент
пирофосфатаза катализирует реакцию гидролиза пирофосфата до двух молекул
ортофосфата, что представляет собой очень важный процесс в организме живых организмов,
так как пирофосфат является побочным продуктом многих биохимических реакций,
таких как, например, биосинтез РНК, ДНК, олигосахаридов, а также образуется в
процессе присоединения аминокислот к соответствующим тРНК. При этом гидролиз пирофосфата не только влияет на выход целевых
продуктов, но даже может определять направление протекания биохимических реакций
[1].
В
настоящей работе пирофосфатаза использовалась в качестве дополнительного
фермента в реакции синтеза фармакологически важного диаденозин-5′,5′′′-Р1,Р4-тетрафосфата (Ар4А) с помощью
генно-инженерной лизил-тРНК-синтетазы (LysU) [2]. Данная реакция является
обратимой, и сдвиг равновесия в сторону образования конечного продукта зависит
от наличия в реакционной среде пирофосфата, поэтому важным является его
расщепление до ортофосфата с помощью пирофосфатазы, дополнительно вводимой в
реакционную смесь.
Целью
настоящего исследования было создание генно-инженерного штамма-суперпродуцента
пирофосфатазы и изучение возможности применения этого фермента в реакции синтеза
Ар4А.
Материалы и методы исследования. В работе использовали бактерии Escherichia coli BL21(DE3) и E. coli DH5α из коллекции лаборатории молекулярной генетики Института генетики и
цитологии НАН Беларуси.
Ген ppa, кодирующий пирофосфатазу, был выделен методом ПЦР с
использованием в качестве матрицы геномной ДНК штамма E. coli DH5α. Для амплификации гена ppa использовали
следующую пару праймеров: «прямой» – (5¢-ATATTACATATGAGCTTACTCAACGTCCCTGCGGGTAAAG-3¢) и «обратный» – (5¢-CAGGTCGACTTATTTATTCTTTGCGCGCTCGAAGGA-GGC-3¢). В 5¢-окончания прямого праймера был встроен сайт рестрикции эндонуклеазы NdeI, а в праймер обратный – сайт узнавания рестриктазы SalI (выделены жирным шрифтом). Для
проведения реакции амплификации использовали 1,25 ед. активности Go-Taq-полимеразы (Promega, США). Полученный в результате ПЦР
продукт выделяли из геля с помощью набора реактивов «Wizard SV gel and PCR clean-up system» (Promega, США) согласно методике фирмы-изготовителя, обрабатывали смесью рестриктаз NdeI и SalI и полученную вставку с геном ppa лигировали в вектор pET24b+, содержащий T7-промотор (Novagen, США). В результате была получена
плазмида pETppa8, несущая ген ppa. Сконструированным вектором были
трансформированы клетки E. coli BL21(DE3) с получением нового штамма,
обозначенного E. coli ppa8.
Клетки E. coli ppa8 выращивали на LB-среде, содержащей 50 мкг/мл канамицина, до оптической
плотности 0,6 (λ = 600 нм); затем проводили индукцию синтеза белка путем
внесения изопропил-β-D-тиогалактопиранозида (IPTG) до концентрации
Полученный в результате
центрифугирования осадок клеток растворяли
в
Ферментативную активность
пирофосфатазы анализировали по скорости реакции превращения пирофосфата в
ортофосфат. Стандартная реакционная смесь (300 мкл) содержала
Средние значения и
доверительные интервалы определяемых параметров рассчитывали с применением t-критерия Стьюдента.
Полученную пирофосфатазу
использовали в реакции синтеза Ар4А. Стандартная реакционная смесь
(1 мл) содержала
Белок определяли по
модифицированному методу Лоури [4].
Результаты и их обсуждение
Клонирование гена рра
и экспрессия генно-инженерного белка. Для получения пирофосфатазы ген, кодирующий данный белок, был
клонирован под контролем промотора гена 10 бактериофага Т7 в плазмиде рЕТ24b+ по сайтам рестрикции NdeI и SalI с применением стандартных генно-инженерных
методов. Полученная плазмида была названа рЕТрра8. Данной плазмидой
трансформировали клетки E. coli BL21(DE3). Экспрессию гена индуцировали IPTG в концентрации
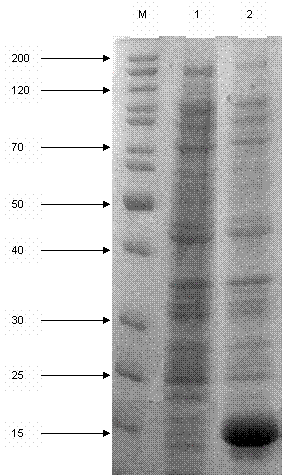
Рис 1. Электрофоретический анализ
лизата клеток E. coli рра8 при индукции синтеза пирофосфатазы
М – положение
и молекулярные массы (кДа) стандартных белков; 1 – белковый состав
неиндуцированных клеток; 2 – белковый состав клеток, индуцированных IPTG
Очистка пирофосфатазы. Пирофосфатаза является одним из наиболее
термостабильных ферментов [5]. Так как при нагревании до 80оС большинство
белков E. coli денатурируют и выпадают в осадок, в
то время как пирофосфатаза сохраняет свою активность, эту процедуру можно
использовать в качестве одного из этапов очистки этого фермента.
Для определения
термостабильности пирофосфатазы проводили следующий эксперимент. Две пробы с
лизатом, полученным после дезинтегрирования клеток E. coli ppa8, прогревали в течение 20 мин при 80оС. В одну из проб
вносили ионы магния до конечной концентрации
Таблица 1
Влияние ионов магния на термоинактивацию пирофосфатазы при 80оС
|
Длительность прогрева, мин |
Концентрация белка, мг/мл |
Активность пирофосфатазы, ед/мг белка |
Общая активность, ед/мл белка |
|
Нагревание лизата E. coli ppa8 в отсутствии ионов магния |
|||
|
0 |
1,420 |
1699±314 |
2412±343 |
|
5 |
1,410 |
903±35 |
1274±49 |
|
10 |
1,400 |
768±36 |
1075±49 |
|
15 |
1,410 |
549±36 |
773±49 |
|
Нагревание лизата E. coli ppa8 в присутствии |
|||
|
0 |
1,420 |
1699±314 |
2412±343 |
|
5 |
0,900 |
2181±81 |
1963±74 |
|
10 |
0,825 |
2288±30 |
1888±26 |
|
15 |
0,825 |
1485±60 |
1225±49 |
|
20 |
0,900 |
1278±219 |
1150±198 |
На следующем этапе работы
частично очищенная пирофосфатаза была использована в реакции синтеза Ар4А.
При внесении в стандартную реакционную смесь 0,5 ед полученного фермента выход
целевого продукта достигал 95%. Такой же результат получен при использовании
0,5 ед коммерческой пирофосфатазы (Serva, Германия). В отсутствии этого
дополнительного фермента Ар4А не образовывался. Таким образом, генно-инженерная
пирофосфатаза способна влиять на равновесие реакции синтеза Ар4А в
сторону образования продукта за счет побочной реакции гидролиза пирофосфата.
Заключение. Таким образом, нами сконструирован бактериальный
штамм-суперпродуцент пирофосфатазы и продемонстрирована возможность применения ее
в качестве дополнительного фермента в реакции синтеза Ар4А для
сдвига равновесия этой реакции в сторону образования целевого продукта.
Литература:
1. Ramos A. /
FEMS Microbiol. Lett. – 2003. – Vol. 225, № 1. – Р. 85–92.
2.
Квач
С.В., Бурко Д.В. / Весцi НАН Беларусi. Сер. бiял. навук. – 2006. – № 5, Ч. 1. – С. 82–84.
3. Rumsfeld J. /
Protein Expr. Purif. – 2000. –Vol. 18, № 3. – Р. 303–309.
4. Pеterson G.L. / Anal. Biochem. – 1997. – Vol. 83, № 2. –
Р.
436–356.
5.
Josse J. / J. Biol. Chem. – 1966. – Vol. 241, № 9. – P.
1938–1947.