Великанова И.А.
Белорусский государственный технологический
университет, Беларусь
Электродные
материалы на основе оксидов иридия
В
настоящей работе исследовалось влияние способа обработки подложки, ее
пористости и состава активного покрытия на электрохимические свойства электродов на основе оксидов иридия (содержание иридия
3 г/м2). Оксидные электроды получены путем термического разложения гексахлориридиевой
кислоты [1, 2], тетрахлорида титана, нитратов
кобальта, никеля, марганца. В качестве подложки использован листовой титан марки ВТ 1-0, толщиной
Установлено, что форма потенциодинамической кривой для оксидного Ir/Ti-электрода, сформированного на опескоструенном
титане с последующим химическим травлением (в смеси серной (10% масс.) и плавиковой
(2 масс. %) кислот в присутствии перекиси водорода (4 масс. %)) в течение 2 мин
(рис. 1, кривая 2), сходна с потенциодинамической
кривой для оксидного Ir/Ti-электрода, химически протравленного
в течение 2 мин (рис. 1, кривая 1). Однако на электроде, сформированном на опескоструенном титане, наблюдается увеличение поляризации
электрода в реакции выделения водорода и кислорода на 70 мВ и 150 мВ
соответственно, к тому же наблюдается уменьшение пика десорбции водорода в 2–3
раза. Так как пескоструйная обработка проводилась корундом зернистостью 25–32,
то увеличение поляризации электродов связано с внедрением в поверхность
титановой основы кусочков Al2O3, обладающих диэлектрическими свойствами и снижающих электропроводность
оксидного покрытия.
На потенциодинамической
кривой оксидного Ir/Ti-электрода, сформированного на
титановой основе химически протравленной в течение 20 мин, пик, отвечающий
переходу Ir (III) в Ir (IV), четко выражен и смещен в анодную область
на 11 мВ (рис. 1, кривая 3). При потенциале 0,74 В появляется пик, который,
вероятно, соответствует образованию кислородного соединения IrOH. Увеличение плотностей тока, соответствующих максимумам
десорбции водорода, кислорода и перехода Ir (III) в Ir (IV) обусловлено, вероятнее всего,
увеличением истинной площади поверхности электрода и вовлечением большего количества
электрокатализатора в электродные процессы.
.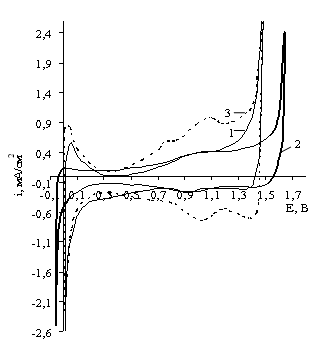
1 –химическое травление титановой основы 2 мин, 2–
пескоструйная обработка титановой основы и химическое травление 2 мин, 3 –
химическое травление титановой основы 20 мин
Рисунок 1. Циклические потенциодинамические
кривые оксидного Ir/Ti-электрода в
Установлено, что при
изготовлении электродов на подложке из пористого титана присутствие оксидов
иридия в пористой титановой матрице увеличивает скорость выделения кислорода и
водорода, а также снижает поляризацию электрода в этих процессах. Однако увеличение
содержания иридия мало влияет на электрохимическое поведение оксидного Ir/Ti пористого электрода. При увеличении содержания иридия в 3
раза происходит незначительное уменьшение поляризации электрода в анодном и
катодном процессах. Это можно объяснить тем, что при изготовлении электрода гексахлориридиевая кислота проникает преимущественно в
глубь пор титановой основы, а электрохимические процессы происходят
преимущественно на внешней поверхности оксидного Ir/Ti пористого электрода.
С целью снижения расхода
благородного металла в активное покрытие вводили оксиды титана, кобальта,
никеля и марганца. Данные электродные материалы исследовались в процессах
получения гипохлорита натрия и электрохимического разложения щавелевой кислоты.
В процессе получения гипохлорита натрия среди исследуемых электродных
материалов следует выделить оксидный Ir-Co-Ti/Ti-электрод, который обладает высокой
стабильностью и селективностью (средний выход по току составляет 84–86%). Наибольшей
селективностью в процессе разложения щавелевой кислоты обладают оксидные Ir-Ti/Ti и Ir-Co-Ti/Ti электроды, выходы по току разложения
щавелевой на которых практически не зависят от анодной плотности тока в
интервале 0,02–0,1 А/см2 и составляют 93–95%.
Таким
образом, в качестве предварительной подготовки поверхности титановой основы целесообразно
применять химическое травление в течение 20 мин, при этом пескоструйную
обработку с использованием корунда применять нежелательно. Применение пористого
титана в качестве основы электрода не целесообразно, т.к. большая часть иридийсодержащего раствора проникает вглубь титановой
матрицы. Среди электродных материалов, содержащих оксиды иридия, титана,
кобальта, никеля, марганца, следует выделить оксидный Ir-Co-Ti/Ti электрод, который обладает наибольшей стабильностью и
селективностью в процессах получения гипохлорита натрия и разложения щавелевой
кислоты.
Литература
1. Великанова И.А., Дроздович В.Б., Жарский И.М.,
Иванова Н.П. Синтез и исследование электрохимических свойств иридиево-титановых электродов // Труды БГТУ. Сер. Химия
и технология неорган. в-в.–2005.–Вып. XIII. C. 31–32.
2. Великанова И. А., Иванова Н. П., Дроздович В. Б., Жарский И. М.
Электрохимическое поведение иридиево-титановых
электродов в реакциях выделения кислорода и хлора // Труды БГТУ. Сер.
Химия и технология неорган. в-в.
– 2006. – Вып. XIV. – С. 62–64.