А.К. Болвако, А.А.
Черник, А.А. Поздеева, И.М. Жарский
Белорусский государственный
технологический университет, г. Минск
Влияние анодного допирования на свойства электродных
материалов на основе диоксида свинца
Химическая и
нефтехимическая отрасли промышленного производства являются лидерами
образования концентрированных отходов
I–II классов опасности.
К этой группе
относятся производства, связанные с выпуском и переработкой пестицидов,
фармацевтических препаратов, красителей, растворителей и т.д. Актуальность
разработки метода обезвреживания подобных
отходов подтверждается отсутствием
универсального экологически безопасного метода обезвреживания смесей неизвестного состава органической
природы. В ряде случаев наиболее оптимальным для применения в локальных
системах водоочистного хозяйства является способ обезвреживания токсичных
органических соединений, осуществляемый за счет их глубокой
окислительной деструкции в жидкой фазе в
активном растворителе (при этом окислитель не
добавляется извне, а генерируется электрохимически),
Достоинством такого
метода является совмещение в реакционном
объеме нескольких процессов — синтеза окислителей, окисления органического вещества в растворе и
на аноде, а также его деструкция за
счет восстановления на
катоде некоторых групп. Эффективность такого
совмещенного процесса значительно
выше, чем при
электрохимическом или химическом окислении [1].
В [2] показано, что
добавки хлоридов оказывают положительное влияние на глубину анодной деструкции
ацетона в кислой среде и его отсутствие в щелочной. Изучено влияние ацетона на
гетерогенно-каталитический распад пероксида водорода
и установлено, что имеет место отравление платины ацетоном по механизму
блокировки. На основании адсорбционных и каталитических свойств показана
возможность замены анодов из платинированной платины на аноды из диоксида
свинца в реакциях анодного окисления ацетона как биологически жесткого
компонента сточных вод.
Таким образом, разработка
методов направленного синтеза новых материалов с заданными свойствами является
одним из приоритетных направлений современной науки. При этом все большее
внимание уделяется различным электрохимическим методам, позволяющим управлять
составом и свойствами получаемых материалов путем изменения режимов электролиза
и состава электролитов [3].
В настоящее время все
более широкое применение находят такие окислители, как перекисные соединения
щелочных металлов и озон. Значительные количества пероксосоединенений
востребованы при отбеливании и окраске тканей, при производстве моющих средств,
в органическом синтезе, для дезинфекции и обеззараживания.
Целью данной работы
является исследование электрохимических свойств анодных электродных материалов
на основе диоксида свинца, допированных анионами Cl–, а также мелкодисперсными частицами нитрида циркония
и диоксида свинца. Изучение электрохимической
активности электродных материалов проводилось в
Все электрохимические
измерения проводились в стандартной электрохимической ячейке ЯЭС-1 с
использованием потенциостата ПИ 50-1.1 в комплекте с
программатором ПР-8. Электрод сравнения – хлорсеребряный. Температура
поддерживалась термостатом UTU-7 с точностью ±0,2оС.
Анализ поляризационных
кривых в растворе H2SO4 (рис. 1) показал, что активный анодный процесс в
При потенциалах
положительнее 2 В на поляризационных кривых
наблюдается перегиб, возможно, связанный с изменением механизма анодного
процесса, а также с вторичным процессом образования озона по реакции:
О2
+ Н2О – 2е → О3 + 2Н+ Ео
= 2,07 В.
Поведение электродов в растворе № 1
значительно отличается от их поведения в H2SO4. Существенный
анодный процесс наблюдается на всех электродах при потенциале положительнее 0,8 В, что связано, по всей видимости, с процессом образования
кислорода. В области потенциалов 1–1,5 В на всех
поляризационных кривых наблюдается перегиб, возможно связанный с изменением
механизма анодного процесса и образование соединений пероксидного
типа. Наибольшую активность проявили электродные материалы без допирования,
наименьшую – электроды, допированные ZrN.
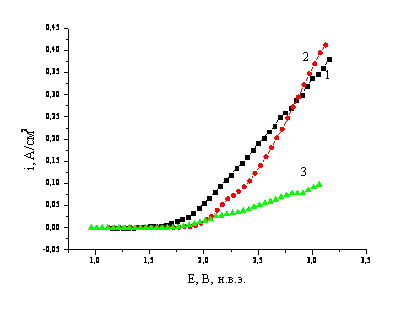
Рис. 1. Поляризационные кривые в
растворе
Исследование анодного
процесса в электролите № 2 показало сходные результаты с электролитом № 1 (рис.
2, 3). Однако, активность электродных материалов в
последнем случае отличается более существенно. Показано, что электроды без
допирования обладают большей электрохимической активностью.
Снижение каталитической
активности допированных электродных материалов может быть обусловлено
следующими причинами. В процессе допирования происходит изменение структуры
поверхности PbO2 и, следовательно, стехиометрического соотношения Pb:O. В свою очередь меньшее соотношение Pb:O приводит к увеличению перенапряжения выделения
кислорода и способствует образованию
высших кислородных соединений [4].
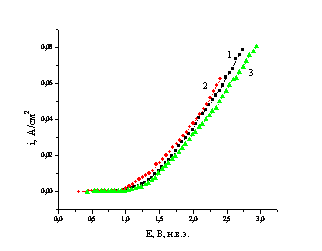
Рис. 2. Поляризационные кривые
различных электродов в растворе для синтеза пероксобората. 1 – PbO2, допированный частицами PbO2;
2 – PbO2; 3 – PbO2, допированный частицами ZrN
Поэтому авторы
предполагают, что применение данных материалов может положительно сказаться на
процессе электросинтеза пероксобората и пероксокарбоната.
Таким образом,
использование допированных электродных материалов позволяет в ряде случаев
отказаться от использования драгоценных металлов, сохранив при этом высокую
каталитическую активность и химическую стойкость.
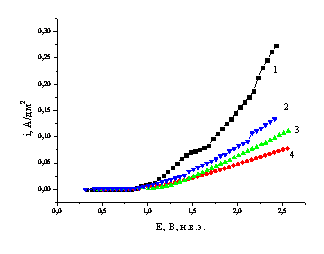
Рис. 3.
Поляризационные кривые различных электродов в растворе для синтеза пероксокарбоната
1 – PbO2;
2 – PbO2, допированный Cl–;
3 – PbO2
с частицами PbO2;
4 – PbO2,
допированный частицами ZnN
Литература
1. Волгина Т.Н., Кукурина
О.С., Новиков В.Т. // Химия в интересах устойчивого развития. 13. 2005. С.
41-44.
2. Электролитические свойства платины и
диоксида свинца в реакции анодной деструкции ацетона / Т.М. Гришина, Ю.А.
Боровский // Вестник Московского университета. Химия. – 1998. – т. 39. – № 2.
3. Электрохимический синтез и
физико-химические свойства композиционных оксидных материалов / Величенко А.Б., Амаделли Р., Девильи Д. // Вісник Харківського
національного університету.
– 2005. – № 648. – Вып.12 (35).
4. Черник А.А., Жарский И.М,, Дрозодвич В.Б. // Электрохимия.
1997. – т. 33. – с. 284.