Биологические
науки/7. Зоология/9. Биохимия и биофизика
К.б.н. Соколянская М. П.
Институт биохимии и генетики УНЦ РАН, Россия
РОЛЬ ДЕТОКСИЦИРУЮЩИХ ФЕРМЕНТОВ В ФОРМИРОВАНИИ УСТОЙЧИВОСТИ ЛИЧИНОК
КОМНАТНОЙ МУХИ К ДЕЛЬТАМЕТРИНУ
Одним из основных механизмов устойчивости
к инсектицидам является биохимический, который связан с увеличением активности
детоксицируюших ферментов. К этой группе ферментов относятся монооксигеназы,
неспецифические эстеразы и глутатион-S-трансферазы.
Основную роль в деградации пиретроидов играют монооксигеназы, но и остальные
ферменты также принимают участие в инактивации этого класса инсектицидов. Ранее
нами было показано, что у имаго комнатной мухи неспецифические эстеразы активизируются
на начальных этапах селекции дельтаметрином, а трансферазы – гораздо позднее
[1]. В данной работе изучалась роль этих двух ферментов при селекции тем же
инсектицидом личинок комнатной мухи.
Водные растворы дельтаметрина (ФАС, 1%
ВРТ) добавляли личинкам III возраста в
корм – пшеничные отруби. Стаканчики содержали при 25°С, учет проводили после
вылета имаго. В каждом 6-м поколении проверяли изменение чувствительности
насекомого к препарату и активности детоксицирующих ферментов. В биохимических
исследованиях использовали гомогенаты целых личинок комнатной мухи. Активность
неспецифических эстераз определяли по скорости гидролиза α-нафтилацетата [2].
Активность глутатион-S-трансфераз (ГSТ) определяли по методу Хабига [3]. Концентрацию белка
определяли по Лоури [4].
Уже в 6-м поколении устойчивость к дельтаметрину
у личинок достигла значительной величины
(ПР=11) и в процессе селекции неуклонно возрастала (ПР=58 в 30-м
поколении). Активность неспецифических эстераз у личинок селектированной линии
возросла почти в 2 раза также к 6-му поколению (рис. 1) и в процессе селекции
имела тенденцию к увеличению, что говорит о безусловной роли этих ферментов в
формировании резистентности. Активность глутатион-S-трансфераз также повысилась, но, тем не менее,
активность этих ферментов была ниже, чем активность эстераз. В целом, изменение
активности детоксицирующих ферментов у личинок при селекции происходило так же,
как и у имаго.
Неспецифические эстеразы Глутатион-S-трансферазы
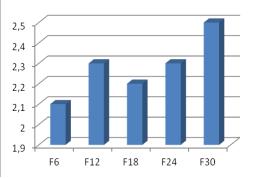
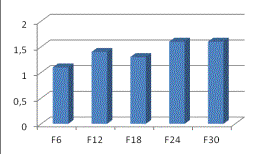
Рис. 1. Изменение активности детоксицирующих ферментов личинок комнатной мухи в процессе селекции
дельтаметрином (нормировано по
чувствительной линии).
Полученные нами данные согласуются с
данными других исследователей. С помощью синергистов эстераз было установлено,
что эти ферменты вносят вклад в устойчивость к пиретроидам у совок Trichoplusia ni и Spodoptera littoralis, табачной белокрылки Bemisia tabaci, булавоусого хрущака Tribolium castaneum и
комнатной мухи Musca domestica [5].
Положительная корреляция между повышенной активностью эстераз и глутатион-S-трансфераз и резистентностью к дельтаметрину
подтверждает, что эти ферменты включены в адаптивный ответ яблонной плодожорки Cydia pomonella к пиретроидным обработкам в теплицах Нидерландов [6]. В
формировании устойчивости к пиретроидам комаров Aedes aegypti в одной из провинций Таиланда также играют
роль оба фермента [7].
Таким
образом, как и у имаго, неспецифические эстеразы включаются в формирование
устойчивости личинок комнатной мухи к дельтаметрину уже на начальных этапах
селекции, а глутатион-S-трансферазы –
на более поздних этапах.
Литература
1. Соколянская М.П. Токсикологическая и
биохимическая характеристика процесса формирования резистентности у комнатной
мухи (Мusca domestica L.) к современным инсектицидам // Дис. … канд. биол.
наук. С-Пб.: ВИЗР. 2007. 142 с.
2. Van
Asperen K. A study of housefly esterases by means of a sensetive calorimetric
method // J. Insect. Physiol. 1962. V. 8. P. 401-416.
3.
Habig W.H., Pabst H.J., Jacoby W.B. Glutathione-S-transferases. The first
engymatic step in mercapturic acid formation // J. Biol. Chem. 1974. V.249. №
22. P. 7130-7139.
4. Lowry O.H.,
Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the
Falin-phenol reagent // J. Biol. Chem.
1951. V. 193. P. 265.
5.Ishaaya I.
Insect detoxifying enzymes: Their importance in pesticide synergism and
resistance // Insect Biochemistry and
Physiology. 1993. V. 22. №
1-2. P.263–276.
7. Bouvier J.C., Boivin T., Beslay
D., Sauphanor B. Age-dependent
response to insecticides and enzymatic variation in susceptible and resistant
codling moth larvae // Insect Biochem. Physiol. 2002. V. 51. № 2. P. 55-66.
8. Paeporn P., Supaphathom K., Srisawat R.,
Komalamisra N., Deesin V., Ya-umphan P. Biochemical detection of pyrethroid
resistance mechanism in Aedes aegypti in Ratchaburi province, Thailand // Trop Biomed. 2004. V. 21. P. 145-151.