УДК 615.477; 615.465
д.т.н., проф. Родионов И.В.
Саратовский
государственный технический университет имени Гагарина Ю.А., Россия
Термомодифицирование поверхности имплантационных ортопедических конструкций в атмосфере водяного пара для получения биосовместимых оксидных покрытий с остеоинтеграционными качествами
Статья подготовлена при
финансовой поддержке гранта РФФИ «а» №
13-03-00248
Аннотация
Исследована возможность модификации поверхности чрескостных титановых и стальных имплантатов способом паротермического оксидирования. Получены металлооксидные покрытия с комплексом функциональных свойств и структурных особенностей, обеспечивающих биосовместимость и остеоинтеграционную способность поверхности имплантатов. Проведены испытания in vivo оксидированных имплантатов, установлено влияние характеристик покрытий на приживляемость изделий в костной ткани. Разработан технологический маршрут создания паротермических оксидных покрытий с качествами биосовместимости на чрескостных имплантатах для травматологии и ортопедии.
Ключевые слова:
стальные и титановые ортопедические имплантаты, термическое модифицирование
(оксидирование) в атмосфере пара, металлооксидные покрытия, свойства, структура
поверхности, биосовместимость, остеоинтеграционная способность.
Введение
Метод внешнего чрескостного остеосинтеза применяется в лечении переломов
различных костей опорно-двигательного аппарата и предусматривает использование
винтовых стержней – имплантатов, вкручиваемых одними концами в костные отломки,
а другими концами закрепляемых во внешних опорах аппарата фиксации для
необходимой репозиции отломков. Имплантаты выполняются из металлических
материалов, обладающих определенной коррозионной стойкостью. В качестве таких
материалов наиболее часто используются титановые сплавы ВТ6, ВТ16 и нержавеющая
сталь 12Х18Н9Т, которые благодаря своим физико-химическим и механическим
свойствам позволяют обеспечить функционирование имплантатов без протекания
существенных воспалительный реакций тканей.
Для улучшенной приживляемости чрескостных имплантатов и их интеграционного
взаимодействия с окружающей костью на металлических поверхностях имплантируемых
конструкций создают биосовместимое покрытие с остеоинтеграционной способностью,
т.е. способностью срастания с костной тканью. Материалами такого покрытия
выступают различные вещества, не оказывающие токсикологического действия и не
вызывающие иммунных процессов в окружающих тканях и жидких средах организма –
кальцийфосфатные соединения, углерод, оксиды биоинертных металлов и др. [1-4].
За счет придания покрытиям высокой степени шероховатости, определенной
пористости, развитой морфологии и структурной гетерогенности достигаются
условия интеграции с костной тканью, когда костные клетки прорастают в
имеющиеся открытые микропоры и неровности поверхности, создавая прочное
закрепление имплантатов в организме.
Перспективными материалами биосовместимых остеоинтеграционных покрытий являются
некоторые нетоксичные металлооксидные соединения, получаемые на поверхности
металлических имплантатов путем их модификации по методу паротермического оксидирования
[5]. Преимущество данного метода получения биосовместимого покрытия от других
применяемых методов состоит в технологической простоте реализации процесса, в отсутствии
необходимости использования дополнительных материалов для покрытия, в возможности
проведения групповой обработки имплантатов.
Поэтому целью настоящей работы являлось получение паротермически
модифицированных металлооксидных покрытий с качествами биосовместимости и
способностью интеграционного взаимодействия с костными структурами на титановых
и стальных имплантатах для чрескостного остеосинтеза.
Методика и техника экспериментальных исследований
Опытные имплантаты изготовлялись из титанового сплава ВТ6 и нержавеющей хромоникелевой стали 12Х18Н9Т в виде винтовых стержней для чрескостного остеосинтеза (рис. 1).

Винтовая поверхность стержней проходила несколько предварительных технологических операций подготовки – промывку в спирте, пескоструйную обработку корундовым абразивом, ультразвуковое обезжиривание в моющем растворе, промывку в дистиллированной воде и сушку. Это позволило обеспечить требуемую чистоту поверхности и придать ей определенную исходную микрошероховатость.
Создание металлооксидного покрытия осуществлялось методом паротермического
оксидирования имплантатов с использованием лабораторной электронагревательной
установки с парогенератором (рис. 2). Для получения покрытия на титановых
стержневых образцах применялась температура нагрева печи, равная 4500С,
и продолжительность обработки 2 ч. Для формирования покрытия на стальных
образцах задавалась температура, составляющая 5500С, при
продолжительности оксидирования 1,5 ч. Паровая реакционная среда подавалась в
камеру печи установки под давлением 1,2-1,3 атм, которое поддерживалось на протяжении
всей продолжительности оксидирования. Получение термооксидных покрытий
происходило в условиях взаимодействия поверхности стержневых образцов с реакционными
компонентами парогазовой среды, в результате чего формировались поверхностные
металлооксидные системы определенной толщины и структуры.
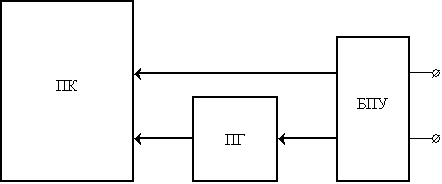
Рис. 2 Блок-схема лабораторной установки паротермического
оксидирования чрескостных имплантатов: ПК –
печь камерная, ПГ – парогенератор, БПУ – блок питания и управления
Термическое модифицирование поверхности имплантатов с
помощью оксидирования в атмосфере перегретого водяного пара позволяет придать
им повышенные механические показатели за счет формирования на поверхности
тонкого слоя собственных оксидов металлов, входящих в химический состав металлической
основы. Образующиеся на поверхности металлооксидные соединения в виде покрытия
отличаются от металла основы повышенными механическими, физическими и антикоррозионными
характеристиками, а также способностью длительное время сохранять свои
функциональные свойства без разрушения металлооксидной матрицы.
Исследование фазового состава и поверхностно-структурных характеристик
покрытий проводилось методами рентгенофазового анализа, микропроцессорной
профилометрии и оптико-компьютерной обработки размерных элементов
микроизображений поверхности.
Экспериментальная апробация титановых и стальных имплантатов с паротермическими металлооксидными покрытиями проводилась на лабораторных кроликах породы «нидерландская красная», которым в кости конечностей на 50 суток вкручивались опытные винтовые стержни. Контрольной группой образцов являлись стержни без покрытия. Основным биомеханическим критерием приживляемости образцов являлось наличие остеоинтеграции их поверхности и формирование на ней костного регенерата как показателя остеокондуктивных свойств применяемых покрытий.
Результаты экспериментальных исследований и их анализ
При исследовании характеристик термооксидированных поверхностей стальных и титановых образцов было установлено, что покрытия на стали 12Х18Н9Т, полученные паротермическим модифицированием, имеют, в основном, четырехфазную структуру, включающую интерметаллид FeNi, Fe, оксиды Ti2O3 и Fe2O3. Оксиды Cr и Ni присутствовали в покрытии в весьма малых, «следовых» количествах, что, вероятнее всего, связано с высокой жаростойкостью этих элементов, а также трудностью идентификации некоторых слабоинтенсивных дифракционных линий при рентгенофазовом анализе. Покрытия на титановом сплаве ВТ6, созданные паротермическим оксидированием, характеризовались фазовым составом, включающим, в основном, нестехиометрический диоксид TiO2 с наличием весьма малого содержания низших оксидов Ti2O3 и Ti3O5.
Полученные металлооксидные покрытия на имплантатах характеризовались
выраженным микрорельефом и поверхностно-морфологической гетерогенностью, что
является необходимым для прорастания костной ткани в структуру покрытия и
обеспечения прочной интеграционной взаимосвязи системы «покрытие-кость» (табл.,
рис. 3). Кроме того, поверхностно-микропористые оксидные покрытия могут
способствовать стимулированию репаративного остеогенеза и обладают высокими
остеокондуктивными свойствами. Наличие большого количества пор и структурных
микронесплошностей приводят к существенному возрастанию величины удельной
поверхности, что, в свою очередь, способствует адсорбции увеличенного
количества адгезивных белков, ускоряет миграционные клеточные механизмы и
транспортные биохимические системы, создавая оптимальные условия для
образования новой костной ткани [6-9].
Таблица
Поверхностно-структурные характеристики металлооксидных
покрытий стержневых чрескостных имплантатов
|
Материал имплантата |
Режим паротермического оксидирования |
Размер пор, мкм |
Размер частиц, мкм |
Суммарная открытая пористость, % |
Параметры шероховатости, мкм |
||
|
Ra |
Rmax |
Sm |
|||||
|
Титановый сплав ВТ6 |
t=4500C, τ =2 ч |
35 |
18 |
35 |
1,2 |
5,6 |
18 |
|
Сталь 12Х18Н9Т |
t=5500C, τ =1,5 ч |
28 |
17 |
30 |
1,1 |
5,4 |
12 |

Рис. 3. Микроструктура поверхности паротермических
металлооксидных покрытий: а – на титановом сплаве ВТ6; б – на
стали 12Х18Н9Т (х300)
Микропористая
структура покрытий позволяет костным клеткам проникать в имеющиеся свободные
пространства, не занятые микрочастицами оксидов, с дальнейшим разрастанием
кости в структуре поверхности. Данный механизм взаимодействия костной ткани с
покрытием характеризуется протеканием микроостеоинеграционных процессов, усиливающих
взаимосвязь поверхности имплантатов с окружающей тканью и существенно
повышающих прочность закрепления имплантируемых изделий в кости.
Исследования
in vivo неоксидированных и
оксидированных стержневых имплантатов показали, что титановые и стальные
образцы без оксидного покрытия (контрольная группа) не проявили
остеоинтеграционную способность поверхности и характеризовались подвижностью
при функционировании в условиях отсутствия прочного контактного взаимодействия
с костной тканью. После извлечения образцов из костей лабораторных животных по
истечении 50 суток клинического испытания на поверхности отсутствовали выраженные
фрагменты костного регенерата, что свидетельствует о крайне низкой
эффективности применения таких имплантатов при внешнем чрескостном остеосинтезе
(рис. 4).
Титановые и стальные образцы с металлооксидными покрытиями обладали выраженной микроостеоинтеграционной способностью. После завершения клинических испытаний на их поверхности формировалось повышенное количество костного регенерата. Так, при извлечении стержней из организма животных наблюдалось присутствие на оксидированной поверхности значительного объема новообразованной костной ткани, прочно соединенной с имплантатами (рис. 5). Это свидетельствует о протекании на поверхности покрытий интенсивного костеобразования и о выраженной микроостеоинтеграционной способности оксидированных имплантатов.

Рис.
4. Внешний вид стержневых имплантатов без металлооксидного покрытия после испытания
in vivo: а – титановый (ВТ6)
имплантат; б – стальной (12Х18Н9Т) имплантат
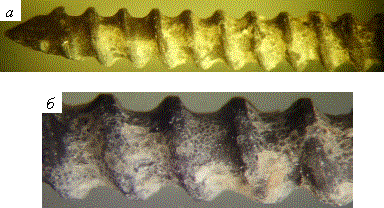
Рис. 5. Внешний вид
стержневых имплантатов с паротермическим металлооксидным покрытием после
испытания in vivo: а – титановый (ВТ6)
имплантат; б – стальной (12Х18Н9Т) имплантат
Таким образом,
чрескостные имплантаты из титанового сплава ВТ6 и нержавеющей хромоникелевой
стали 12Х18Н9Т с паротермическим металлооксидным покрытием способны прочно
закрепляться в кости за счет микроинтеграционного взаимодействия поверхности с
окружающими костными структурами. Поэтому применение разработанных
биосовместимых покрытий остеоинтеграционного типа обеспечивает повышенный уровень
приживляемости ортопедических имплантатов и высокую медико-техническую эффективность
их использования в составе аппаратов внешней фиксации при чрескостном остеосинтезе.
Разработан технологический
маршрут создания чрескостных металлических имплантатов с биосовместимыми
остеоинтеграционными покрытиями, получаемыми термической обработкой в атмосфере
перегретого водяного пара, включающий ряд операций подготовки поверхности перед
формированием оксидных покрытий и нанесение покрытий способом паротермического
оксидирования при установленных рациональных технологических режимах (рис. 6).
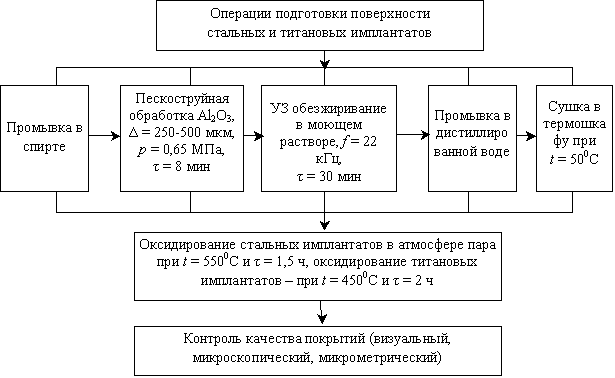
Рис. 6. Маршрутная
технологическая схема изготовления чрескостных ортопедических имплантатов с
биосовместимыми металлооксидными покрытиями остеоинтеграционного типа
Предварительная обработка поверхности имплантатов осуществляется воздушно-абразивным
воздействием путем пескоструйной обдувки корундовым абразивом для создания
выраженной микрошероховатой структуры.
После пескоструйной обдувки шероховатые имплантаты обрабатываются
методом ультразвуковой очистки в моющем растворе 40 г/л Na3РО4 в течение
25-30 мин при частоте ультразвуковых колебаний f=22 кГц и интенсивности W=1,2
Вт/см2 для удаления загрязнений различной химической природы.
Очищенные имплантаты промываются в дистиллированной воде для удаления
компонентов моющего раствора и высушиваются в термошкафу до полного удаления
влаги с поверхности.
Затем предварительно подготовленные изделия подвергаются процессу паротермического
модифицирования с получением оксидного биосовместимого покрытия.
Сегодня
исследования в области создания ортопедических имплантационных конструкций с
биосовместимыми металлооксидными покрытиями ведутся по следующим актуальным направлениям:
- определение физико-химических факторов, оказывающих
влияние на взаимосвязь оксидированных поверхностей металлических имплантатов с
костными клеточными структурами, а также на характер взаимодействия получаемых
металлооксидных соединений с жидкими биосредами (кровью, лимфой, тканевой жидкостью).
- установление физико-химических факторов, влияющих на
контактное взаимодействие металлооксидов и биоструктур без протекания
аллергенных реакций и канцерогенных явлений; исследование
структурно-морфологических изменений на контактной границе «металлооксиды-биосреда».
- исследование механизмов химических превращений,
протекающих на оксидированных поверхностях имплантатов при их взаимодействии с
биосистемами.
- установление закономерностей взаимосвязи свойств
металлооксидов от технологических условий их получения.
- изучение влияния металлооксидных покрытий,
модифицированных бактерицидными химическими элементами (лантан, серебро, медь)
и остеостимулирующими веществами (гидроксиапатит, фторгидроксиапатит и др.), на
процессы и явления, протекающие в костной ткани и жидких биологических средах
(кровь, лимфа, тканевая жидкость).
- разработка методики оценки биологической совместимости
и остеоинтеграционной способности материалов и покрытий на основе нетоксичных металлооксидных
соединений.
- исследование влияния фазово-элементного состава
модифицированных (лантан-, медь- и серебросодержащих) металлооксидов на
процессы химических превращений в окружающих биологических жидкостях организма.
- экспериментальная оценка отсутствия либо присутствия
металлоза взаимодействующих с металлооксидами биотканей, т.е. явления перехода
атомов имплантируемого вещества в контактирующую биосреду, что вызывает, как
правило, существенные воспалительные процессы с протеканием аллергенных
химических реакций.
- разработка фундаментальных основ и формулировка
комплекса принципов создания имплантационных металлооксидных систем, способных
длительное время функционировать в организме, не вызывая в его структурах протекание
иммунных реакций и вредных биохимических явлений.
Выводы
Методом паротермической модификации получены биосовместимые металлооксидные покрытия остеоинтеграционного типа на чрескостных стержневых имплантатах из титанового сплава ВТ6 и нержавеющей стали 12Х18Н9Т. Проведены исследования фазового состава и поверхностно-структурных характеристик покрытий и установлено, что шероховатая микропористая структура металлооксидов способствует протеканию микроостеоинтеграционных процессов с ускоренным формированием на поверхности оксидированных имплантатов новообразованной костной ткани при прочном закреплении имплантируемых конструкций в кости.
Список литературы
1. Биосовместимые материалы: Учебное пособие / Под ред. В.И. Севастьянова, М.П. Кирпичникова. М.: ООО «Медицинское информационное агентство», 2011, 544 с.: ил.
2. Штильман М.И. Полимеры медико-биологического назначения. М.: ИКЦ «Академкнига», 2006, 400 с.
3. Бейдик О.В., Бутовский К.Г., Островский Н.В. и др. Моделирование наружного чрескостного остеосинтеза. Саратов: Изд-во СГМУ, 2002. 198 с.
4. Родионов И.В. Костные металлоимплантаты с оксидными биосовместимыми покрытиями / Сб. трудов XV Междунар. научн.-практ. конф. «Современные техника и технологии». Томск: Изд-во ТПУ, 2009. Т.1. С. 569-571.
5. Родионов И.В. Оксидирование медицинских имплантатов в комбинированной
инертно-окислительной газовой смеси //
Технологии живых систем. №3, 2010. С. 14-22.
6. Корж Н.А. Имплантационные материалы и остеогенез. Роль биологической фиксации и остеоинтеграции в реконструкции кости / Н.А. Корж, Л.А. Кладченко, С.В. Малышкина и др. // Ортопедия, травматология и протезирование. 2005. №4. С. 118-127.
7. Корж Н.А. Имплантационные материалы и остеогенез. Роль индукции и кондукции в остеогенезе / Н.А. Корж, В.А. Радченко, Л.А. Кладченко, С.В. Малышкина // Ортопедия, травматология и протезирование. 2003. №2. С. 150-157.
8. Корж Н.А. Имплантационные материалы и остеогенез. Роль оптимизации и стимуляции в реконструкции кости / Н.А. Корж, Л.А. Кладченко, С.В. Малышкина // Ортопедия, травматология и протезирование. 2008. №4. С. 5-14.
9. Хлусов И.А. Генез костной ткани на поверхности
имплантатов для остеосинтеза / И.А. Хлусов, А.В. Карлов, И.В. Суходоло // Гений
ортопедии. 2003. №3. С. 16-26.